徳田 均*
*JCHO東京山手メディカルセンター呼吸器内科(〒169-0073 東京都新宿区百人町3-22-1)
Bronchiectasis revisited(1)
Hitoshi Tokuda*
*Department of Respiratory Medicine, Tokyo Yamate Medical Center, Japan Community Health Care Organization (JCHO), Tokyo
Keywords:気管支拡張症,病態,免疫,びまん性気管支拡張症,末梢気道病変/bronchiectasis, pathogenesis, immunity, diffuse bronchiectasis, small airway disease
呼吸臨床 2017年1巻2号 論文No.e00011
Jpn Open J Respir Med 2017 Vol. 1 No. 2 Article No.e00011
DOI: 10.24557/kokyurinsho.1.e00011
受付日:2017年9月27日
掲載日:2017年11月22日
©️Hitoshi Tokuda. 本論文の複製権,翻訳権,上映権,譲渡権,貸与権,公衆送信権(送信可能化権を含む)は弊社に帰属し,それらの利用ならびに許諾等の管理は弊社が行います。
気管支拡張症は,慢性下気道感染症に分類される疾患群であるが,近年その病像は大きく変貌してきており,欧米ではその成立機序,病態,治療法などについて活発な議論が展開されている[1-5]。しかしわが国ではこの疾患群についての議論は最近ほとんど行われていない。これには慢性下気道感染症の1つ,わが国でその疾患概念の確立から病態,治療法まで大きな展開をみたびまん性汎細気管支炎(diffuse panbronchiolitis:DPB)の新規発生が激減し,ここに集中していた国内の専門家の関心とエネルギーが行き場を失っているという事情もあろうかと推察される。
しかし診療の場を訪れる気管支拡張症の患者は確実に増えており,マクロライドを含む既知の治療に不応で,咳,痰,呼吸困難などの症状に苦しむ患者も多い。これに対して,どう考え,どのように対処すべきか,問題は切実度を増している。
本稿では,この古くて新しい病気,気管支拡張症について,現在までにわかっている知識を整理し,病態についての最近の学説を紹介し,治療法についても,エビデンスに基づいて今何が言われているかに加え,筆者の臨床経験に基づき新しい治療の可能性をも考察したい。
第1部では,疾患概念,疫学,病態をまとめる。
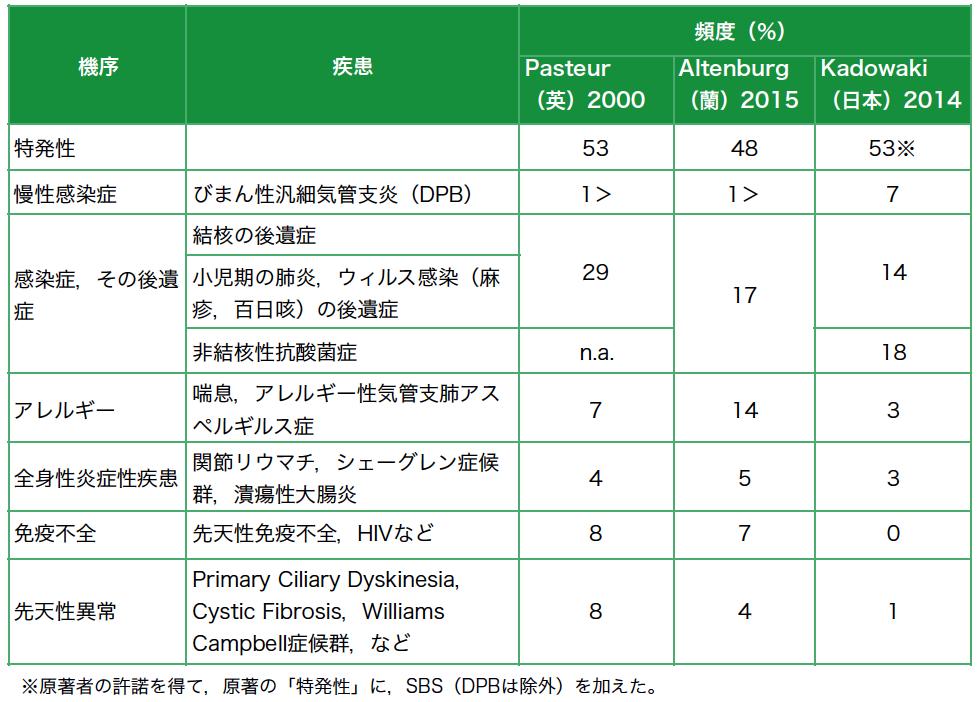
気管支拡張症(bronchiectasis:BE)とは,気管支(亜区域枝~小気管支)が持続性炎症の結果,径の拡張をきたす病態を指す呼称である[1][2][3]。拡張という形態学的変化に対して与えられる名称であり,単一の疾患ではなく,さまざまな疾患,病態の気管支における発現として理解されている。特定の基礎疾患が見出されない場合特発性と呼ぶが,現在これが約1/2を占め,臨床上の大きな問題となっている[5][6][7](図1)。
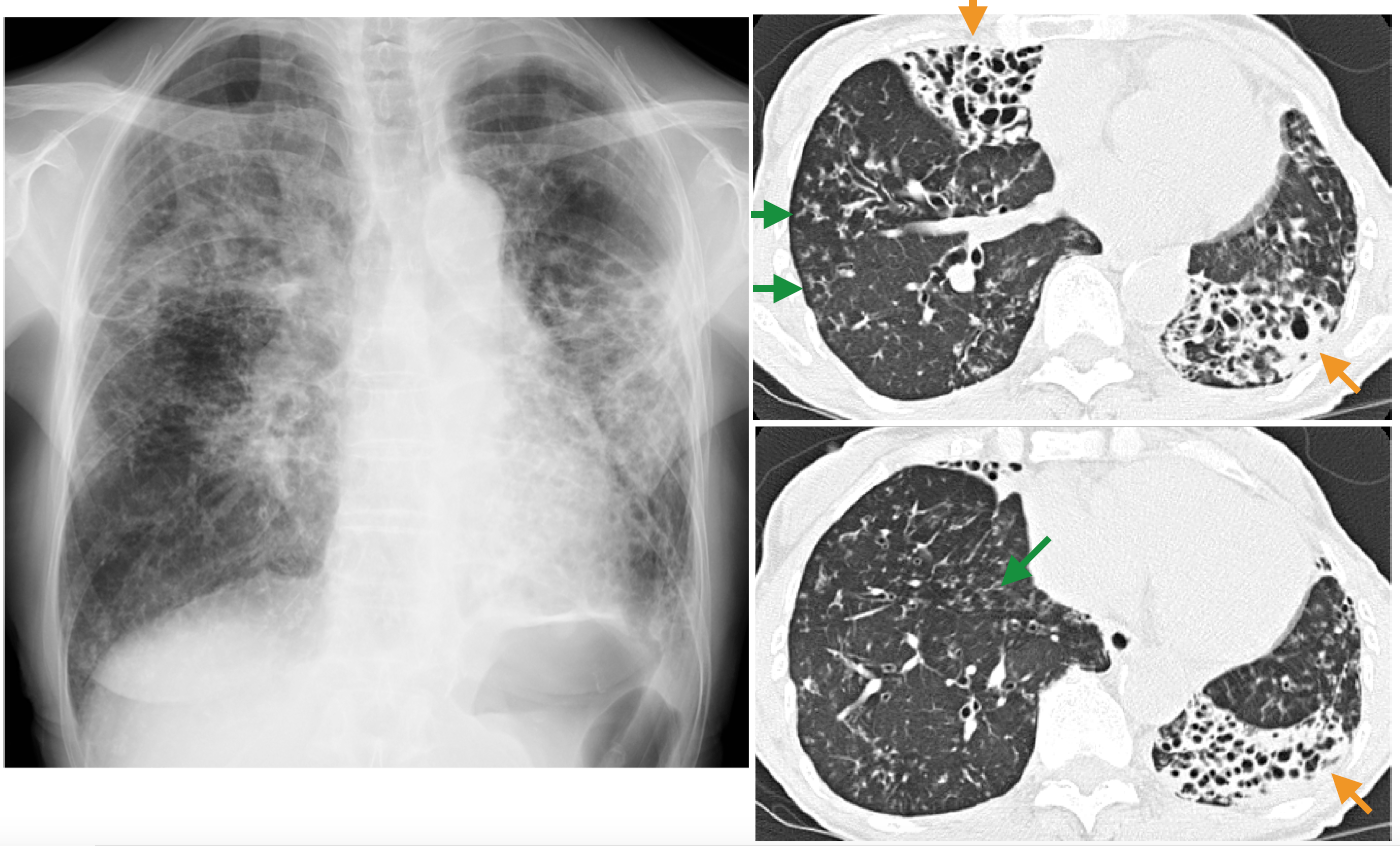
図1 びまん性気管支拡張症の典型例
a.胸部単純写真:63歳,女性。結核や小児期の肺炎の既往はない。20年前から断続的に咳,痰に苦しんできた。両側肺野に多発性に区域性浸潤影がある。その中には多数の透亮像が認められる。左肺の収縮は著しく,縦隔は左に偏位している。
b, c.HRCT:右中葉,左下葉に高度の気管支拡張とその周囲肺の虚脱を見る(→)。両側肺野に小葉中心性の粒状影・分岐状影が見られ(→),細気管支炎の所見。
以前は重い肺感染後(結核,小児期の肺炎)に成立し,以後感染を繰り返しつつ徐々に悪化してゆく疾患と理解されていた。その治療も,去痰薬や理学療法による喀痰の排除,感染増悪時の対応などと,消極的なものであった。このようなBEは,抗菌薬の普及,小児への広範なワクチン接種などによりその頻度は減少し,注目度も低下,BEは一時,先進工業国においてはorphan disease と呼ばれたこともある。しかし近年世界的に再び注目されているのは,頻度の増加とともに,これといった基礎疾患がなく,病変は広範で,咳,痰などの症状が制禦困難,あるいは高度の閉塞性障害が進行する特発性,びまん性BEの増加,また関節リウマチ(rheumatoid arthritis:RA),潰瘍性大腸炎(ulcerative colitis:UC)などの全身性炎症性疾患においても本症が多く見出され[8-12],その成立機序に特発性BEとの対比,関連において関心がもたれている,という事情がある。またその治療においても,工藤らにより提唱されDPBに高い有効性が示されたマクロライドの少量長期投与が[13],BEにおいても有効であるとのエビデンスが徐々に蓄積されているが[14],マクロライド不応例も臨床の場では多く,治療はいまだ模索段階にあり,多くの研究が積み重ねられつつある。
さまざまな疾患が基礎疾患として挙げられる。最近のオランダ,英国,日本の報告におけるこれらの頻度を表1に示す[5-7]。特に英国からの報告は,前向き,かつすべての因子についての綿密な検討を全例に行うなど,徹底したものである[6]。先天性異常(原発性線毛機能不全/primary ciliary dyskinesia,嚢胞性線維症/cystic fibrosis:CF,など)は1~8%,先天性免疫不全は8%以下と,いずれも比較的まれなものである。RAその他の自己免疫疾患も3~5%とされるが,これは膠原病科との連携など施設の性格にもよるであろう。以前は主因の座を占めていた感染後は,大きく減少し,非結核性抗酸菌症(non-tuberculous mycobacteriosis:NTM症)を別に数えれば14~29%である。最も多いのは特発性であり,50%前後を占める。
表1 気管支拡張症の原因疾患とその頻度
Kadowakiの報告は最近の日本国内の数値として貴重であるが[7],特発性のほかに副鼻腔気管支症候群(sino-bronchial syndrome:SBS)との1項を設けているが,海外のデータとの整合性のために,表1では原著者の許可を得て,筆者の考えで,SBSとの項からDPB以外のものを特発性に含めて算定した。SBSは後で述べるように症候群であり,疾患ではないとの考えに基づく。その結果はやはり特発性が52%となった。
BEはまたその病変分布から,一葉に限局する限局性と,複数の葉に広がるびまん性とに分類されてきた。限局性BEは,結核,小児期の感染などの既往をもち,全身的な素因は少なく,外科的切除で治癒することもあり得る。一方びまん性BEは,上記,特発性にほぼ合致し,副鼻腔炎の既往,合併が多いなど,何らかの素因の関与が疑われる例が多い[1]。
これらの大部分において,その基本的病態は気道における過剰な炎症であるとの認識が広く共有されている。これは特発性のみならず,ヒト免疫不全ウイルス(human immunodeficiency virus:HIV)などの免疫低下宿主,CFなどの先天性異常においても共通することである[2][3][4]。
----------------------------------------------------------------------------------
副鼻腔気管支症候群(SBS)は,慢性副鼻腔炎と慢性下気道感染症(DPB,BE)の合併する病態を指す言葉で,何らかの病因的つながりが想定されるとしてわが国でしきりに取り上げられたが[17][18],欧米でもその名称こそ使わないもののこの両者が高率に合併するとの指摘は以前から多い[1][6][16]。あるいはRAの気道病変についても,HayakawaはRA患者の気道病変(BE,細気管支炎)に副鼻腔炎の合併率が高いことを指摘し,気道全体に炎症が発生,進行すると考察している[19]。副鼻腔と下気道がさまざまな点で共通の特性を有することは確かで,このSBSなる語は特別の疾患を指すというより,上気道,下気道併せ気道全体に過剰な炎症の起こりやすさがあることを示す語として用いられるのが適切と思われる。
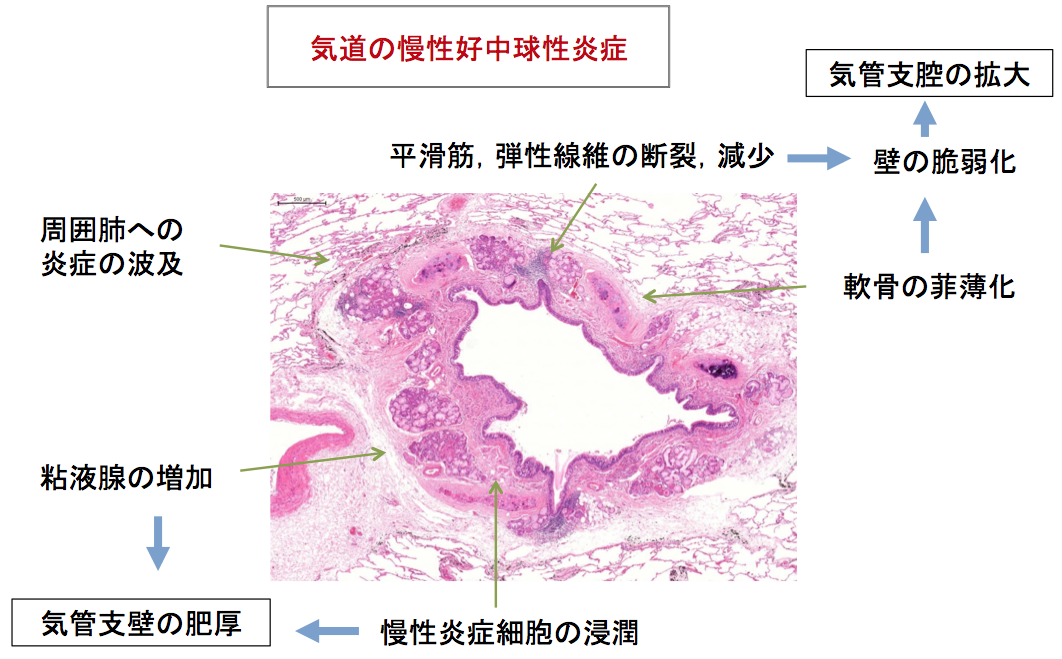
すべてのBEに共通する病態として,気道における過剰な炎症との捉え方が定着している[1-4][23][24]。古典的には,何らかの原因でひとたび気管支の脆弱部分が成立すると,そこに細菌の定着が起こり,それに対する過剰な免疫応答の結果持続性の炎症が起こり,気管支の構造保持組織である弾性線維,平滑筋,軟骨などが破壊され,構造改変が進行する,さらに粘液の過剰分泌,クリアランス能の低下(線毛運動の低下,気道マクロファージの機能低下)などが加わって細菌の定着が助長されそれが更に炎症を促進する,という悪性サイクルに入る,と説明される[3][4](図2)。
図2 病理から見た気管支拡張症の成立機序
(病理写真:武村民子先生ご提供)
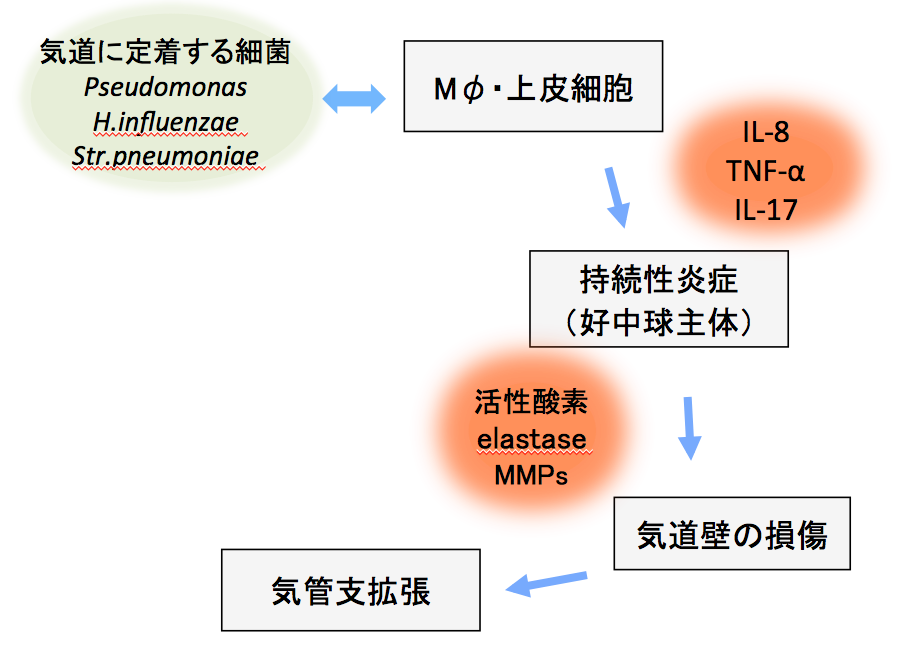
炎症の主役は好中球で,それをドライブするさまざまなサイトカイン(IL-8,TNF-αなど)は,菌を認識したマクロファージ,気道の上皮細胞,Tリンパ球などから放出される。活性化された好中球はelastase,reactive oxygen,matrix metalloproteinases(MMPs)などを放出し,組織破壊を引き起こす[24][25](図3)。
図3 最近の免疫学的研究から明らかになった気管支拡張症の病態
(文献[24]に基づき筆者が作成)
しかしこの理論では,最初の拡張がなぜ起こるのか説明できない。特発性BEにおいては小児期の重い感染のエピソードなどは確認されず,咳,痰の症状に長期間苦しみ発見されたときはびまん性の広がりとなっている,また小児期より上気道感染のたびに咳,痰が長引く,また慢性副鼻腔炎の合併率が高いことなどから[1][6][16],何らかの遺伝的素因をもった個体に環境因子などが加わり,気道において異常に亢進した免疫応答が持続性に起こると考えられるが[2][4],詳細は未解明である。
BEにおける過剰免疫(サイトカインネットワークの発現)については近年急速に研究が進み,まったく新たな視野も展開されてきている。
気道のサイトカインの過剰は,必ずしも定着している細菌量とは関係しない。Angrillらは,安定期のBE49例に気管支肺胞洗浄(broncho-alveolar lavage:BAL)を施行し,炎症性サイトカインや炎症細胞を検討した報告で,菌の定着が見られないBEにおいて既に好中球やIL-8の増加が見られ,菌の定着,その菌量の増加とともにこれらの炎症に関わる因子は急増するとしている[2[5]。近年の最大のトピックスは,皮膚,腸管など外界に接する臓器における常在細菌叢としてのmicrobiomeの発見と,それがヒトのさまざまな慢性炎症性疾患の成り立ちに関わることが明らかになったことである。気道も例外ではない。新世代ゲノムシークエンサーの本格的な応用が始まり,人体のあらゆる部位のmicrobiomeが調査されつつある(Human Microbiome Project)。その中で下気道,肺についても研究が展開中で,最近まで下気道~肺は無菌であると信じられてきたが,喀痰,BAL液や切除肺を検体として最新の遺伝子解析技術を用い16sRNAなどを検索することにより,培養法では検出できなかったさまざまな菌(嫌気性菌など)が存在すること,またこれらが気道粘膜を介して宿主と活発な免疫応答をもっていること(mucosal immunity),またそれら細菌叢の乱れ(dysbiosis)が,宿主免疫の乱れ(dysregulation)を引き起こし,これが気道の慢性炎症性疾患(BE,COPD,気管支喘息)の成立に密接に関与していることが明らかにされつつある[26][27][28]。
今後これら慢性炎症性肺疾患の成り立ちを考えるうえで,このmicrobiome仮説は中心的な位置に上っていくことは確実である。このような進歩を踏まえ,Boytonらは,BEの炎症の発生,持続には,いくつかの遺伝子の密接な関与を認めつつ,肺のmicrobiomeの乱れ(感染,炎症,抗菌薬などによって引き起こされる)が宿主の免疫応答に大きな影響を与え,Th17系を介した好中球の動員を主としつつ,ほかに,NK細胞の活性化も加わり,炎症がさらに強化される,との筋道を描いている[2]。
このような研究はいまだ緒についたばかりで,決定的な成果が上がっているわけではないが,今後急速な進展が期待される。
利益相反:なし。