【投稿/症例報告】KL-6を疾患活動性の指標にステロイドを漸減できた抗ARS抗体陽性間質性肺炎の長期観察例

藤原清宏
なにわ生野病院呼吸器内科(〒556-0014 大阪府大阪市浪速区大国1-10-3)
Long-term observation of anti-ARS antibody-positive interstitial pneumonia with steroid tapering using KL-6 as an indicator of disease activity: A case report
Kiyohiro Fujiwara
Department of Respiratory Medicine, Naniwa Ikuno Hospital, Osaka
Keywords:間質性肺炎,抗ARS抗体,KL-6/interstitial pneumonia, anti-ARS antibody, KL-6
呼吸臨床 2023年7巻11号 論文No.e00181
Jpn Open J Respir Med 2023 Vol. 7 No.11 Article No.e00181
DOI: 10.24557/kokyurinsho.7.e00181
受付日:2023年9月19日
掲載日:2023年11月21日
©️Kiyohiro Fujiwara. 本論文はクリエイティブ・コモンズ・ライセンスに準拠し,CC-BY-SA(原作者のクレジット[氏名,作品タイトルなど]を表示し,改変した場合には元の作品と同じCCライセンス[このライセンス]で公開することを主な条件に,営利目的での二次利用も許可されるCCライセンス)のライセンシングとなります。詳しくはクリエイティブ・コモンズ・ジャパンのサイト(https://creativecommons.jp/)をご覧ください。
症例は84歳女性で,呼吸困難のため前医に入院加療となり,間質性肺炎の急性増悪の発症と診断され,ステロイドパルス療法などで病状は改善した。急性増悪から10カ月後に当院紹介となった。抗ARS抗体を測定したところ陽性であり,多発性筋炎/皮膚筋炎の臨床所見を認めず,抗ARS抗体陽性間質性肺炎と診断された。ステロイド漸減中に間質性肺炎の再増悪は認めず,経時的に測定したKL-6は病勢と一致して再上昇することはなかった。一方,抗ARS抗体は高値に推移した。
抗アミノアシルtRNA合成酵素抗体(抗ARS抗体)は,多発性筋炎/皮膚筋炎の25〜30%に検出される自己抗体である。抗ARS抗体陽性例では間質性肺疾患(ILD),筋炎,関節炎を高頻度に合併し,抗ARS抗体症候群と呼ばれているが,ILDのみの症例もみられる。近年,いずれの自己免疫疾患の診断基準も満たさないものの,自己免疫疾患の特徴を有するILDを検討するための基準としてinterstitial pneumonia with autoimmune features(IPAF)が提唱されている。今回,抗ARS抗体陽性間質性肺炎の1例を経験したので文献的考察を含めて報告する。
症例:84歳,女性。
主訴:労作時呼吸困難。
既往歴:高血圧症。
家族歴:特記事項はない。
生活歴:喫煙歴なし。飲酒歴なし。
吸入歴:特記事項なし。
ペット飼育歴:特記事項なし。
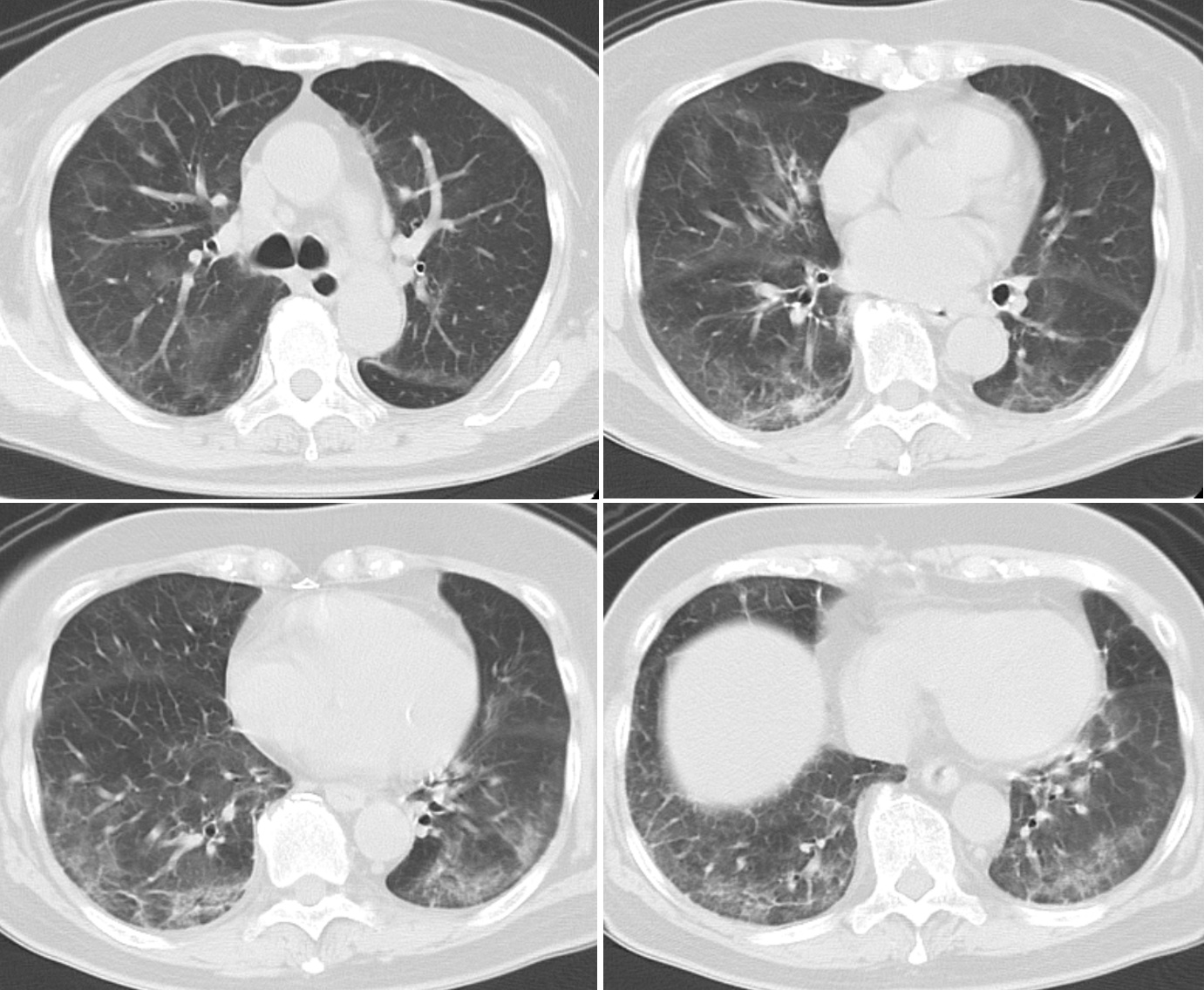
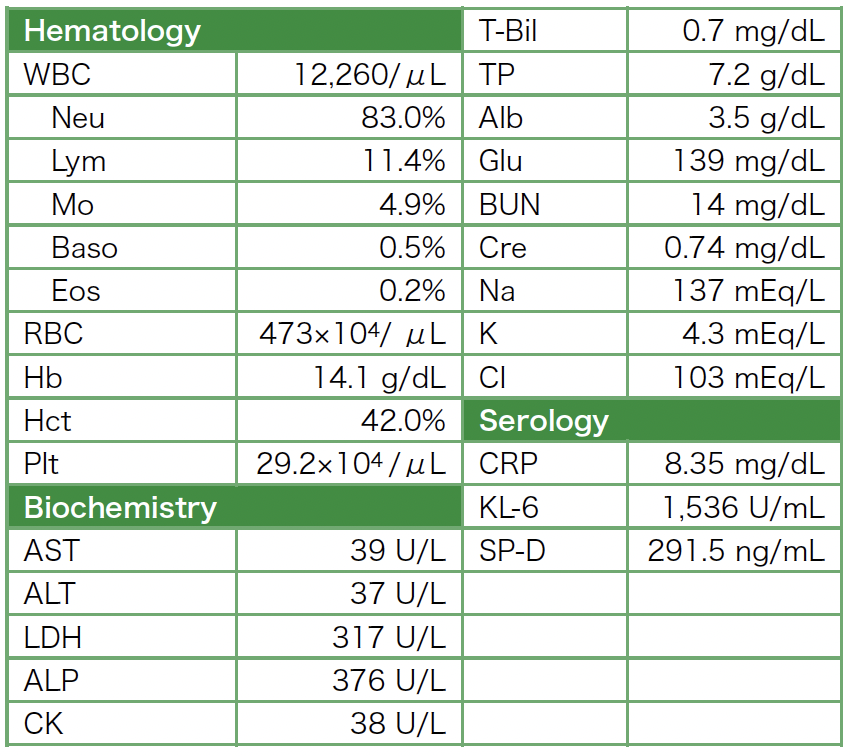
現病歴:前医に入院2週間前から咳嗽があり,呼吸困難が次第に増強するため,近医で胸部X線像上肺炎像を指摘され,同日に前医に入院となった。胸部CT(図1)では,両側とも下肺野の背側優位に広範囲にすりガラス陰影を認められた。後方視的には,すりガラス陰影はsubpleural sparingが認められ,非特異性間質性肺炎(NSIP)に合致する所見であった。入院時の検査所見(表1)では,白血球増多,LDH,KL-6,SP-Dの上昇が認められた。間質性肺炎の急性増悪と診断され,ステロイド・パルス療法としてメチルプレドニゾロン1,000mg/日 3日間で治療開始となり,後治療としてプレドニゾロン1mg/kg/日から漸減する方針となった。また,喀痰検査で明らかな起炎菌は検出されなかったが,細菌性肺炎を考慮し,抗菌薬治療も行った。呼吸管理については,気管挿管で人工呼吸を10日間行われ,抜管後,非侵襲的陽圧換気療法を約1カ月間施行され,以後,酸素吸入は経鼻カニューレ 2L/分で対応可能であった。入院後2カ月目に脳梗塞を発症し,点滴治療,抗血小板薬の投与が行われ,リハビリテーションを行いつつ,経管栄養も行われた。入院後5カ月目に誤嚥性肺炎となり,抗菌薬で改善した。誤嚥性肺炎発症時の胸部CT像は,図2に示すように,両側下肺野の背側にコンソリデーションを認められ,その周囲にすりガラス陰影がみられ,コンソリデーション内部にエアーブロンコグラムがみられた。経管栄養中であり,食道内腔にチューブがみられた。入院後7カ月目から経口摂取可能となった。プレドニゾロン7mg/日まで漸減され,急性増悪から10カ月目に退院となり,在宅酸素療法を導入され,当院に紹介受診となった。
図1 前医初診時の胸部CT像
両側下肺野背側優位に広範囲にすりガラス陰影を認め,胸膜下の領域は比較的保たれており,subpleural sparingを呈している。
表1 前医入院時検査所見
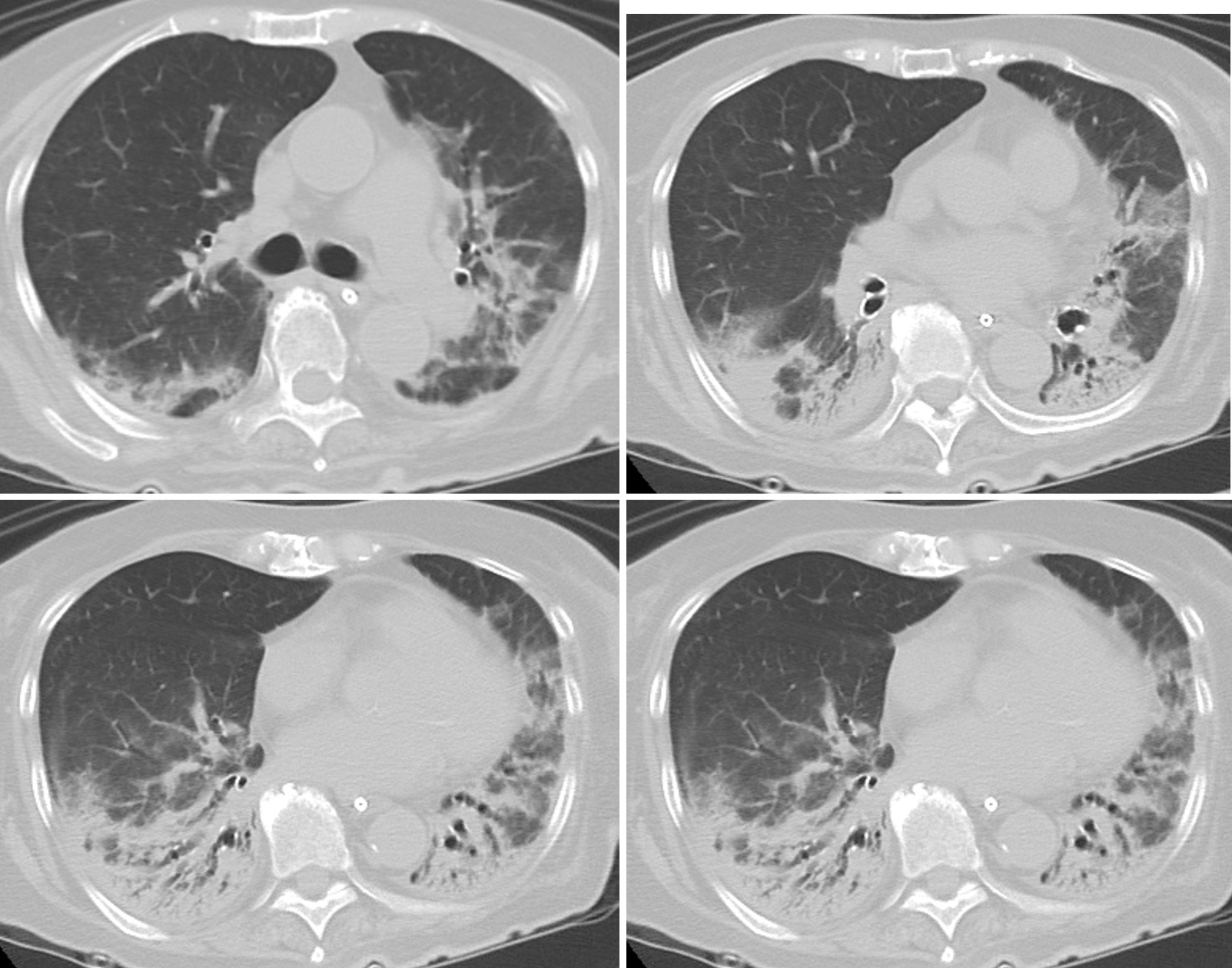
図2 間質性肺炎の急性増悪後4カ月目の胸部CT像
両側下肺野背側にコンソリデーションを認められ,周囲にすりガラス陰影がみられる。コンソリデーション内部はエアーブロンコグラムがみられる。
入院時現症:身長147cm,体重37kg。意識清明。体温36.5℃。脈拍102/分,血圧112/60mmHg。聴診上,胸部両側に乾性ラ音を聴取した。心音は整で心雑音は聴取せず。SpO2 96%(経鼻カニューレ 酸素 2L/分)。四肢の関節や筋肉に腫脹・圧痛はなく,Mechanic’s hand,Raynaud徴候など膠原病を示唆する身体所見は認めなかった。
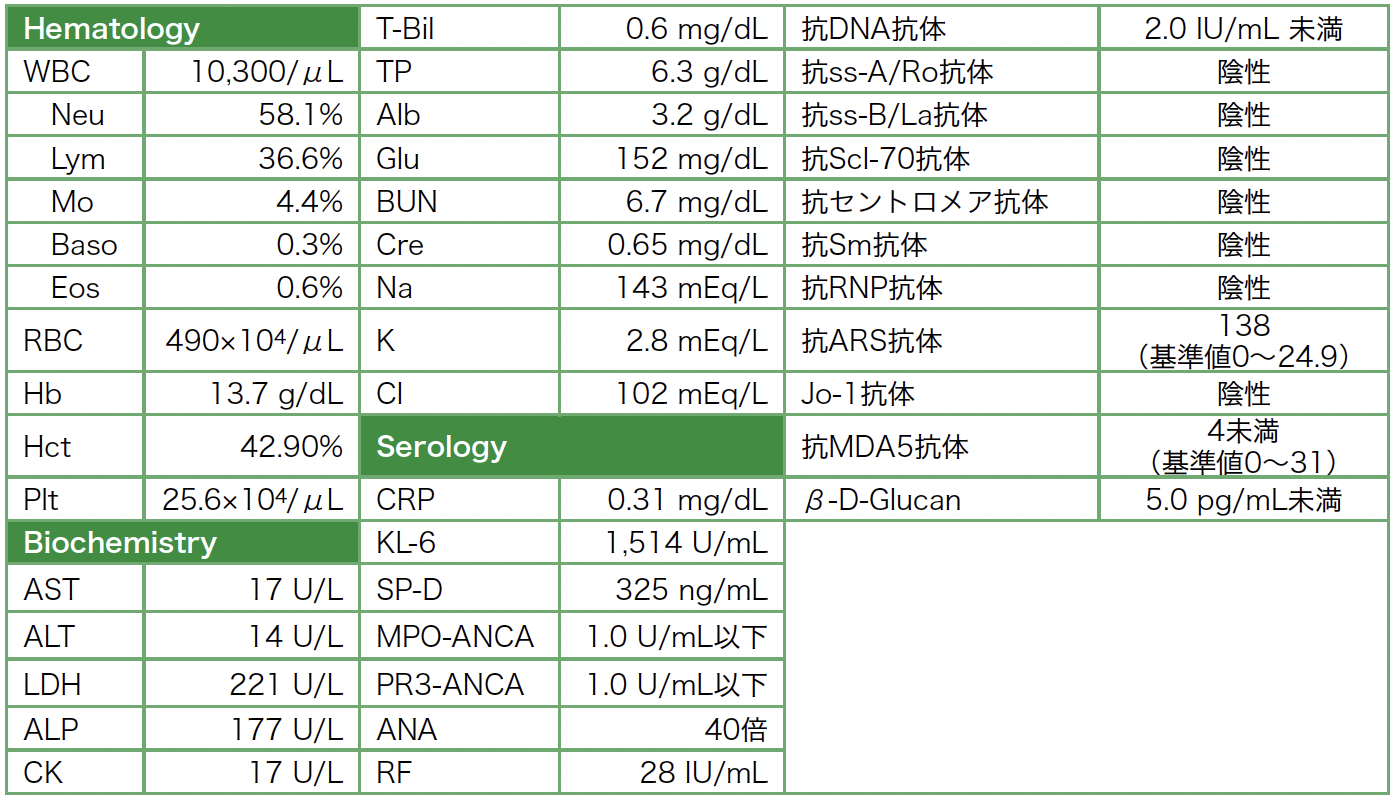
入院時検査所見(表2):膠原病関連のマーカーも検査したところ,抗ARS抗体は陽性,Jo-1抗体は陰性であったが,その他の抗ARS抗体は測定していない。抗MDA5抗体は陰性であった。
表2 入院時検査所見
入院時胸部CT像(図3):両側下肺野背側を中心に広範囲にコンソリデーションを伴う気管支拡張を認め,その周囲に網状影やすりガラス陰影がみられ,下葉の容積減少が認められた。CT像の背景病理としては,NSIP+organizing pneumonia,fibrosing organizing pneumonia,急性肺傷害などが相当すると考えられた。
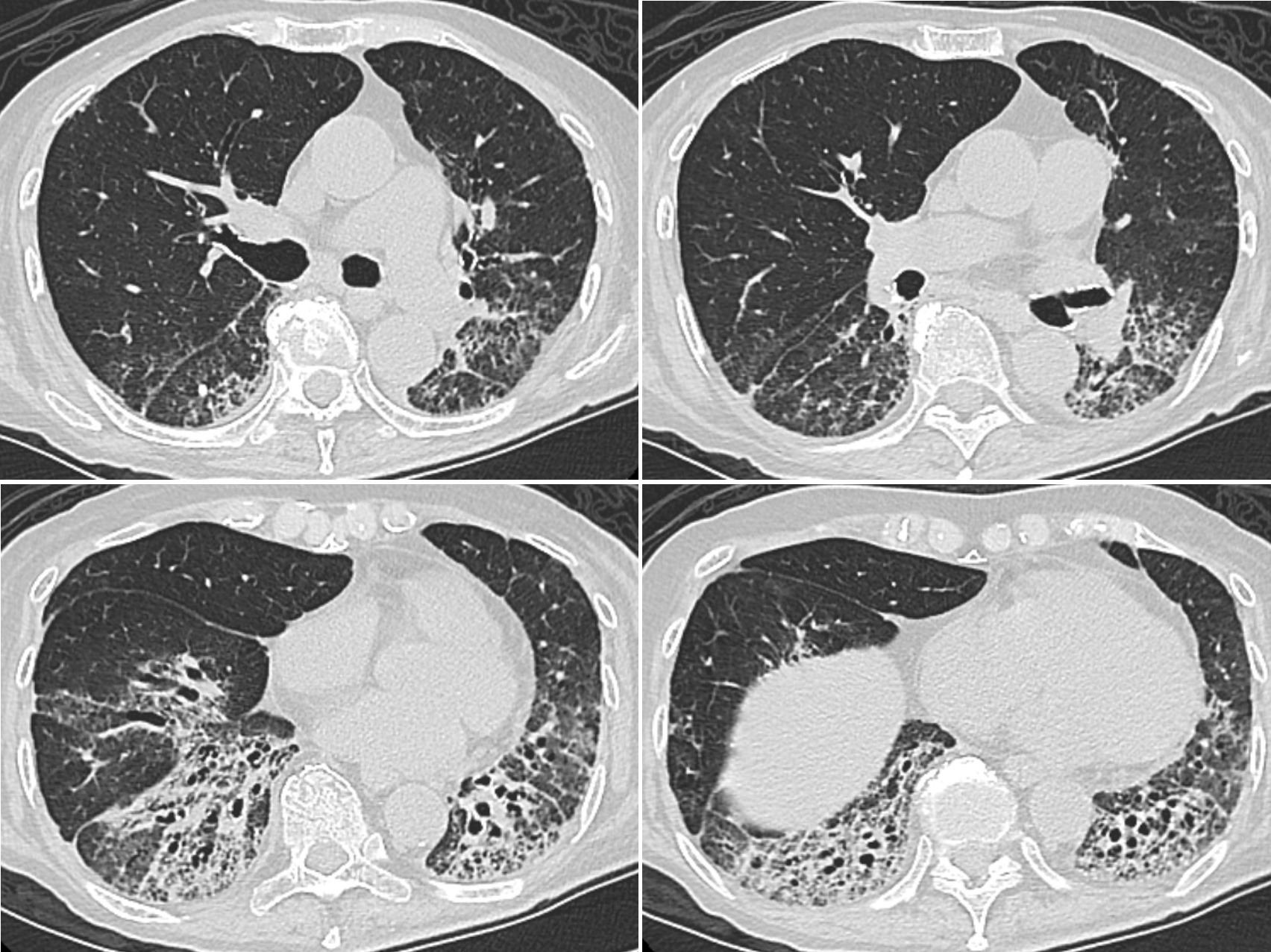
図3 間質性肺炎の急性増悪後10カ月目で当院初診時の胸部CT像
両側下肺野背側を中心に広範囲にコンソリデーションを伴う気管支拡張を認め,その周囲に網状影やすりガラス陰影がみられ,下葉の容積減少が認められる。
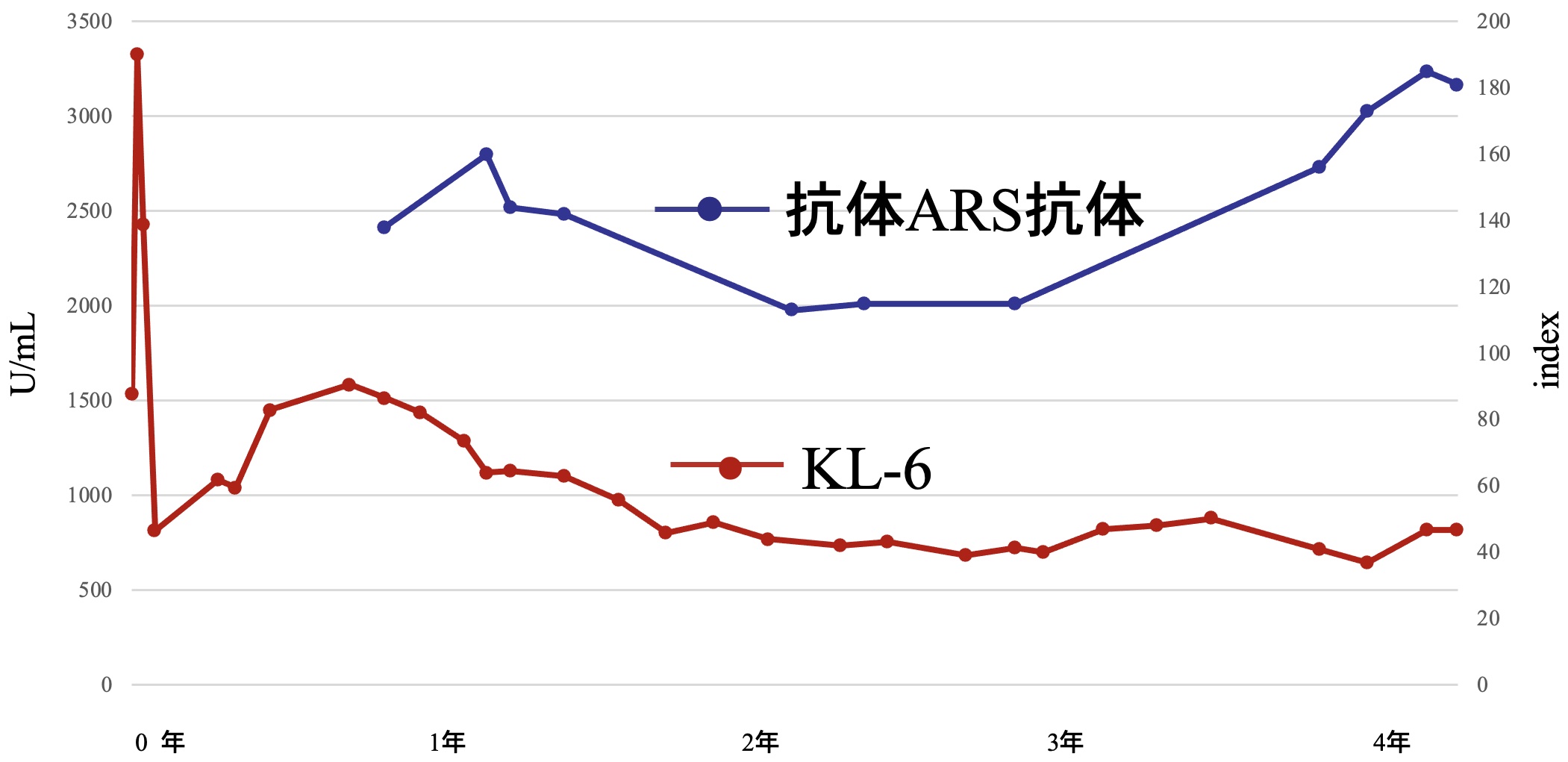
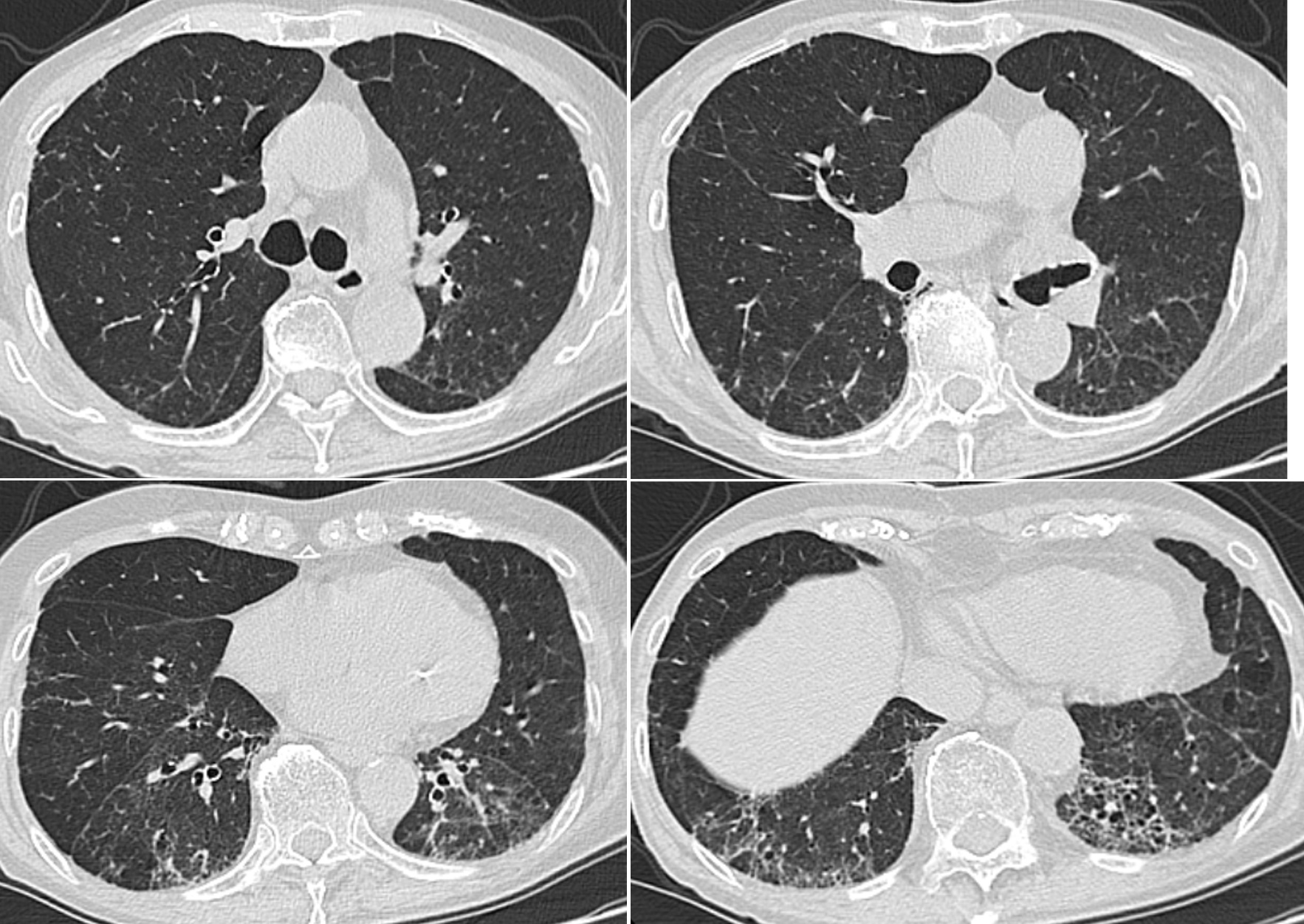
当院での経過:血液検査所見と胸部CT像から抗ARS抗体陽性間質性肺炎と考えられ,プレドニゾロン7mg/日を継続投与とした。KL-6と抗ARS抗体を経時的に測定した(図4)。KL-6は急性増悪時に高値であったが,以後,著しい再上昇はなく,急性増悪時より2年目頃から1,000 U/L以下を維持していた。一方,当院で測定開始した抗ARS抗体は,3年以上,陽性のまま推移した。なお,経過中,CKの上昇はなかった。胸部CTで改善は漸次進み,急性増悪後46カ月経過したCT像(図5)では,両側下葉の容積減少は残っているが,コンソリデーションは消失し,線維化部位の拡大はなかった。当院で診療を引き継いで,2年後からプレドニゾロン5mg/日に減量した。急性増悪を発症してから,4年間再発なく経過し,酸素吸入は経鼻カニューレで安静時 1L/分,労作時 2L/分で安定している。
図4 KL-6と抗ARS抗体の推移
KL-6:基準値 0〜499U/mL,抗ARS抗体:基準値 0〜24.9
図5 間質性肺炎の急性増悪後46カ月目の胸部CT像
両側下葉は容積減少のままであるが,線維化部位は縮小している。
抗アミノアシルtRNA合成酵素(ARS)抗体症候群(ASS)とは筋炎特異的抗体の1つである抗ARS抗体が陽性である一群をいう。陽性例の多くが,筋炎に加えてILDや多発関節炎など類似した臨床像を呈するため,1つの疾患群として認識されるようになった[1]。
抗ARS抗体症候群のILDは,早稲田[1]によると①経過にて改善し,ほとんど陰影が消失するもの,②いったん改善するが,その後線維化が軽度残存するが進行のないもの,③いったん改善するが,その後明らかに線維化が進行していくものがあり,非常に多彩であるとしている。CT所見としては,すりガラス陰影,網状影,コンソリデーションが多くみられ,分布としては下肺野,気管支血管束周囲,末梢にみられ,下葉の容積減少を伴うことが多いとしている[1]。Hozumiら[2]によるとNSIPパターンが最も一般的であるが,器質化肺炎(OP),びまん性肺胞障害(DAD),通常型間質性肺炎(UIP)およびこれらの特徴を伴う混合パターンもあるとしている。抗ARS抗体症候群の発症と進行のパターンについてPalmucciら[3]は以下のように述べている。すなわち,無症候性/潜在性の場合はCTで最小限の変化が見られるか見られない程度である。急速に進行する場合は急性間質性肺炎やDADによって急性呼吸窮迫症候群を呈する。亜急性/慢性の場合はCTでコンソリデーションまたはすりガラス陰影を呈し,OP,NSIP,OP/NSIPのパターンを呈するとしている。自験例はNSIPパターンであり,急性増悪や誤嚥性肺炎を経過した後,改善が認められた。
KL-6は間質性肺炎に対する血清マーカーとして診断や病勢把握として実地臨床で頻用されている。ASSにおいても間質性肺炎の活動性と再発について,相関関係のあるKL-6を経時的に測定して,モニタリングは有用であることをYamaguchiら[4]は述べている。肺機能検査は呼吸器症状のある患者では,困難な場合があり,CT撮影を頻繁に繰り返すことは放射線被曝の問題が生じることがあり,それぞれの欠点と考えられるが,血液検査のKL-6の経時的測定は間質性肺炎の活動性評価に簡便であるとしている。自験例でも有用であり,急性増悪時は高値を呈していた。当科でも概ねKL-6の再上昇はなく,7mg/日から5mg/日の少量のプレドニゾロンで対応可能であった。
抗ARS抗体は,アミノ酸とそれに対するtRNAの結合を触媒する酵素群であり,それぞれのアミノ酸に対し約20種類のARSが知られている。抗ARS抗体には8種類が知られており,本検査は酵素免疫測定法により,そのうち5種類,抗Jo-1,抗PL-7,抗PL-12,抗EJ,抗KS抗体を網羅的に検出するものである。山崎ら[5]によれば抗ARS抗体の抗体量は疾患活動性には必ずしも比例しないとしている。抗体レベルが低くても,進行性の間質性肺炎など生命予後に影響を与える重要臓器病変を呈する症例もあり,抗ARS抗体のindex値にかかわらず積極的な治療介入が必要としている。通常,抗ARS抗体は治療により陰性化することはなく,初期評価で一度陽性であれば,その後は通常,陽性のままであるとしている。本症例でも画像所見でNSIPパターンは漸次改善していたが,抗ARS抗体は陽性で推移している。一方,経時的に測定したKL-6は病勢と一致して再上昇することはなかった。抗ARS抗体の推移と間質性肺炎の活動性の関係については,検討課題と考えられた。
前医で入院中に誤嚥性肺炎を発症したが,そのリスク因子としては,脳梗塞による嚥下機能の低下,経管栄養による胃内容物の流入,ステロイド治療による免疫機能の低下などが考えられた。抗ARS抗体症候群では呼吸筋の筋力低下だけでなく,ステロイドや免疫抑制薬の投与により,誤嚥性肺炎を起こしやすいことが報告されている[3]。
ASSは副腎皮質ステロイド治療によく反応し,比較的予後良好であるといわれている。Fujisawa[6]のレビューによれば,急性/亜急性ILDではプレドニゾロン1,000mg/日 3日間のステロイド・パルス療法に続き,高用量のプレドニゾロン0.75〜1mg/kg/日から投与する。さらに免疫抑制薬との併用も推奨されている。Hozumiら[7]によれば,抗ARS抗体症候群の治療について,後方視的にプレドニゾロンとカルシニューリン阻害薬を併用した群とプレドニゾロン単独群と比較し,無増悪生存率は併用群が優るが,全生存率は有意差がなかったとしている。自験例は少量のプレドニゾロン単独で長期間にわたり治療中であるが,4年以上,急性増悪の再燃なく経過している。Tanizawaら[8]によれば,抗ARS抗体陽性間質性肺炎の長期転帰については,筋炎有無を問わず,同等の生存率を示し,UIPより生存率は良好であるとしている。
利益相反:本主題に関して利益相反はない。
The patient was an 84-year-old woman admitted to another hospital for treatment due to breathing difficulties, where she was diagnosed with acute exacerbation of interstitial pneumonia. Her condition improved with steroid pulse therapy. Ten months after the acute exacerbation, she was referred to our hospital and tested positive for anti-ARS antibodies. The patient was diagnosed as having anti-ARS antibody-positive interstitial pneumonia without symptoms of polymyositis/dermatomyositis. KL-6 levels were measured periodically but did not rise again, and acute exacerbation of interstitial pneumonia did not recur. However, the patient continued to test positive for anti-ARS antibodies.
- 早稲田優子. 3 抗ARS抗体症候群-診断過程, 特徴的な画像所見, BALの意義と治療方法について. 喜舎場朝雄, 監修. 間質性肺炎のみかた, 考えかた. 東京: 中外医学社, 2022: 169-75.
- Hozumi H, et al. Prognostic significance of anti-aminoacyl-tRNA Synthetase antibodies in polymyositis/dermatomyositis-associated interstitial lung disease: A retrospective case control study. PLoS One 2015; 10: e0120313.
- Palmucci S, et al. Clinical and radiological features of interstitial lung diseases associated with polymyositis and dermatomyositis. Medicina (Kaunas) 2022; 58: 1757.
- Yamaguchi K, et al. Serial measurement of KL-6 for monitoring activity and recurrence of interstitial pneumonia with anti-aminoacyl-tRNA synthetase antibody: A retrospective cohort study. Medicine (Baltimore) 2018; 97: e13542.
- 山崎宣興,ほか.新たに保険収載された多発性筋炎・皮膚筋炎の検査法: 抗アミノアシルtRNA合成酵素(ARS)抗体について. モダンメディア 2014; 60: 200-205.
- Fujisawa T. Management of myositis-associated interstitial lung disease. Medicina (Kaunas) 2021; 57: 347.
- Hozumi H, et al. Efficacy of glucocorticoids and calcineurin inhibitors for anti-aminoacyl-tRNA synthetase antibody-positive polymyositis/dermatomyositis-associated interstitial lung disease: A propensity score-matched analysis. J Rheumatol 2019; 46: 509-17.
- Tanizawa K, et al. The long-term outcome of interstitial lung disease with anti-aminoacyl-tRNA synthetase antibodies. Respir Med 2017; 127: 57-64.