【投稿/レビュー】重症喘息におけるバイオマーカー
-診断から予後予測まで-

権 寧博*1,岡崎博志*2
*1日本大学医学部内科学系呼吸器内科学分野(〒173-8610 東京都板橋区大谷口上町30-1)
*2アストラゼネカ株式会社メディカル本部
Biomarkers in severe asthma - Diagnosis to prognosis -
Gon Yasuhiro*1,Okazaki Hiroshi*2
*1Division of Respiratory Medicine, Department of Internal Medicine, Nihon University School of Medicine, Tokyo
*2Medical, AstraZeneca K.K.
Keywords:重症喘息,バイオマーカー,好酸球,FeNO,IgE/severe asthma,biomarker,eosinophil,FeNO,IgE
呼吸臨床 2020年4巻8号 論文No.e00110
Jpn Open J Respir Med 2020 Vol. 4 No. 8 Article No.e00110
DOI: 10.24557/kokyurinsho.4.e00110
受付日:2020年6月3日
掲載日:2020年8月17日
©️Gon Yasuhiro, et al. 本論文はクリエイティブ・コモンズ・ライセンスに準拠し,CC-BY-SA(原作者のクレジット[氏名,作品タイトルなど]を表示し,改変した場合には元の作品と同じCCライセンス[このライセンス]で公開することを主な条件に,営利目的での二次利用も許可されるCCライセンス)のライセンシングとなります。詳しくはクリエイティブ・コモンズ・ジャパンのサイト(https://creativecommons.jp/)をご覧ください。
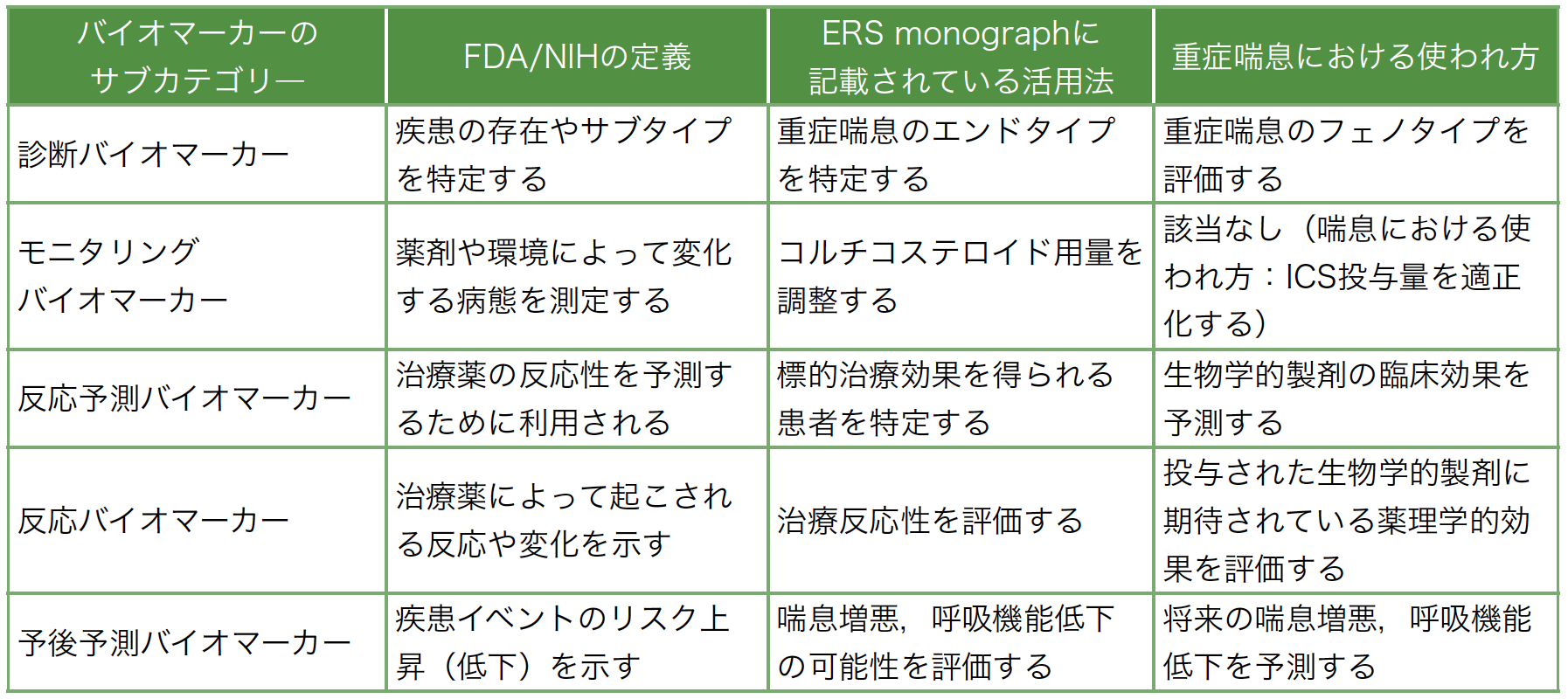
病態に応じた治療が必要とされる重症喘息患者の診療において,バイオ―マーカーの整理・理解が重要である。本稿では,FDA/NIH Biomarker working groupで提唱されたバイオマーカー分類に基づき,既存の喘息に対するバイオマーカーの報告について分類・整理した。末梢血好酸球は,簡便に測定可能かつ,重症喘息の診断から予後予測まで幅広く活用が可能である。今後は,各バイオマーカーの特徴を理解した上で,組み合わせも含めた有効な活用法が期待される。
気管支喘息(喘息)は気道の慢性炎症を本態とした代表的な呼吸器疾患の1つであり,基本治療として吸入ステロイド薬(inhaled corticosteroid:ICS)が使用されている。しかしながら,本邦では,高用量ICSおよびその他の長期管理薬を併用してもコントロール不良な重症喘息の患者が約3~15%存在することが報告されており[1][2],その病態を形成する因子は多様であることが報告されている[3]。
重症喘息病態の中心である2型気道炎症を反映するバイオマーカーとして,喀痰中好酸球,末梢血好酸球,呼気一酸化窒素(FeNO)などが報告されており,これらのバイオマーカーは診断や病態の予後予測などへの活用について議論が重ねられてきた[4]。
2018年にFDA/NIH Biomarker working groupにおいて,7つのバイオマーカー分類およびその定義が提唱された[5]。さらにERS monographでは,これらのバイオマーカーの定義に基づき重症喘息における「診断,モニタリング,反応予測,反応,予後予測」の5つに分類されている[4]。しかしながら,これらの分類における各バイオマーカーの有用性について整理はされているが,理解が十分に浸透していない。
本稿では,喘息のバイオマーカーの中でも低侵襲性かつ日常診療で汎用性の高いものとして認識されている末梢血好酸球,血清IgE,FeNOの重症喘息における活用法について,エビデンスが不十分なモニタリングバイオマーカーを除く4つの分類(診断,反応予測,反応,予後予測)の観点に整理し,紹介する(表1)。
表1 各バイオマーカーの定義に基づく重症喘息における活用法
(文献[4][5]より一部改変引用)
診断バイオマーカー(Diagnostic biomarker)
本稿では,重症喘息における診断バイオマーカーは重症喘息のフェノタイプを評価するものと位置づけた。
末梢血好酸球数およびFeNO値は好酸球性気道炎症を評価する上で有用であり[6][7][8],また血清総IgE値は若年の2型気道炎症の評価に,特異的IgE抗体はアトピー型喘息診断に有用であることが報告されている[9][10]。
末梢血好酸球数が150/µL以上の場合,好酸球性気道炎症が存在するとされている喀痰中好酸球2%以上を反映する感度・特異度はそれぞれ85%・75%であり[6],この結果から,末梢血好酸球数が150/µL以上であれば,好酸球性気道炎症が存在する可能性が高いことが示唆される。さらに,軽症~重症喘息患者を対象とした試験では,喀痰中好酸球2%以上を反映する末梢血好酸球数の感度・特異度(66%,83%)は血清総IgE値(63%,59%),FeNO値(65%,75%)と比べ,高いことが報告されている[7]。
FeNO値は軽症~中等症喘息患者を対象とした試験において,42ppb以上であれば,喀痰中好酸球3%以上を反映する感度・特異度はそれぞれ63%・92%であった[8]。この結果から,FeNO値が42ppb以上であれば,好酸球性気道炎症が存在する可能性が高いことが示唆される。
特異的IgE抗体は,ダニや動物の毛・皮膚,真菌などに対し陽性であれば,アトピー型喘息が疑われる[9]。一方で,血清総IgE値はより若年の患者において2型気道炎症と相関することが報告されているが[10],前述のとおり,末梢血好酸球数やFeNO値と比べ好酸球性気道炎症の予測能は低い[7]。
反応予測バイオマーカー(Predictive biomarker)
本稿では,重症喘息における反応予測バイオマーカーは重症喘息治療薬として本邦で承認された4種の生物学的製剤〔抗IL-5受容体α抗体(ベンラリズマブ),抗IL-5抗体(メポリズマブ),抗IL-4受容体α抗体(デュピルマブ),抗IgE抗体(オマリズマブ)〕の臨床的効果を予測するものと位置づけた。
末梢血好酸球数はベンラリズマブ,メポリズマブ,デュピルマブ,オマリズマブの臨床的効果を予測する上で有用である。ベンラリズマブおよびメポリズマブでは,投与時の末梢血好酸球数が150/µL以上あるいは,300/µL以上の症例おいて,有意に年間喘息増悪回数の抑制および呼吸機能の改善が示され[11][12],経口ステロイドの維持用量も有意に減量したことが報告されている[13][14]。オマリズマブでは,投与時の末梢血好酸球数が260/µL以上の症例において,有意な喘息増悪率の抑制が報告されている[15]。一方で,デュピルマブでは,中等症~重症喘息患者を対象とした試験において,同様に末梢血好酸球数と有効性の関連性が報告されている[16][17]。
FeNO値はオマリズマブ,デュピルマブの臨床的効果を予測する上で有用である。オマリズマブでは,投与時のFeNO値が19.5ppb以上の群の場合,プラセボ群に比べ,喘息増悪率を有意に抑制したことが報告されている[15]。デュピルマブでは,中等症~重症喘息患者を対象とした試験において,投与時のFeNO値が25ppb以上の群の場合,プラセボ群に比べ,有意な喘息増悪率の抑制および呼吸機能の改善が示され[16][17],さらには経口ステロイドの維持用量も有意に減量したことが報告されている[17]。
血清総IgE値はオマリズマブの投与量設定に活用されるが,反応予測マーカーとしての検出力は弱く,十分なエビデンスが蓄積されていない[18]。
これらの報告から,末梢血好酸球数は現在使用可能なすべての生物学的製剤の反応予測に,またFeNO値はオマリズマブやデュピルマブの反応予測に有用な指標となることが示唆される。
反応バイオマーカー(Response biomarker)
本稿では,重症喘息における反応バイオマーカーは投与された生物学的製剤に期待されている薬理学的効果を評価するものと位置づけた。
末梢血好酸球数はベンラリズマブ,メポリズマブ投与後の薬理学的効果を評価する上で有用である。末梢血好酸球数はベンラリズマブ投与後4週時点での中央値が0/µLに[11],メポリズマブ投与後4週時点で86%減少したことが報告されている[12]。一方で,デュピルマブ投与後では,末梢血好酸球数は一過性に増加し,52週時点までに投与時に近い値まで減少したことが報告されている[16]。
FeNO値はデュピルマブ投与後の薬理学的効果を評価する上で有用であり,デュピルマブの投与後,12週時点でFeNO値が15.6ppb減少したことが報告されている[16]。一方で,ベンラリズマブ,メポリズマブ投与後のFeNO値はプラセボ群と差がないことが報告されている[19][20]。
血清総IgE値は一般的にオマリズマブ投与後,IgEの消失半減期の延長により上昇することが知られており,オマリズマブ投与後の薬理学的効果を評価することは難しい。一方で,free IgEはオマリズマブ投与後の薬理学的効果を評価する上で有用であり,オマリズマブ投与後,16週時点で減少したことが報告されており[21],今後の保険適用追加が期待される。
これらの報告から,使用する生物学的製剤により薬理学的評価をするための指標は異なり,事前にどのバイオマーカーを指標とすべきかを理解しておく必要がある。
予後予測バイオマーカー(Prognostic biomarker)
本稿では,重症喘息における予後予測バイオマーカーは将来の喘息増悪,呼吸機能低下を予測するものと位置づけた。重症喘息における予後予測バイオマーカーはこれまでの研究において将来の増悪,入院や緊急受診のリスク,呼吸機能の経年変化などの予測に対しさまざまな検討がなされてきた。
予後予測バイオマーカーの中でも末梢血好酸球数およびFeNO値は将来の喘息増悪,呼吸機能低下を評価する上で有用である。
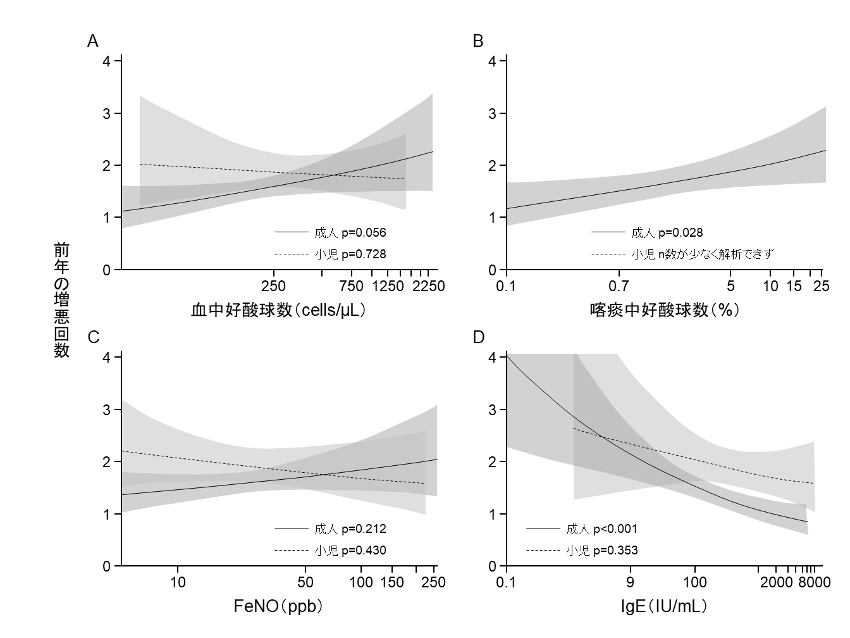
末梢血好酸球数が400/µL以上の重症喘息患者では,年間2回以上の喘息増悪リスクが有意に高く,入院や緊急受診のリスクも有意に高いことが報告されている[22]。また末梢血好酸球数の増加に伴い,喘息増悪リスクが上昇する傾向があることが報告されている(図1)[23]。さらに軽症~重症喘息患者を対象とした試験において,末梢血好酸球数の増加は呼吸機能の低下と有意に相関することが報告されている[24]。
図1 2型炎症マーカーと喘息増悪回数
(文献[23]より一部改変引用)
FeNO値は,喘息の頻回増悪に有意に関連しており[25],また呼吸機能については,コントロール良好な喘息患者において,持続的FeNO高値(≧40ppb)群では,持続的FeNO低値(<40ppb)群と比べ,3年後の呼吸機能が有意に低下したことが報告されている[26]。
これらの結果からも末梢血好酸球数およびFeNO値を評価し,治療強度を調節することで将来の喘息増悪および呼吸機能低下の回避を可能にすることが示唆される。一方で,末梢血好酸球数低値かつFeNO高値の場合,重篤な増悪を起こした患者の割合は,末梢血好酸球数,FeNOがいずれも低値の場合と同様であり,末梢血好酸球数高値の場合のみ,FeNOは重篤な増悪の増加に関連するとの報告もあり(図2)[27],好酸球数低値の場合のFeNO高値の病態については今後の更なる検討が必要と思われる。
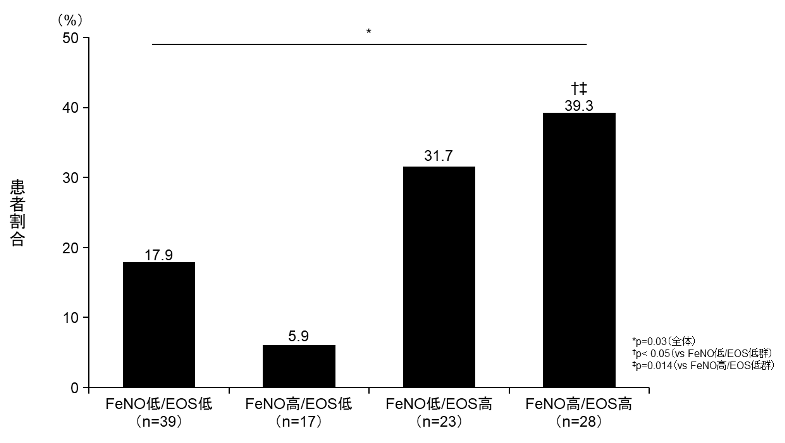
図2 重篤な喘息増悪を経験した各フェノタイプの患者割合
EOS:Eosinophil(好酸球)
(文献[27]より一部改変引用)
血清総IgE値は喘息の頻回増悪と関連しなかったことが報告されており[23][25],呼吸機能についてはエビデンスが十分ではない。
2型気道炎症バイオマーカーである末梢血好酸球,血清IgE,FeNOにおける重症喘息の診断から予後予測に対する有用性について分類・整理した(表2)。末梢血好酸球は,日常臨床において簡便に測定可能かつ,重症喘息における診断から予後予測まで幅広く活用が可能なバイオマーカーである。今後は,重症喘息における各バイオマーカーの特徴を理解した上で,各バイオマーカーの組み合わせも含めた有効な活用法が期待される。
表2 末梢血好酸球,FeNO,血清IgEの診断から予後予測に対する有用性
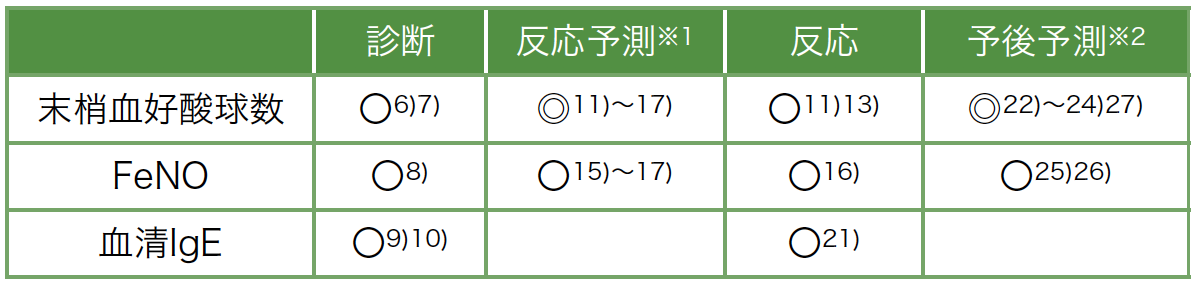
◎:非常に有用なマーカーであることを示す,〇:有用なマーカーであることを示す
※1:末梢血好酸球数は現在使用可能な全ての生物学的製剤の反応予測マーカーに有用である[11]〜[17]ことから,◎とした。FeNOは2製剤(オマリズマブおよびデュピルマブ)の反応予測マーカーに有用である[15]〜[17]ことから〇とした。
※2:末梢血好酸球数は単独高値で重篤な増悪の増加に関連する[27]ことから◎とした。FeNOは好酸球数高値の場合のみ,重篤な増悪の増加に関連する[27]ことから〇とした。
(文献より作図)
COI:本論文の投稿にあたっては,アストラゼネカ株式会社が資金提供をした。著者の岡崎博志はアストラゼネカ株式会社の社員である。
In the medical treatment of patients with severe asthma who treatment is required according to pathophysiology, it is important to organize and understand biomarkers.
In this article, previously reported biomarkers for asthma are classified and organized according to the classification proposed by the FDA-NIH Biomarker Working Group.
The peripheral blood eosinophil is a biomarker which can be easily measured and widely used from diagnosis to prognosis in severe asthma. In the future, based on the understanding of the characteristics of each biomarker, effective utilization including combination is expected.
- 足立 満, ほか. コントロール不良な日本人重症喘息患者を対象とした主観的負荷に関するインターネット調査―SHIRAHAE study―. Therapeut Res. 2019; 40: 375-91.
- Nagase H, et al. Prevalence, disease burden, and treatment reality of patients with severe, uncontrolled asthma in Japan. Allergol Int. 2020; 69: 53-60.
- Opina MT, et al. Phenotype-driven therapeutics in severe asthma. Curr Allergy Asthma Rep. 2017; 17: 10. doi:10.1007/s11882-017-0678-1.
- Svenningsen S, et al. Clinical biomarkers and noninvasive assessment of severe asthma. Eur Respir Mon. 2019; 84: 93-112.
- FDA-NIH Biomarker Working Group. BEST (Biomarkers, EndpointS, and other Tools) Resource. Food and Drug Administration, National Institutes of Health. 2018 Update.
- Ortega H, et al. Blood eosinophil counts predict treatment response in patients with severe eosinophilic asthma. J Allergy Clin Immunol. 2015; 136: 825-6. doi:10.1016/j.jaci.2015.05.039.
- Korevaar DA, et al. Diagnostic accuracy of minimally invasive markers for detection of airway eosinophilia in asthma a systematic review and meta-analysis. Lancet Respir Med. 2015; 3: 290-300. doi:10.1016/S2213-2600(15)00050-8.
- Wagener AH, et al. External validation of blood eosinophils, FE(NO) and serum periostin as surrogates for sputum eosinophils in asthma. Thorax. 2015; 70: 115-20. doi:10.1136/thoraxjnl-2014-205634.
- 日本呼吸器学会難治性喘息診断と治療の手引き2019作成委員会. 難治性喘息診断と治療の手引き2019. 東京: メディカルレビュー社, 2018.
- Peters MC, et al. Refractory airway type 2 inflammation in a large subgroup of asthmatic patients treated with inhaled corticosteroids. J Allergy Clin Immunol. 2019; 143: 104-13.e14. doi:10.1016/j.jaci.2017.12.1009.
- FitzGerald JM, et al. Benralizumab, an anti-interleukin-5 receptorαmonoclonal antibody, as add-on treatment for patients with severe, uncontrolled, eosinophilic asthma (CALIMA): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet. 2016; 388: 2128-41. doi:10.1016/S0140-6736(16)31322-8.
- Ortega HG, et al. Mepolizumab treatment in patients with severe eosinophilic asthma. N Engl J Med. 2014; 371: 1198-207. doi:10.1056/NEJMoa1403290.
- Nair P, et al. Oral glucocorticoid-sparing effect of benralizumab in severe asthma. N Engl J Med. 2017; 376: 2448-58. doi:10.1056/NEJMoa1703501.
- Bel EH, et al. Oral glucocorticoid-sparing effect of mepolizumab in eosinophilic asthma. N Engl J Med. 2014; 371: 1189-97. doi:10.1056/NEJMoa1403291.
- Hanania NA, et al. Exploring the effects of omalizumab in allergic asthma:an analysis of biomarkers in the EXTRA study. Am J Respir Crit Care Med. 2013; 187: 804-11. doi:10.1164/rccm.201208-1414OC.
- Castro M, et al. Dupilumab efficacy and safety in moderate-to-severe uncontrolled asthma. N Engl J Med. 2018; 378: 2486-96. doi:10.1056/NEJMoa1804092.
- Rabe KF, et al. Efficacy and safety of dupilumab in glucocorticoid-dependent severe asthma. N Engl J Med. 2018; 378: 2475-85. doi:10.1056/NEJMoa1804093.
- Bousquet J, et al. Predicting and evaluating response to omalizumab in patients with severe allergic asthma. Respir Med. 2007; 101: 1483-92. doi:10.1016/j.rmed.2007.01.011
- Castro M, et al. Benralizumab, an anti-interleukin 5 receptorαmonoclonal antibody, versus placebo for uncontrolled eosinophilic asthma:a phase 2b randomised dose-ranging study. Lancet Respir Med. 2014; 2: 879-890. doi:10.1016/S2213-2600(14)70201-2.
- Haldar P, et al. Mepolizumab and exacerbations of refractory eosinophilic asthma. N Engl J Med. 2009; 360: 973-84. doi:10.1056/NEJMoa0808991.
- Tajiri T, et al. Utility of serum periostin and free IgE levels in evaluating responsiveness to omalizumab in patients with severe asthma. Allergy. 2016; 71: 1472-9. doi:10.1111/all.12922.
- Zeiger RS, et al. Blood eosinophil count and outcomes in severe uncontrolled asthma: A prospective study. J Allergy Clin Immunol Pract. 2017; 5: 144-153.e8. doi:10.1016/j.jaip.2016.07.015.
- Denlinger LC, et al. Inflammatory and comorbid features of patients with severe asthma and frequent exacerbations. Am J Respir Crit Care Med. 2017; 195: 302-13. doi:10.1164/rccm.201602-0419OC.
- Graff S, et al. Increase in blood eosinophils during follow-up is associated with lung function decline in adult asthma. Respir Med. 2019; 152: 60-6. doi:10.1016/j.rmed.2019.04.020.
- Kimura H, et al. Prospective predictors of exacerbation status in severe asthma over a 3-year follow-up. Clin Exp Allergy. 2018; 48: 1137-46. doi:10.1111/cea.13170.
- Matsunaga K, et al. Persistently high exhaled nitric oxide and loss of lung function in controlled asthma. Allergol Int. 2016; 65: 266-71. doi:10.1016/j.alit.2015.12.006.
- Soma T, et al. Implication of fraction of exhaled nitric oxide and blood eosinophil count in severe asthma. Allergol Int. 2018; 67S: S3-S11. doi:10.1016/j.alit.2018.04.003.