【投稿/レビュー】気管支喘息における気道上皮細胞によるサイトカインを介した気道炎症の制御

權 寧博*,薮田忠孝**
*日本大学医学部内科学系呼吸器内科学分野(〒173-8610 東京都板橋区大谷口上町30-1)
**アストラゼネカ株式会社メディカル本部
Regulation of airway inflammation via cytokines secreted by airway epithelial cells in asthma
Yasuhiro Gon *,Tadataka Yabuta**
*Division of Respiratory Medicine, Department of Internal Medicine, Nihon University School of Medicine, Tokyo
**Medical, AstraZeneca K.K.
Keywords:気管支喘息,気道上皮細胞,TSLP,IL-33,IL-25/bronchial asthma, airway epithelial cells, TSLP, IL-33, IL-25
呼吸臨床 2020年4巻12号 論文No.e00113
Jpn Open J Respir Med 2020 Vol. 4 No. 12 Article No.e00113
DOI: 10.24557/kokyurinsho.4.e00113
受付日:2020年10月7日
掲載日:2020年12月7日
©️Yasuhiro Gon, et al. 本論文はクリエイティブ・コモンズ・ライセンスに準拠し,CC-BY-SA(原作者のクレジット[氏名,作品タイトルなど]を表示し,改変した場合には元の作品と同じCCライセンス[このライセンス]で公開することを主な条件に,営利目的での二次利用も許可されるCCライセンス)のライセンシングとなります。詳しくはクリエイティブ・コモンズ・ジャパンのサイト(https://creativecommons.jp/)をご覧ください。
これまで気道上皮細胞は吸入した環境因子に対して物理的なバリアとして機能していることが知られてきた。近年,気道上皮細胞は環境因子の刺激によって上皮サイトカインを産生し,多様な気道炎症を制御していることが明らかになってきた。本稿では,最近注目を集めている上皮サイトカイン〔thymic stromal lymphopoietin(TSLP),インターロイキン(interleukin:IL)-33,IL-25〕を介した気道炎症メカニズムについて概説する。
気道上皮細胞は,吸入された外来異物の体内への侵入を防ぐ物理的バリアとして機能する。これに加え,近年,気道上皮細胞の細胞膜や細胞内には,アレルゲン,ウイルス,細菌,タバコ煙などの環境因子を認識する受容体が存在していることが明らかになった[1]。これらの受容体は認識した環境因子の情報を細胞内に伝達し,thymic stromal lymphopoietin(TSLP),インターロイキン(interleukin:IL)-33,IL-25などの上皮サイトカインの産生を促進し,気管支喘息患者において多様な気道炎症を誘導することから,気道上皮細胞の気道炎症における役割が注目されている(図1)。本稿では,気管支喘息における気道上皮細胞による,上皮サイトカインを介した気道炎症メカニズムについて概説する。
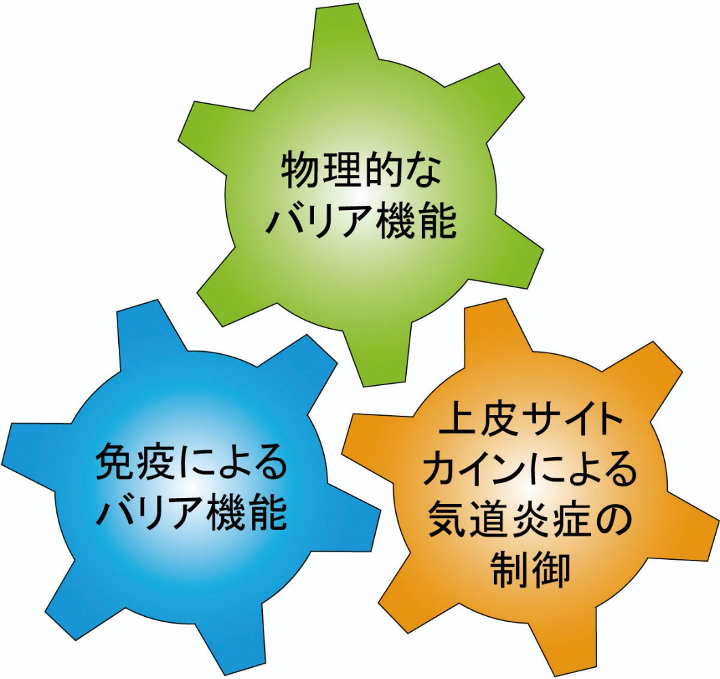
図1 外来異物に対する気道上皮細胞の機能
気道上皮細胞は,これまで知られている物理的なバリアや免疫によるバリア機能に加え,上皮サイトカインによる気道炎症の制御機能の役割も有する。
気道上皮細胞には,Toll様受容体(Toll-like receptor:TLR)やプロテアーゼ活性化受容体(protease-activated receptor:PAR)などのパターン認識受容体(pattern recognition receptor:PRR)が存在し,これらを介して環境因子を迅速に認識している。
TLRはさまざまな病原体関連分子パターン(pathogen-associated molecular pattern:PAMP)を認識するI型の膜貫通蛋白質である。ヒト気道上皮由来細胞では10種のTLR(TLR1-10)が発現していることが確認されている[2]。TLRは細胞内の局在が異なるサブグループに分かれており,認識するPAMPもそれぞれで違っている。TLR4は主に細胞膜に局在し,室内塵ダニ(house dust mite:HDM)アレルゲンや真菌プロテアーゼ,グラム陰性菌由来のリポ多糖(lipopoly-saccharide:LPS)などを認識する[3][4]。一方で,TLR3,TLR7およびTLR9は,細胞質エンドソームに局在し,病原体由来の核酸を認識している。これらの核酸のうち二本鎖RNAはTLR3が,ウイルス由来の一本鎖RNAはTLR7が認識し,非メチル化CpG DNAはTLR9が特異的に認識する[5]。
PARはG蛋白質共役型受容体であり[6],4つのファミリーメンバーが確認されている。気道上皮細胞において,PAR2は真菌やHDM,ゴキブリ由来のプロテアーゼにより活性化される[3][6]。
気道上皮細胞における上皮サイトカイン産生メカニズム
TLRやPARがPAMPを認識すると,myeloid differentiation protein-88(MyD88)やtoll-interleukin 1 receptor domain containing adaptor protein(TIRAP),TIR domain-containing adaptor inducing IFNβ(TRIF),TRIF-related adaptor molecule(TRAM)などの細胞内アダプター分子が動員され免疫が活性化しサイトカイン産生が促進される(図2)。PAMPの種類に応じて,これらのアダプター分子は選択的にそれぞれのTLRと相互作用し,IκB kinase(IKK)複合体を誘導し,転写因子nuclear factor(NF)-κBの活性化と核内移行を誘導後,TSLPやIL-33などのサイトカイン遺伝子群の転写を促進する[7]。ヒト気道上皮細胞を用いた研究によってHDM由来のプロテアーゼ,Dermatophagoides pteronyssinus group 1 allergen(Der p1)によりPAR2が活性化されると,IL-25の発現が促進されることが知られているが[8],サイトカイン産生に対する細胞内シグナル伝達のメカニズムは,まだ未解明な部分が多い。
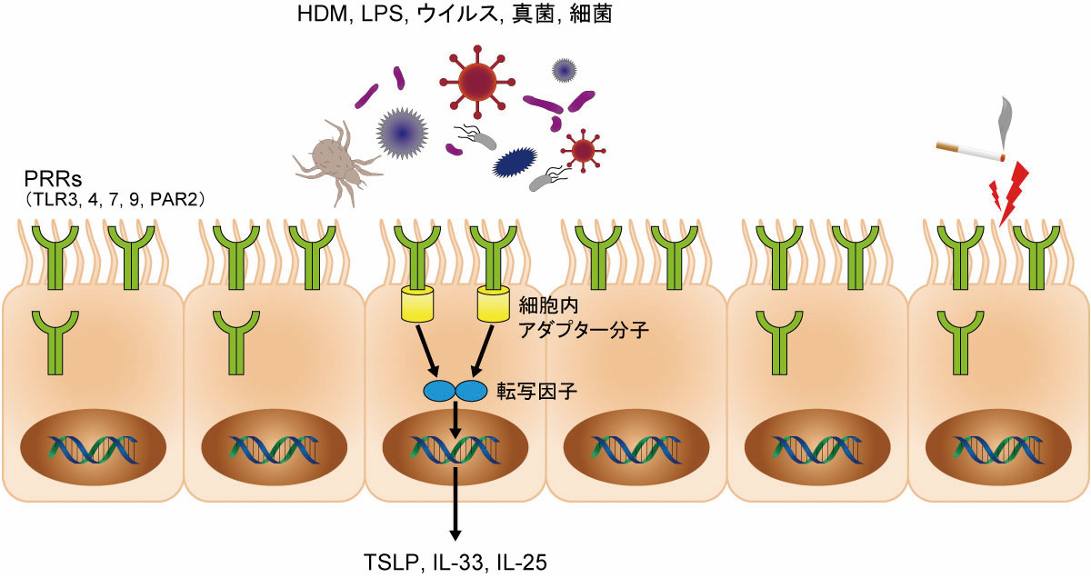
図2 気道上皮細胞は環境因子を認識して,上皮サイトカインを分泌する
気道上皮細胞は細胞で発現しているパターン認識受容体(PRR)でアレルゲンや病原体などの環境因子を認識する。認識した情報は細胞内シグナル伝達により,NFκBのような転写因子を刺激し,上皮サイトカインの産生を促進する。
HDM:house dust mite,IL:interleukin,LPS:lipopolysaccharide,PAR:protease-activated receptor,TLR:toll-like receptor,TSLP: thymic stromal lymphopoietin
環境因子によって気道上皮細胞のPRRが活性化されると多くのサイトカイン,ケモカインが産生されることが報告されている[3]。その中でも,気管支喘息における気道炎症病態で重要な働きを有する上皮サイトカインであるTSLP,IL-33,IL-25の役割について解説する。
TSLP:TSLPはIL-2ファミリーに属するサイトカインであり,受容体はTSLP受容体鎖(TSLP receptor:TSLPR)とIL-7受容体α鎖とのヘテロ二量体から成る[9]。TSLPRは樹状細胞(dendritic cell:DC),マスト細胞,グループ2自然リンパ球(group 2 innate lymphoid cell:ILC2),B細胞,T細胞,好塩基球,好酸球と上皮細胞自体,気道平滑筋細胞や線維芽細胞などの非血球系細胞に発現している[10][11]。
TSLPは,TSLPRコンディショナルノックアウトマウスを用いた研究において,パパイン誘発の自然免疫応答モデルにおいてはILC2を介して,卵白アルブミン誘発の獲得免疫応答モデルにおいてはDCとTh2細胞を介してType2炎症を誘導することが示されている[12]。また,ヒトの末梢血を用いた研究ではTSLPがTLR3リガンドとの共存下でナイーブT細胞をTh17細胞に分化させることが明らかになっている[13]。Th17細胞が産生するIL-17Aは,気道上皮細胞を刺激することにより好中球を遊走させるケモカインを産生させることから[14],TSLPは好中球性炎症にも関与していると考えられる。
IL-33:IL-33は,IL-1ファミリーに属するサイトカインである[10]。IL-33の受容体はST2とIL-1 receptor accessory protein(IL-1RAP)のヘテロ二量体であり,マスト細胞,ILC2,Th2細胞,好酸球,好塩基球,DC,Th1細胞,細胞障害性T細胞,natural killer(NK)細胞,制御性T細胞,invariant NK T(iNKT)細胞,B細胞,マクロファージ,線維芽細胞などで発現している[10]。
IL-33は恒常的に発現している核蛋白質で,病原体の侵入を他の細胞に知らせるアラーミンとして機能している。上皮細胞が病原体による物理的な傷害やプロテアーゼを含むアレルゲンに曝露すると細胞死(ネクローシス)を起こし,核内に存在していたIL-33が急速に放出される。放出されたIL-33はアレルゲンのプロテアーゼ活性によって切断され成熟型となり,ILC2を活性化し,好酸球を動員することでType2炎症を誘導している[15]。
IL-25:IL-25はIL-17ファミリーに属し,その受容体はIL-17受容体(IL-17 receptor:IL-17R)AとIL-17RBから成る[16]。IL-25受容体はILC2,DC,気道平滑筋,気道上皮細胞,線維芽細胞,好酸球,NKT細胞などで発現している[10]。ほとんどのIL-17ファミリーのメンバーが好中球性炎症を促進するのに対し,IL-25はTh2細胞の分化を促進し,Type2サイトカイン産生を強化することが知られている[17]。IL-25は,他の2つと比べて比較的最近同定されたサイトカインであり,今後の研究の進展が期待される。
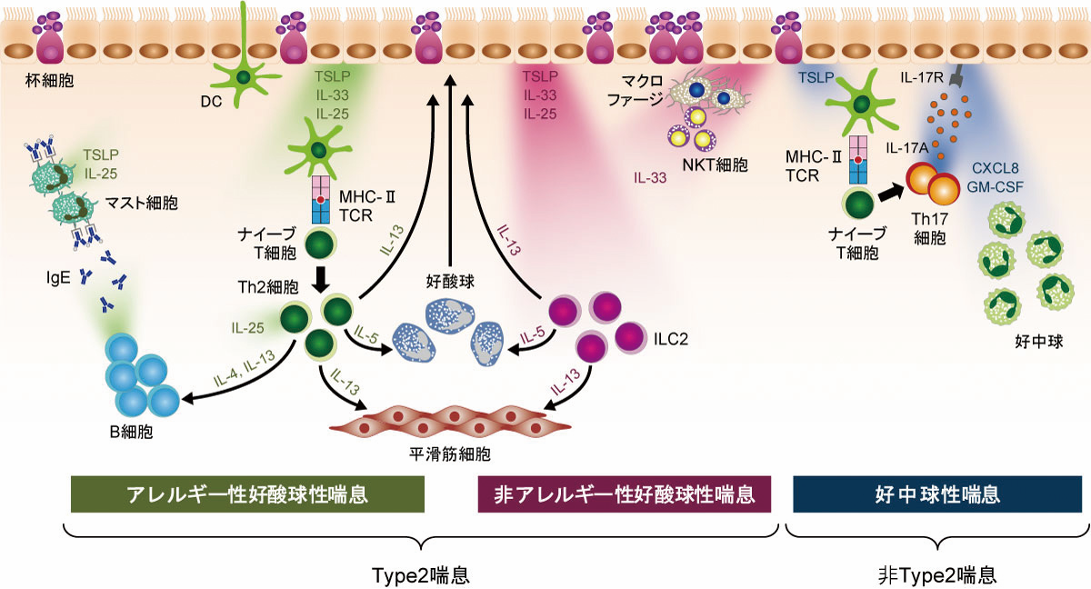
これらの上皮サイトカインは,協調して作用することも報告されている。Cameloらは末梢血から採取したILC2をin vitroで培養すると,TSLPはILC2の生存率を上昇させ,この効果は3つの上皮サイトカイン存在下でさらに向上することを示した[18]。同様に,他の気道炎症経路においても上皮サイトカインは相乗的に機能していると考えられる[19]。また,これら3つの上皮サイトカインは,DCやマスト細胞など上皮細胞以外のType2炎症に関わる細胞からも産生されることが知られており[20][21][22],上皮サイトカインは環境因子による気道炎症の開始だけでなく気道炎症の慢性化および喘息病態の重症化にも重要な働きを担っていると考えられる(図3)。
図3 上皮サイトカインによる炎症反応
気道上皮細胞から産生されたTSLP,IL-33,IL-25はさまざまな免疫細胞を刺激し,炎症反応を惹起する。また,気道上皮細胞以外の炎症に関わる細胞も上皮サイトカインを発現しており,炎症の慢性化にも関与している。
CXCL8:C-X-C motif chemokine ligand 8,DC:dendritic cell,GM-CSF:granulocyte macrophage colony-stimulating factor,IgE:immunoglobulin E,IL:interleukin,ILC2:group 2 innate lymphoid cells,MHC-II:major histocompatibility complex class II,NKT:natural killer T,TCR:T-cell receptor,TSLP:thymic stromal lymphopoietin
現在,これらの上皮サイトカインを標的とした生物学的製剤が開発されている[10]。TSLPに対する抗体であるtezepelumabは,コントロールが不十分な重症喘息患者を対象にした第II相試験において好酸球,呼気一酸化窒素(fractional exhaled nitric oxide:FeNO)や血清総IgEを含む幅広い気道炎症関連因子を低下させた結果,プラセボと比べて喘息増悪の有意な低下が報告された[23]。今後,これらの上皮サイトカインをターゲットとした製剤の開発の進展が期待される。
気管支喘息において,気道上皮細胞はこれまで知られていた物理的バリア機能だけではなく,気道炎症の司令塔としての機能を持っていることが明らかになってきた。気道上皮細胞は環境因子に応じて上皮サイトカインを産生し多様な気道炎症を誘導することから,上皮サイトカインの制御が,既存治療でコントロールできない喘息患者に対する新たな治療法として期待される。
謝辞:本論文の作成支援を受けたEMC株式会社の田中優史氏に感謝する。
利益相反:本論文の作成・投稿に関する費用はアストラゼネカ株式会社が負担した。薮田忠孝はアストラゼネカ株式会社の社員である。
It is well known that airway epithelial cells function as a physical barrier against inhaled airborne triggers. Recent studies have revealed that airway epithelial cells produce cytokines in response to airborne triggers and regulate various airway inflammation. Here, we review the mechanisms involved in airway inflammation mediated by epithelial cytokines 〔thymic stromal lymphopoietin (TSLP), interleukin (IL)-33, and IL-25〕, which have recently attracted attention.
- Lambrecht BN, et al. The airway epithelium in asthma. Nat Med. 2012;18: 684-92. doi: 10.1038/nm.2737.
- Sha Q, et al. Activation of airway epithelial cells by Toll-like receptor agonists. Am J Respir Cell Mol Biol. 2004;31:358-64. doi: 10.1165/rcmb.2003-0388OC.
- Hammad H, et al. Barrier Epithelial Cells and the Control of Type 2 Immunity. Immunity. 2015; 43: 29-40. doi: 10.1016/j.immuni.2015.07.007.
- Poltorak A, et al. Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice: Mutations in Tlr4 gene. Science 1998; 282: 2085-8. doi: 10.1126/science.282.5396.2085.
- 立松 恵, ほか. 自然免疫受容体TLR3により認識されるRNA構造の解明. 生化学. 2014; 86: 523-7.
- 川畑篤史. プロテアーゼ受容体PAR-2(protease-activated receptor-2)の生理機能. 日薬理誌. 2003; 121: 411-20.
- Kawai T, et al. The role of pattern-recognition receptors in innate immunity: Update on Toll-like receptors. Nat Immunol. 2010; 11: 373-84. doi: 10.1038/ni.1863.
- Kouzaki H, et al. Transcription of interleukin-25 and extracellular release of the protein is regulated by allergen proteases in airway epithelial cells. Am J Respir Cell Mol Biol. 2013; 49: 741-50. doi: 10.1165/rcmb.2012-0304OC.
- Pandey A, et al. Cloning of a receptor subunit required for signaling by thymic stromal lymphopoietin. Nat Immunol. 2000; 1: 59-64. doi: 10.1038/76923.
- Gauvreau MG, et al. Anti-alarmin approaches entering clinical trials. Curr Opin Pulm Med. 2020; 26: 69-76. doi: 10.1097/MCP.0000000000000615.
- Datta A, et al. Evidence for a functional thymic stromal lymphopoietin signaling axis in fibrotic lung disease. J Immunol. 2013; 191: 4867-79. doi: 10.4049/jimmunol.1300588.
- Kabata H, et al. Targeted deletion of the TSLP receptor reveals cellular mechanisms that promote type 2 airway inflammation. Mucosal Immunol. 2020; 13: 626-36. doi: 10.1038/s41385-020-0266-x.
- Tanaka J, et al. Human TSLP and TLR3 ligands promote differentiation of Th17 cells with a central memory phenotype under Th2-polarizing conditions. Clin Exp Allergy. 2009; 39:89-100. doi: 10.1111/j.1365-2222.2008.03151.x.
- Kolls JK, et al. Interleukin-17 family members and inflammation. Immunity. 2004; 21: 467-76. doi: 10.1016/j.immuni.2004.08.018.
- Cayrol C, et al. Environmental allergens induce allergic inflammation through proteolytic maturation of IL-33. Nat Immunol. 2018; 19: 375-85. doi: 10.1038/s41590-018-0067-5.
- Rickel AE, et al. Identification of functional roles for both IL-17RB and IL-17RA in mediating IL-25-induced activities. J Immunol. 2008; 181: 4299-310. doi: 10.4049/jimmunol.181.6.4299.
- Angkasekwinai P, et al. Interleukin 25 promotes the initiation of proallergic type 2 responses. J Exp Med. 2007; 204:1509-17. doi: 10.1084/jem.20061675.
- Camelo A, et al. IL-33, IL-25, and TSLP induce a distinct phenotypic and activation profile in human type 2 innate lymphoid cells. Blood Adv. 2017; 1: 577-89. doi: 10.1182/bloodadvances.2016002352.
- Roan F, et al. Epithelial cell-derived cytokines: More than just signaling the alarm. J Clin Invest. 2019; 129: 1441-51. doi: 10.1172/JCI124606.
- Varricchi G, et al. Thymic stromal lymphopoietin isoforms, inflammatory disorders, and cancer. Front Immunol. 2018; 9: 1595. doi: 10.3389/fimmu.2018.01595.
- Afferni C, et al. The pleiotropic immuno-modulatory functions of IL-33 and its implications in tumor immunity. Front Immunol. 2018; 9: 2601. doi: 10.3389/fimmu.2018.02601.
- 中島裕史. Th2型免疫応答におけるIL-25の役割. 千葉医学. 2006; 82: 9-13.
- Corren J, et al. Tezepelumab in adults with uncontrolled asthma. N Engl J Med. 2017; 377: 936-46. doi: 10.1056/NEJMoa1704064.