
浅野浩一郎*,薮田忠孝**
*東海大学医学部医学科内科学系呼吸器内科学(〒259-1193 神奈川県伊勢原市下糟屋143)
**アストラゼネカ株式会社メディカル本部
The role of thymic stromal lymphopoietin (TSLP) in asthma
Koichiro Asano *,Tadataka Yabuta**
*Division of Pulmonary Medicine, Department of Medicine, Tokai University, School of Medicine, Kanagawa
**Medical, AstraZeneca K.K.
Keywords:気管支喘息,thymic stromal lymphopoietin(TSLP),気道炎症,分子メカニズム,気道上皮/bronchial asthma, thymic stromal lymphopoietin (TSLP), airway inflammation, molecular mechanism, airway epithelium
呼吸臨床 2021年5巻2号 論文No.e00120
Jpn Open J Respir Med 2021 Vol. 5 No. 2 Article No.e00120
DOI: 10.24557/kokyurinsho.5.e00120
受付日:2020年12月9日
掲載日:2021年2月5日
©️Koichiro Asano, et al. 本論文はクリエイティブ・コモンズ・ライセンスに準拠し,CC-BY-SA(原作者のクレジット[氏名,作品タイトルなど]を表示し,改変した場合には元の作品と同じCCライセンス[このライセンス]で公開することを主な条件に,営利目的での二次利用も許可されるCCライセンス)のライセンシングとなります。詳しくはクリエイティブ・コモンズ・ジャパンのサイト(https://creativecommons.jp/)をご覧ください。
TSLPは,マウス胸腺間質細胞株からリンパ球増殖刺激活性をもつ因子として同定されたサイトカインで,IL-7に類似した構造をもつ[4]。TSLPは,主に気道上皮細胞や腸管上皮細胞,皮膚ケラチノサイトなどの上皮細胞で産生される[1]。TSLP受容体は,Th2細胞やILC2といった免疫細胞から血小板や線維芽細胞など非免疫細胞まで幅広い細胞で発現している[3][5]。TSLPは初めに標的細胞上のTSLP受容体鎖と結合し,その後にIL-7受容体α鎖と複合体を形成する。TSLPを認識したTSLP受容体複合体は,ヤヌスキナーゼ(JAK)を介してSTATを活性化することで,細胞内へのシグナル伝達を誘導する(図1)[6]。
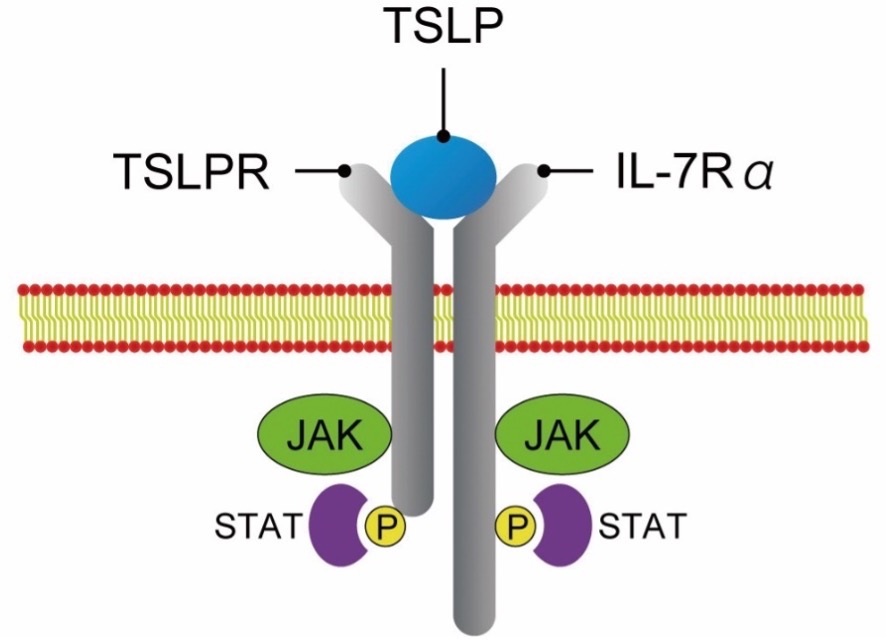
図1 TSLP受容体の構造
TSLP受容体はTSLP受容体鎖(TSLPR)とIL-7受容体α鎖(IL-7Rα)のヘテロダイマーから構成されている。TSLPがTSLP受容体複合体に認識されると,ヤヌスキナーゼ(JAK)が活性化される。活性化されたJAKはSTATをリン酸化することによって,細胞内へシグナルが伝達される。
(文献[6]より引用して改変)
ヒトTSLPには,short-form TSLPとlong-form TSLPの2つのアイソフォームが存在し,病態や組織によって発現が異なる。Short-form TSLPのmRNAは恒常的に多様な組織で発現が見られるが,その受容体や機能については不明な点が多い[7]。一方で,long-form TSLPは二本鎖RNAなどによる刺激によって気道上皮細胞で高発現することが知られている[8]。そこで,本稿ではlong-form TSLPの気管支喘息における役割について解説する。
Pattern recognition receptorによるアレルゲンやウイルス,プロテアーゼの認識,炎症性サイトカイン,たばこ煙のような炎症性物質による刺激や機械的刺激によって気道上皮細胞におけるTSLP産生が開始され,多様な炎症反応を引き起こす[2][9]。まず,分泌されたTSLPは樹状細胞(DC)を活性化し,Th2細胞によるType 2サイトカイン産生を誘導する[10]。また,TSLPはマスト細胞や好塩基球を直接活性化し,マスト細胞からのType 2サイトカイン[11],好塩基球からのType 2サイトカインおよびヒスタミン産生を誘導するとともに[12],他の上皮サイトカインとの共刺激によりILC2からのIL-5,IL-13の産生を誘導する[13]。さらに,TSLPはM2マクロファージへの誘導を介してType 2炎症を促進する[14]。加えて,TSLPは気道組織内での好酸球前駆細胞から成熟好酸球への分化を誘導することも報告されている[15]。Type 2炎症だけでなく,TSLPはTh17細胞の分化誘導促進を介して好中球性炎症にも関与する可能性が示唆されている[16]。
TSLPはフィードフォワードメカニズムにより,TSLPで刺激されたDC[17]やマスト細胞[18],線維芽細胞[19]は自らもTSLPを産生し,同種の細胞や他の標的細胞へのTSLPの供給源としても機能している。さらに,Type 2炎症によって気道に集積した好酸球はETosisと呼ばれる特異な細胞死を起こすことによってクロマチン(細胞外トラップ)を細胞外に放出するが,この好酸球由来細胞外トラップによっても気道上皮細胞からTSLPが産生される[20]。このようなメカニズムによって,TSLPは気道炎症反応の起点になるだけでなく,炎症の慢性化においても重要な働きを担っている(図2)。
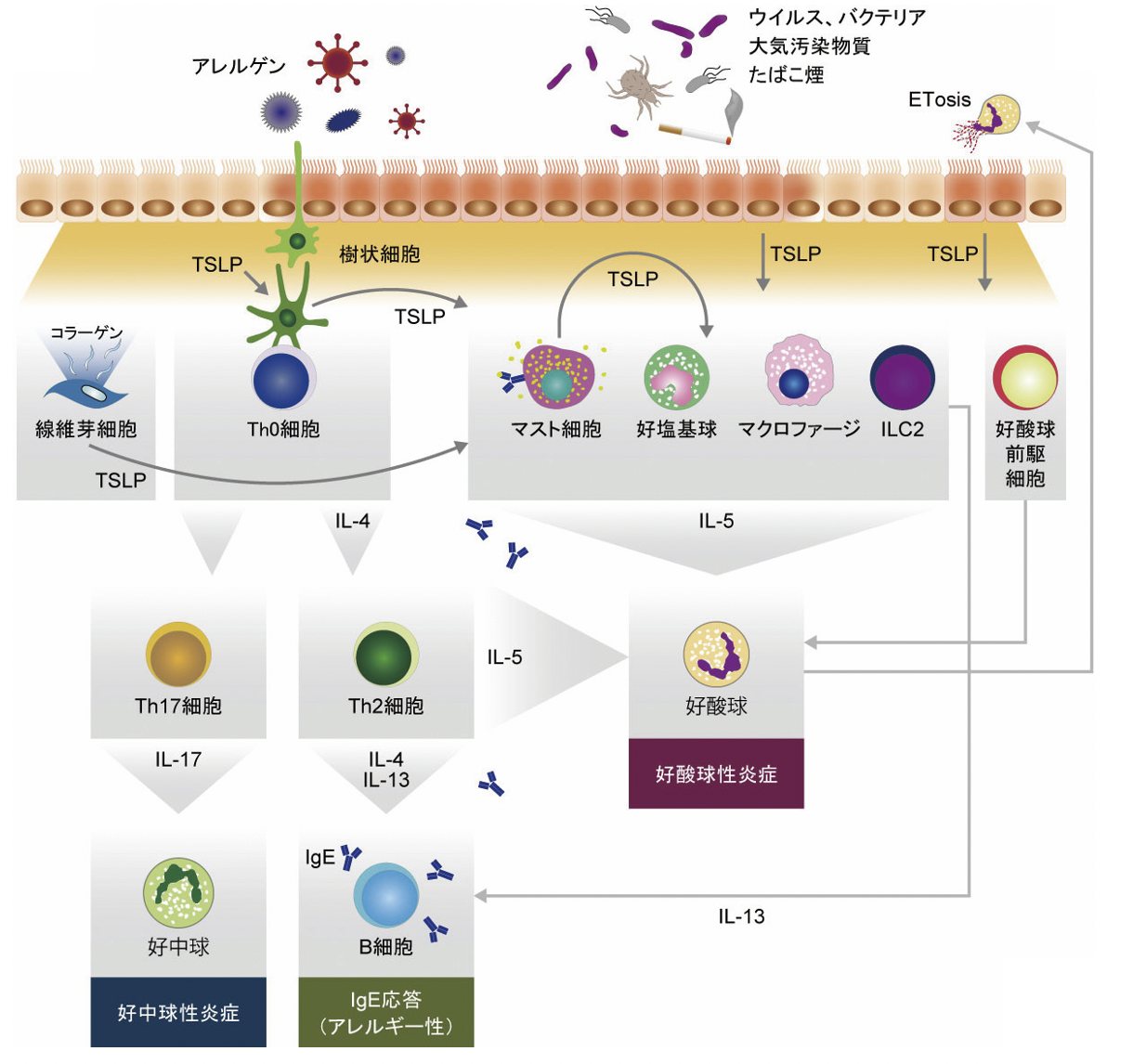
図2 気道炎症病態におけるTSLPの分子メカニズム
アレルゲン,ウイルス,バクテリア,大気汚染物質やたばこ煙で刺激された気道上皮細胞はTSLPを産生する。分泌されたTSLPは樹状細胞を介したTh2細胞やTh17細胞の誘導や,マスト細胞,グループ2自然リンパ球(ILC2)などの活性化を介した炎症反応を引き起こす。TSLPは樹状細胞やマスト細胞,線維芽細胞からも産生され,炎症反応をさらに増幅・慢性化させる。TSLPが気道内の好酸球前駆細胞から好酸球への分化を誘導する一方で,ETosisと呼ばれる細胞死を起こした好酸球が細胞外に放出したクロマチン(細胞外トラップ)は気道上皮細胞などからのTSLP産生を促進する。
ヒトTSLP遺伝子は5番染色体長腕上のアトピー・喘息関連サイトカインクラスターの近傍に存在しており,TSLP関連領域の遺伝子多型が喘息,アトピー素因を有する喘息や気道過敏性のリスク上昇に関連していることが報告されている[21]。この関連は実験的に遺伝子導入によって肺にTSLPを発現させたマウスで気道過敏性の亢進が認められることからも裏付けられる[22]。気管支肺胞洗浄液中のTSLP濃度は喘息患者で上昇が認められ,経口ステロイド薬治療を必要とする重症喘息患者で最も高い値を示す[23]。これには,TSLPがステロイドによるILC2のアポトーシス・Type 2サイトカイン産生抑制を阻害し,ステロイド感受性を低下させることが関与している可能性がある[24][25]。また,気管支肺胞洗浄液中のTSLP濃度はステロイド薬の使用状態に関わらずFEV1値と有意な負の相関を示し[23],呼吸機能の低下にも関わっていることが示唆されている。これに関しても,TSLPが線維芽細胞を活性化してコラーゲン産生を亢進させ[5],リモデリングを促進している可能性がある(図3)。
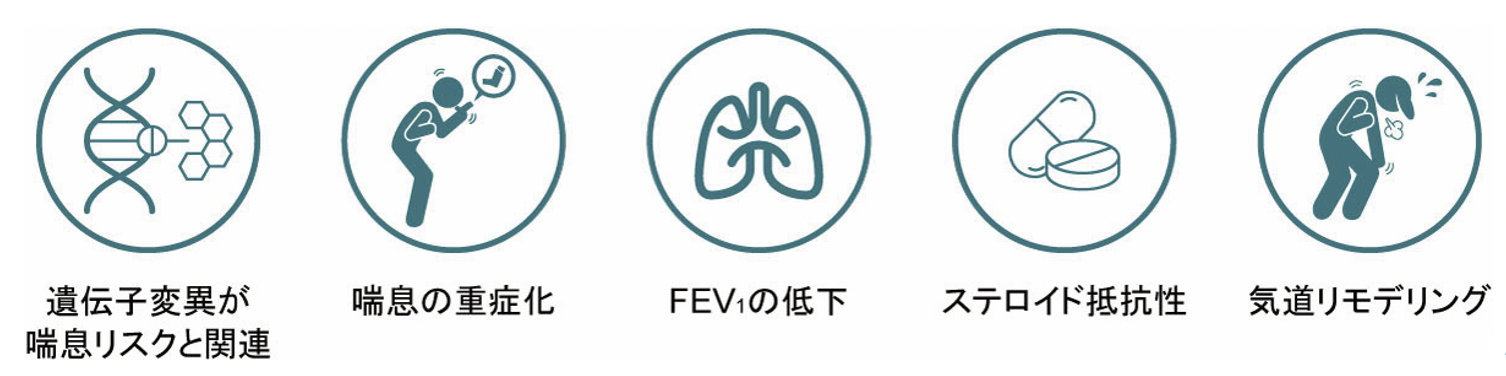
図3 気管支喘息におけるTSLPの作用
TSLPは喘息の発症から重症化に至る様々な段階に関連している。
現在,抗TSLP抗体であるTezepelumabの喘息に対するPhase 3試験(ClinicalTrials.gov Identifier: NCT03347279,NCT03406078)および吸入抗TSLP抗体であるCSJ117のPhase 2試験(ClinicalTrials.gov Identifier: NCT04410523)が進められている。これらの開発試験から,重症喘息患者におけるTSLP阻害により末梢血好酸球数や呼気一酸化窒素濃度(FeNO),血清総IgE,IL-5,IL-13,ペリオスチン,胸腺および活性化制御ケモカイン(TARC)を含む広範なバイオマーカーの低下と,有意な喘息増悪の抑制が報告されてきている[26][27][28]。
これまでの研究によりTSLPは気道炎症の起点となる気道上皮細胞から産生され,喘息における広範な免疫細胞・構成細胞に作用して多様な気道炎症を誘導し,さらに気道炎症の慢性化・重症化に寄与することが明らかになってきた。このようにTSLPが喘息に対して多面的に関与していることから,今後,TSLP阻害薬が,既存治療薬ではコントロールが難しい喘息患者に対する新たな治療選択肢として臨床応用されることが期待される。
謝辞:本論文の作成支援を受けたEMC株式会社の田中優史氏に感謝する。
利益相反:本論文の作成・投稿に関する費用はアストラゼネカ株式会社が負担した。浅野浩一郎はアストラゼネカ株式会社より講演料および研究助成を受けている。薮田忠孝はアストラゼネカ株式会社の社員である。
Thymic stromal lymphopoietin (TSLP) is a cytokine produced by airway epithelial cells that initiate airway inflammation in response to allergens, microorganisms, pollutants, and other stimuli. TSLP acts on a variety of immune cells related to asthma pathophysiology, and is strongly implicated not only in the induction but also in the aggravation and perpetuation of airway inflammation. Here, we review the molecular mechanisms of TSLP in airway inflammation and its role in bronchial asthma.



