【投稿/症例報告】胸部CTで多彩な陰影を呈したMPO-ANCA陽性多発血管炎性肉芽腫症の1例

岡田浩平*,櫻井侑美*,都築早美*,榊原桂太郎*,竹中 圭*
*博慈会記念総合病院呼吸器科(〒123-0864東京都足立区鹿浜5-11-1)
A case of MPO-ANCA positive granulomatosis with polyangiitis showing various chest CT findings
Kohei Okada*,Yumi Sakurai*, Hayami Tsuzuki*,Keitaro Sakakibara*, Kiyoshi Takenaka*
*Department of Pulmonary Medicine, Hakujikai Memorial Hospital, Tokyo
Keywords:多発血管炎性肉芽腫症,CT,MPA-ANCA,PR3-ANCA/granulomatosis with polyangiitis,CT,MPA-ANCA,PR3-ANCA
呼吸臨床 2022年6巻3号 論文No.e00146
Jpn Open J Respir Med 2022 Vol. 6 No.3 Article No.e00146
DOI: 10.24557/kokyurinsho.6.e00146
受付日:2021年12月18日
掲載日:2022年3月11日
©️Kohei Okada, et al. 本論文はクリエイティブ・コモンズ・ライセンスに準拠し,CC-BY-SA(原作者のクレジット[氏名,作品タイトルなど]を表示し,改変した場合には元の作品と同じCCライセンス[このライセンス]で公開することを主な条件に,営利目的での二次利用も許可されるCCライセンス)のライセンシングとなります。詳しくはクリエイティブ・コモンズ・ジャパンのサイト(https://creativecommons.jp/)をご覧ください。
症例は51歳男性,発熱,咳嗽,筋肉痛で発症し前医で肺炎と診断され加療受けたが症状が悪化したため当科を受診した。頭痛,鼻出血を伴い,炎症反応高値,血清Cr上昇,尿蛋白+,尿潜血2+,胸部CTで両側肺野に大小の多発結節影,浸潤影,すりガラス陰影,末梢肺血管の拡張と毛羽立ち,縦隔リンパ節腫大など多彩な陰影を認めた。入院後に急速進行性糸球体腎炎を呈し,MPO-ANCA陽性,PR3-ANCA陰性であった。主要症状と肺生検に基づき多発血管炎性肉芽腫症と診断し,ステロイドパルス療法とシクロホスファミドパルス療法により軽快退院した。
多発血管炎性肉芽腫症(granulomatosis with polyangiitis:GPA)は上下気道を障害する壊死性肉芽腫性炎症で,小型血管を主として中型血管まで障害する壊死性血管炎である[1]。典型的な胸部CT所見は多発性,両側性に認められる結節影,腫瘤影であり[2],PR3-ANCAが高率に陽性を示すとされる[3]。今回,我々は多彩な胸部異常影を呈したMPO-ANCA陽性のGPAの症例を経験したので,文献的考察を加えて報告する。
症例:51歳,男性。
主訴:発熱,咳嗽,筋肉痛。
既往歴:20歳,急性A型肝炎。
家族歴:なし。
喫煙歴:40本×31年(20〜51歳)。
職業歴:運転手。
現病歴:20XX年7月6日発熱,咳嗽,筋肉痛が出現したため7月13日近医を受診し,アジスロマイシン500mg 1×3日間を処方された。症状改善せず,頭痛および鼻出血も出現したため,7月16日当科を受診した。胸部X線写真(図1)で両側下肺野の血管影の不鮮明化,およびWBC 1,4740/µL,CRP 11.99mg/dLで炎症反応上昇を認めたことから,肺炎が疑われガレノキサシン400mg 1×を処方された。7月20日再診時に炎症反応悪化と胸部CT(図2)で両肺多発結節影,縦隔リンパ節腫大などを認めたため,精査加療目的で入院となった。
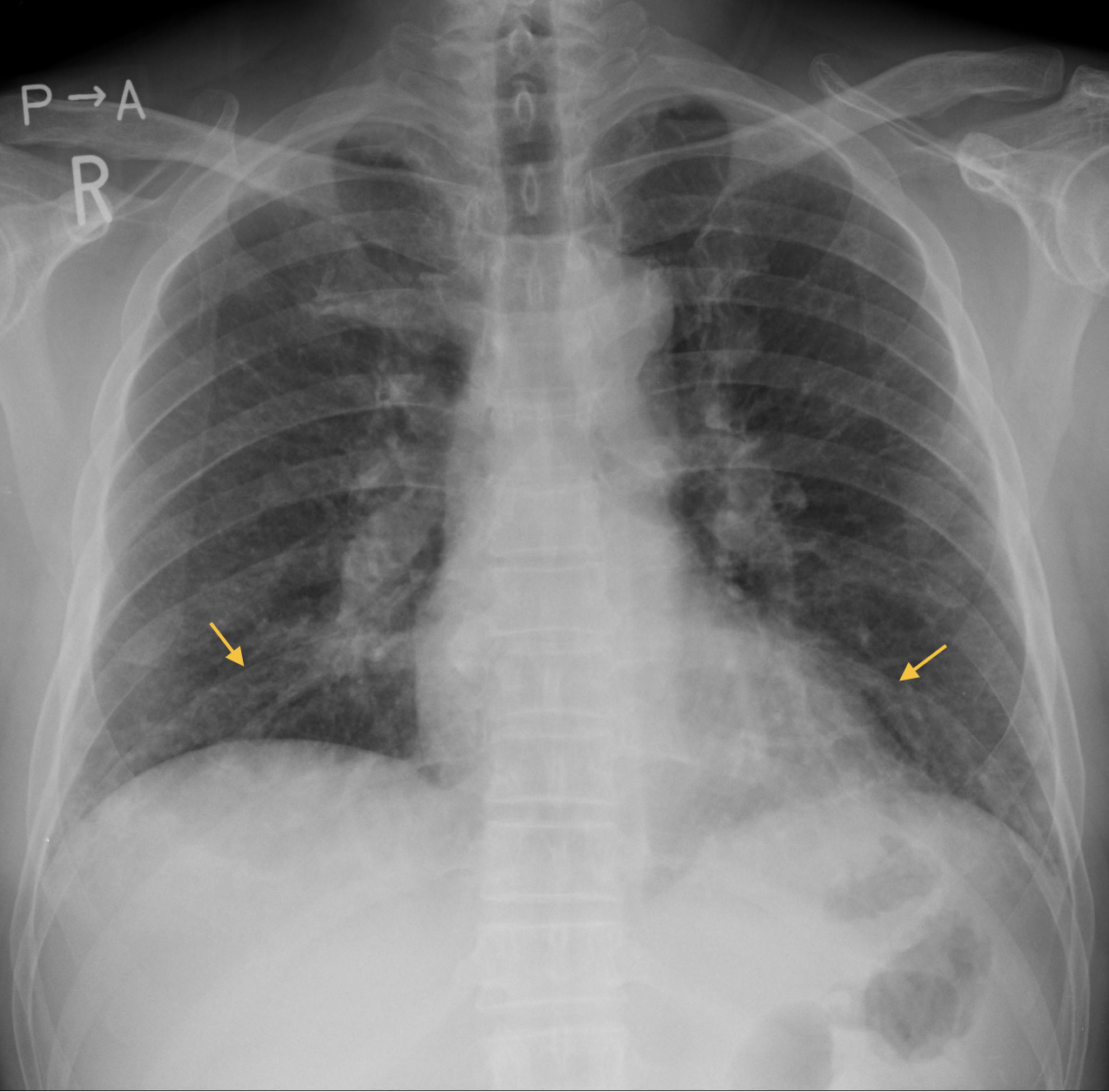
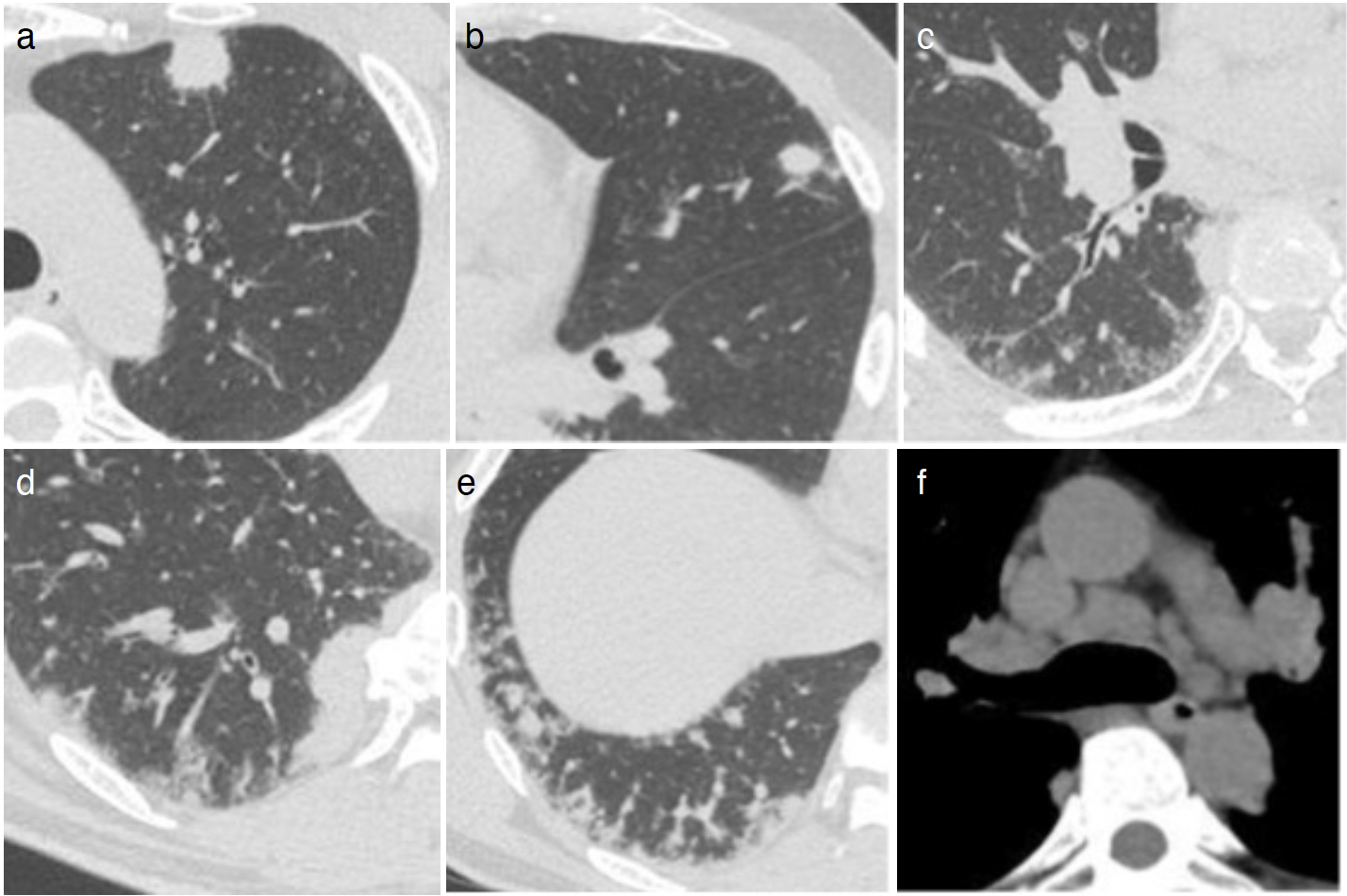
図1 入院時胸部X線写真
左上肺野に結節影と両側下肺野に肺血管影の不鮮明化を認める。
図2 入院時胸部CT
左上葉にスピキュラを伴う結節影(a),左舌区に小結節影(b),右S6に浸潤影とGGOならびに右B6気管支壁の肥厚(c),右S10の椎体に接し胸膜に癒着するように広がる塊状影(d),右肺底部に末梢肺血管の拡張と毛羽立ち,および血管周囲を中心としたGGOを認める(e)。縦隔条件では多発性の縦隔リンパ節腫大を認める(f)。
入院時現症:身長170cm,体重79kg。体温38.1℃,脈拍89/分整,SpO2 98%(室内気),表在リンパ節触知せず,呼吸音および心音に異常なし。
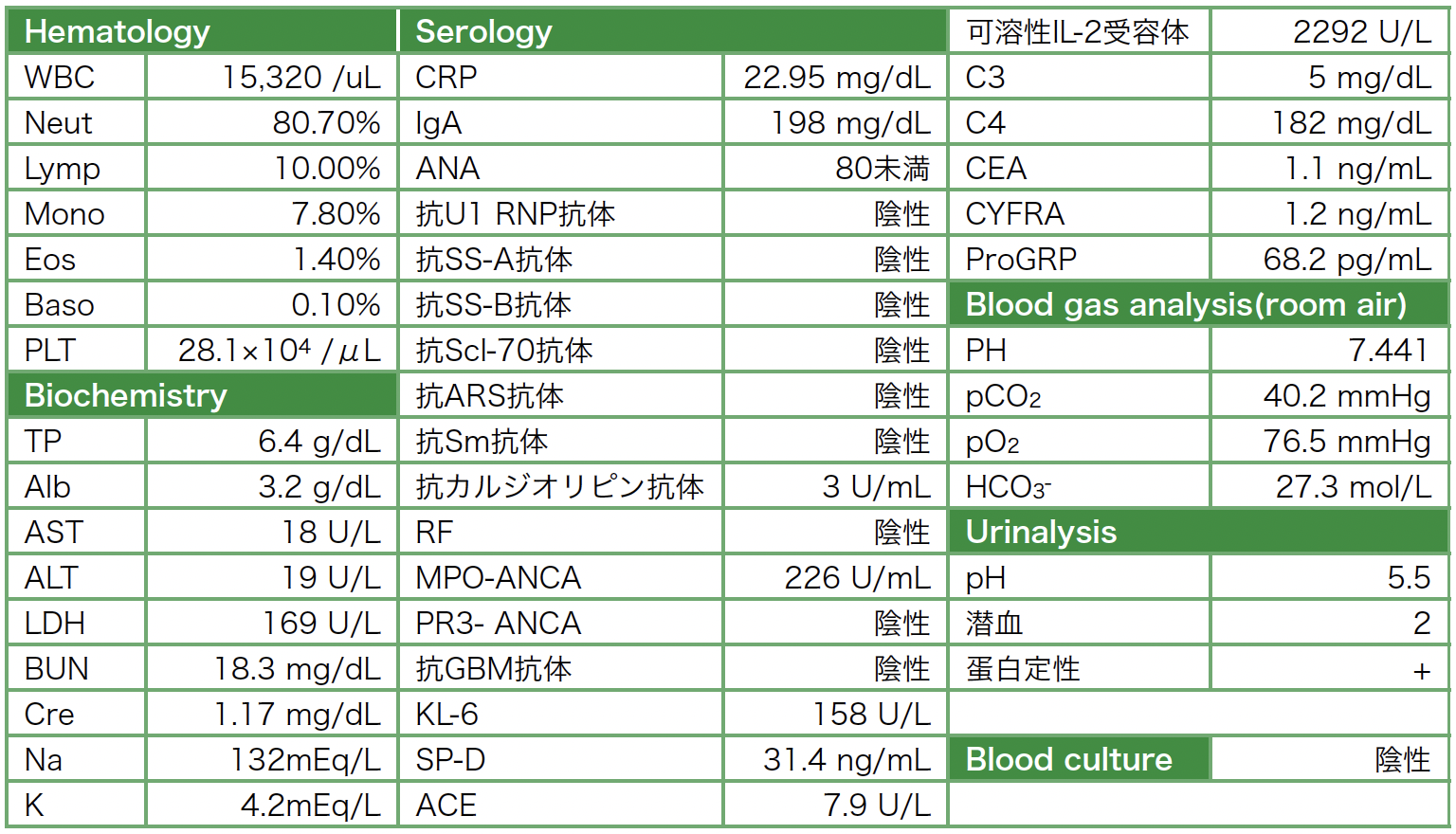
入院時検査所見(表1):血液検査でWBC 15,320/µL,CRP 29.5mg/dL,血清Cre 1.17mg/dL,尿蛋白+,尿潜血2+で炎症反応上昇と軽度の腎機能障害を認めた。
表1 入院時検査所見
臨床経過:発熱に加えて尿潜血陽性,尿蛋白陽性,血清Cr上昇を認めたため全身性血管炎を疑い,入院時にANCAなど自己抗体の測定を行った。また胸部CTで認められた肺野の結節影ならびに塊状影は,原発性肺癌が否定できない肺末梢病変であり,気管支鏡下肺生検での診断が困難と考えられたこと,GPAの診断は,臨床症状,画像所見,検査データ,病理組織所見などを組み合わせて行われるものであり,組織所見を得ることも重要と考えられたため,右S10の塊状影のCTガイド肺生検を行った。入院後腎機能は急速に悪化し,第6病日にBUN 41.3mg/dL,Cre 2.75mg/dL,尿潜血3+,尿蛋白2+となった。同日入院時採血でMPO-ANCA陽性(226U/mL)(表1)が判明したため,ANCA関連血管炎による急速進行性糸球体腎炎(臨床重症度Ⅱ)と診断し,ステロイドパルス療法(メチルプレドニゾロン1g/日3日間)後プレドニゾロン0.7mg/kg(50mg/body)/dayを投与した。厚生労働省のGPA診断基準[3]の主要症状4項目すべてを満たし,胸部CT所見もGPAに矛盾しない所見であることからMPO-ANCA陽性GPAと診断し,第11病日にシクロホスファミド500mg/m2(900mg/body)点滴静注を追加し,自他覚所見および検査所見が改善し退院となった。
肺生検の結果は以下の通りであり,GPAが疑われる所見であった。
病理組織検査:肺内に核破砕物や好中球を伴うsuppurative granulomaの像が認められる。中心部では一部壊死を伴い組織球,多核巨細胞なども認められる。一部の血管壁では弾性板の破綻,内腔の狭小化がみられ好中球の浸潤が認められ血管炎が示唆される。Ziehl-Neelsen染色やGrocott染色では明らかなmicroorganismは認められない。
抗好中球細胞質抗体(anti-neutrophil cytoplasmic antibody:ANCA)は好中球の細胞質顆粒に対する自己抗体で1982年に初めて報告され[4],1985年にオランダのWoudeらはANCAがGPAの診断や活動性評価に有用で,病因にも重要な役割を果たしていると報告した[5]。
日本人のGPA患者におけるANCAのタイプについて,大学病院を中心として多施設で行われた「ANCA関連血管炎の寛解導入の現状とその有効性と安全性に関する観察研究」(RemIT-JAV)では,GPA患者33例中PR3-ANCA陽性割合が45.5%,MPO-ANCA陽性割合が54.6%であり,MPO-ANCA陽性のGPA患者が多いと報告された[6]。一方,厚生労働省に指定難病として登録されたGPA患者のデータベースを基にした報告では,GPA患者215例中PR3-ANCA陽性割合が65.6%,MPO-ANCA陽性割合が31.0%であった[7]。欧米ではPR3-ANCA陽性のGPA患者の割合がおよそ80%と報告されており[8],MPO-ANCA陽性のGPA患者が比較的多いのが本邦の特徴であると考えられるが,その割合の差についてはデータ取集方法の相違も踏まえて評価する必要があると考えられる。
ANCAのタイプによるGPAの臨床的像の相違について,ドイツの報告ではMPO-ANCA陽性GPA 59例,PR3-ANCA陽性GPA 118例が比較され,MPO-ANCA陽性GPA患者は,PR3-ANCA陽性GPA患者よりも年齢が若く,女性が多く,重篤な臓器障害を伴うことが少ないため,強力な免役抑制療法を必要とすることが少なかったことから,ANCA関連血管炎の中では性質の異なるサブタイプであると報告されている[9]。一方,米国からはMPO-ANCA陽性GPA 33例,PR3-ANCA陽性GPA 273例を比較した結果,両群で臨床的に重要な相違は認められなかったと報告されており[10]一定の見解は得られていない。
本邦では,SadaらがMPO-ANCA陽性GPA15例,PR3-ANCA陽性GPA12例を比較した結果,MPO-ANCA陽性GPA患者は腎障害を有する割合が高く,腎障害の程度も高度であったと報告している[6]。
一方,OnoらはMPO-ANCA陽性GPA17例,PR3-ANCA陽性GPA15例を比較した結果,MPO-ANCA陽性GPA患者は腎障害が軽度であったと報告しており[11],相反する結果となっていることから,国内外を問わずANCAのタイプによるGPAの臨床的な相違についていまだ明らかではないと考えられる。
GPAの典型的な胸部CT所見は多発性,両側性に認められる結節影,腫瘤影であるが,Mahatomaらは同時に多彩な陰影を伴うと報告している[2]。結節影または腫瘤影を40~70%の症例に認め,2cmを超えるものでは25%に空洞を伴い,出血を伴う場合は結節影の周囲にGGOを認める。斑状の両側性浸潤影とGGOは25~50%に認められ,気管支血管周囲束の拡大,区域あるいは亜区域気管支壁の肥厚,より頻度の少ない所見として胸膜病変,縦郭あるいは肺門リンパ節腫大を認めると報告した。本症例も結節影に加え,すりガラス影,浸潤影,気管支壁肥厚,縦隔リンパ節腫大を伴い,さらに末梢肺血管の腫大,毛羽立ち像も認めた。胸部CTで多発結節影,腫瘤影を認めた場合,これらの所見を同時に伴うことが,GPAと他疾患の鑑別に役立つ所見であると考えられた。
今回肺癌を鑑別する必要があると考えられたこと,ならびにGPAの診断のために病理組織所見を得ることも必要と判断してCTガイド肺生検を行った。しかし血管炎はCTガイド下肺生検時の空気塞栓のリスク因子とも報告されているため[12],GPAが疑われる症例のCTガイド下肺生検は特に慎重に行われるべきである。生検に際して,穿刺角度が鋭角になることを避け,生検針が肺野を通過しないで生検可能な病変を選択するなど,空気塞栓のリスクを減らすための対応も必要である。
本論文の主旨は第246回日本呼吸器学会関東地方会(2021年9月25日 秋葉原コンベンションホール)で発表した。
利益相反:本主題に関して利益相反ない。
A 51-year-old man developed fever, cough and myalgia, and was diagnosed with pneumonia by a previous doctor. He was treated with antibiotics, but his symptoms deteriorated. When the patient visited our hospital, he also had suffered from headache and nasal bleeding. A blood examination showed elevation of inflammatory reactions and serum creatinine. Urinalysis was positive for protein and occult blood.
Chest CT showed multiple large and small nodular shadows, consolidation, ground glass shadows, bronchial wall thickening, dilation and fluffing of peripheral pulmonary blood vessels in bilateral lung fields, and mediastinal lymph node enlargement. Rapidly progressive glomerulonephritis was observed after admission. MPO-ANCA was positive, but PR3-ANCA was not. Based on the major symptoms and lung biopsy, granulomatosis with polyangiitis was diagnosed. The condition was improved by steroid and cyclophosphamide pulse therapy, and the patient was discharged from hospital.
- Jennette JC,et al. Revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum. 2012; 65: 1-11. doi: 10.1002/art.37715.
- Mahatoma I, et al. From head to toe:Granulomatosis with polyangiitis. RadioGraphics. 2021; 41: 1973–91.
- 有村義宏, ほか編. ANCA関連血管炎診療ガイドライン2017. 厚生労働科学研究班補助金難治性疾患等政策研究事業. 東京: 診断と治療社, 2017: 80-4.
- Davies DJ, et al. Segmental necrotizing glomerulonephritis with antineutrophil antibody. Br Med J. 1982; 285: 606. doi: 10.1136/bmj.285.6342.606.
- Van der Woude FJ, et al. Autoantibodies against neutrophils and monocytes;tool for diagnosis and marker of disease activity in Wegener's granulomatosis. Lancet. 1985; 1: 425-9. doi:10.1016/S0140-6736(85)91147-X.
- Sada K, et al. Classification and characteristics of Japanese patients with antineutrophil cytoplasmic antibody-associated vasculitis in a nationwide, prospective, inception cohort study. Arthritis Res Ther. 2014; 16 R101. doi: 10.1186/ar4550.
- Nagasaka K, et al. Nation-wide survey of the treatment trend of microscopic polyangiitis and granulomatosis with polyangiitis in Japan using the Japanese Ministry of Health, labour and Welfare Database. Modern Rheumatol. 2021; 00: 1-8. doi: 10.1093/mr/roab088.
- Cartin-Ceba R, et al. Pathogenesis of ANCA-associated vasculitis. Curr Rheumatol Rep. 2012; 14: 481-93. doi: 10.1016/j.rdc.2010.05.006.
- Jan H, et al. Myeloperoxidase-antineutrophil cytoplasmic antibody(ANCA)-positive granulomatosis with polyangiitis(Wegener's) is a clinically distinct subset of ANCA-associated Vasculitis. Arthritis Rheumatol. 2016; 68: 2953-63. doi: 10.1002/art.39786.
- Eli M, et al. Myeloperoxidase-antineutrophil cytoplasmic antbody(ANCA)-Positive and ANCA-negative patients with granulomatosis with polyangitis(Wegener's): distinct patient subsets. Arthritis Rheumatol. 2016; 68: 2945-52. doi: 10.1002/art.39812.
- Ono N, et al. Characteristics of MPO-ANCA positive granulomatosis with polyangitis: a retrospective multi-center study in Japan. Rheumatol Int. 2015; 35: 555-9. doi: 10.1007/s00296-014-3106-z.
- Kramer M, et al. Review of thoracic causes of systemic arterial air embolism on computed tomography. J Thorac Imaging. 2020; 35: 68-74.