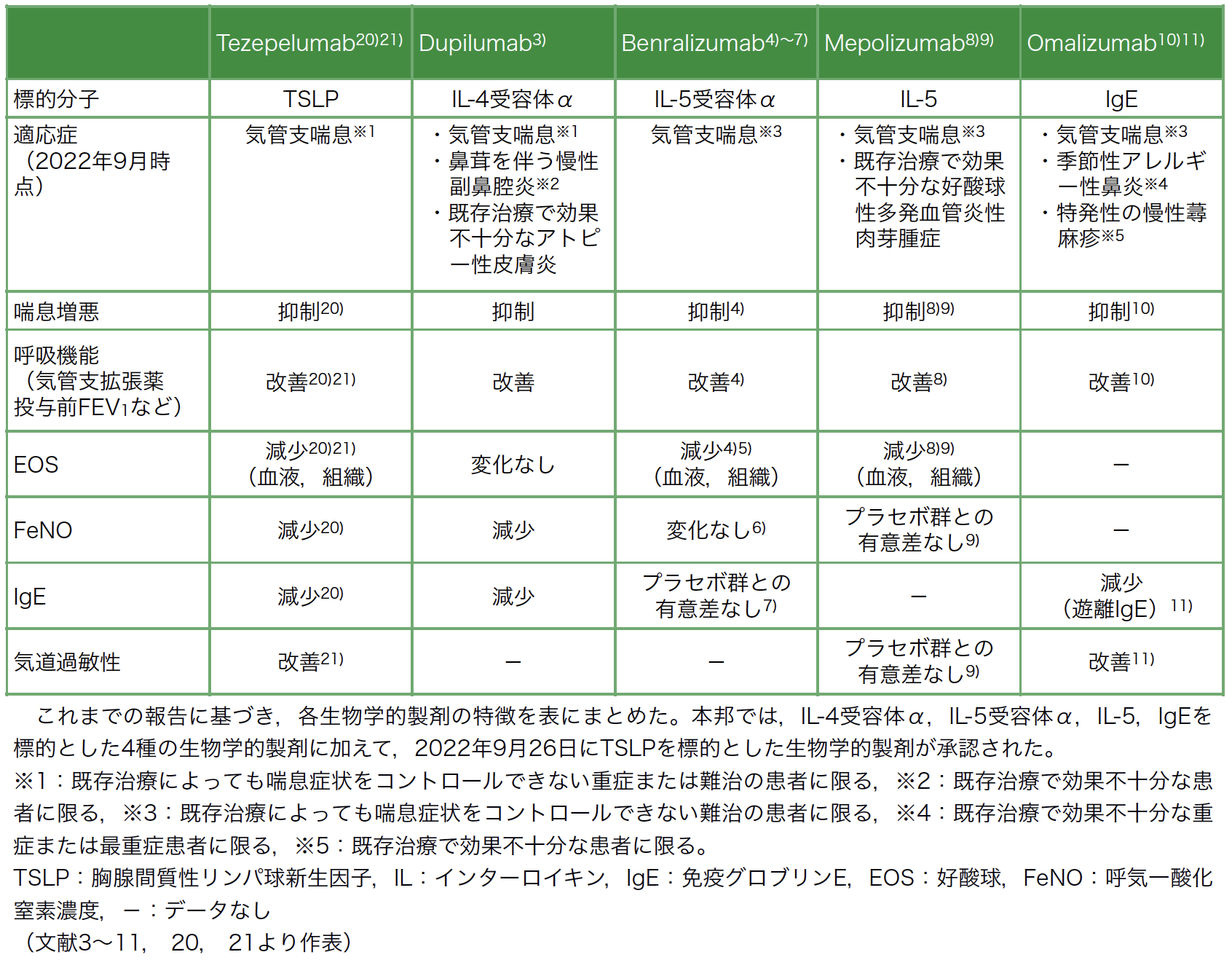
Tezepelumabは,ヒトTSLPに高親和性で結合し,ヘテロ二量体のTSLP受容体との相互作用を阻害する遺伝子組み換えヒトIgG2λのモノクローナル抗体である。これまでに実施されたTezepelumabの臨床試験では,重症喘息患者において,血中好酸球数やIgE,呼気中一酸化窒素濃度(FeNO)のバイオマーカー値によらない喘息増悪抑制だけでなく,血中好酸球やFeNOなどのバイオマーカー自体の低下,また気道過敏性の改善効果が報告されている(表1)[20][21]。
1.重症喘息患者における主要バイオマーカーに対するTezepelumabの作用
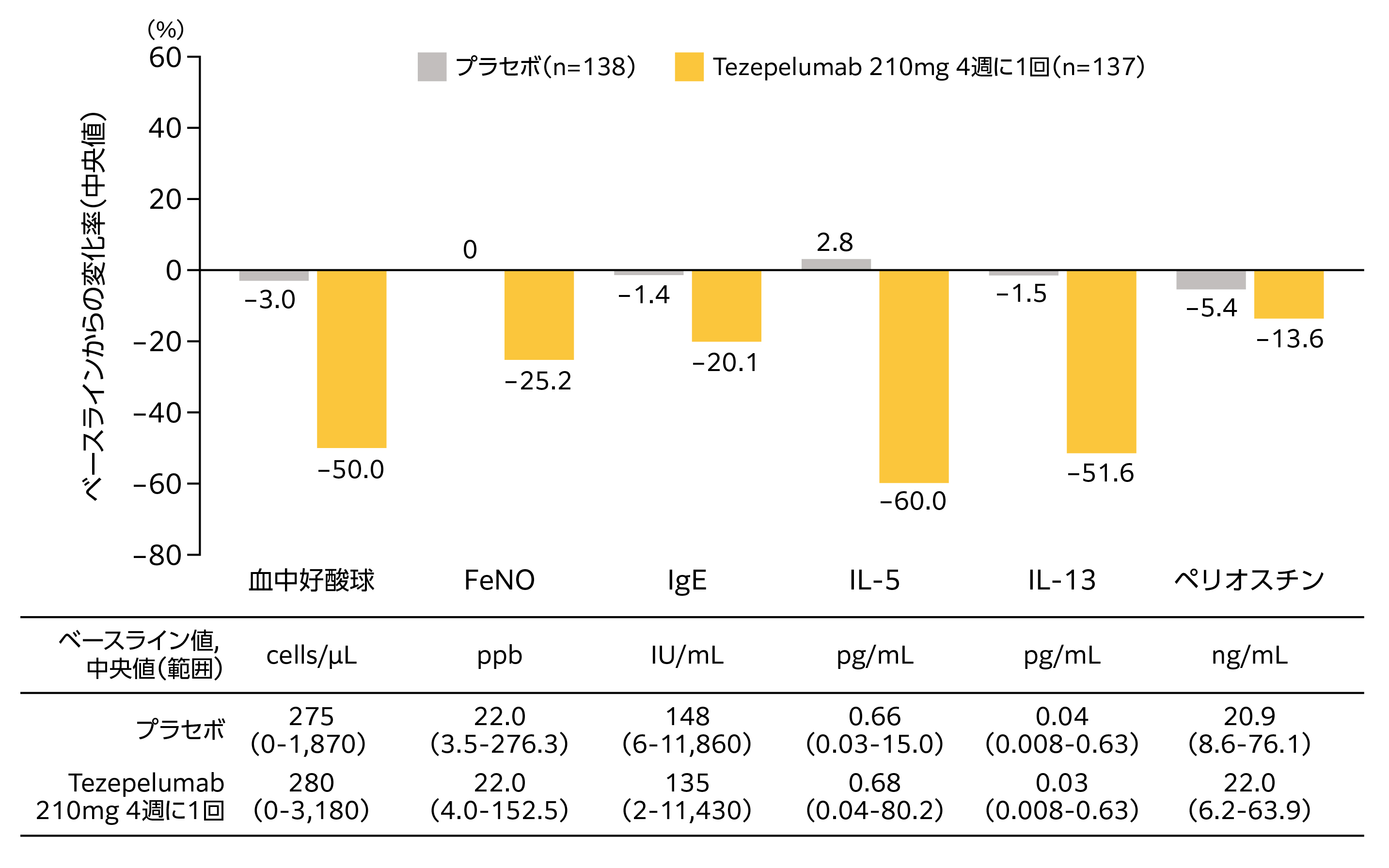
国際共同第3相NAVIGATOR試験では,中~高用量ICSに長時間作用性β2刺激薬(LABA)を併用してもコントロール不良の重症喘息患者を対象に,Tezepelumab 210mgを4週に1回,52週間投与した。52週時点の喘息の主要バイオマーカーのベースラインからの変化量〔最小二乗平均±標準誤差(プラセボ群との差,95%信頼区間)〕は,血中好酸球数−170±9(−130,−156~−104)cells/μL,FeNO −17.3±1.2(−13.8,−17.1~−10.6)ppb,血清総IgE値−164.4±34.4(−208.0,−303.7~−112.3)IU/mLと低下が確認された[20]。血中好酸球数とFeNOは投与開始2週時点から低下が認められ,血清総IgE値は52週間にわたり徐々に低下した[20]。
国際共同第2相PATHWAY試験では,中~高用量ICSにLABAを併用してもコントロール不良の重症喘息患者を対象に,Tezepelumab 70mgを4週に1回(低用量),210mgを4週に1回(中用量),280mgを2週に1回(高用量)の3群にて52週間治療したところ,Tezepelumab 210mgを4週に1回(中用量)群において,Type2サイトカインのIL-5,13を低下させた(図2)[22][23]。さらに,海外第2相CASCADE試験では,中~高用量ICSに一剤以上の長期管理薬を併用してもコントロール不良の喘息患者を対象に,Tezepelumab 210mgを4週に1回,28週間投与することにより,気道粘膜下の好酸球数が89%減少し,プラセボ群の25%と比較して,有意に低下することが気道生検による組織評価で確認された(名目上のp<0.0010)[21]。
図2 ベースラインから52週時点までの主要バイオマーカーの変化率(PATHWAY試験)
Tezepelumab 210mgを4週に1回(中用量)群およびプラセボ群における52週時点のバイオマーカーの変化率を算出した。
IL:インターロイキン,FeNO:呼気一酸化窒素濃度,IgE:免疫グロブリンE,TARC:胸腺および活性化制御ケモカイン
(文献23より,許諾を得て改変)
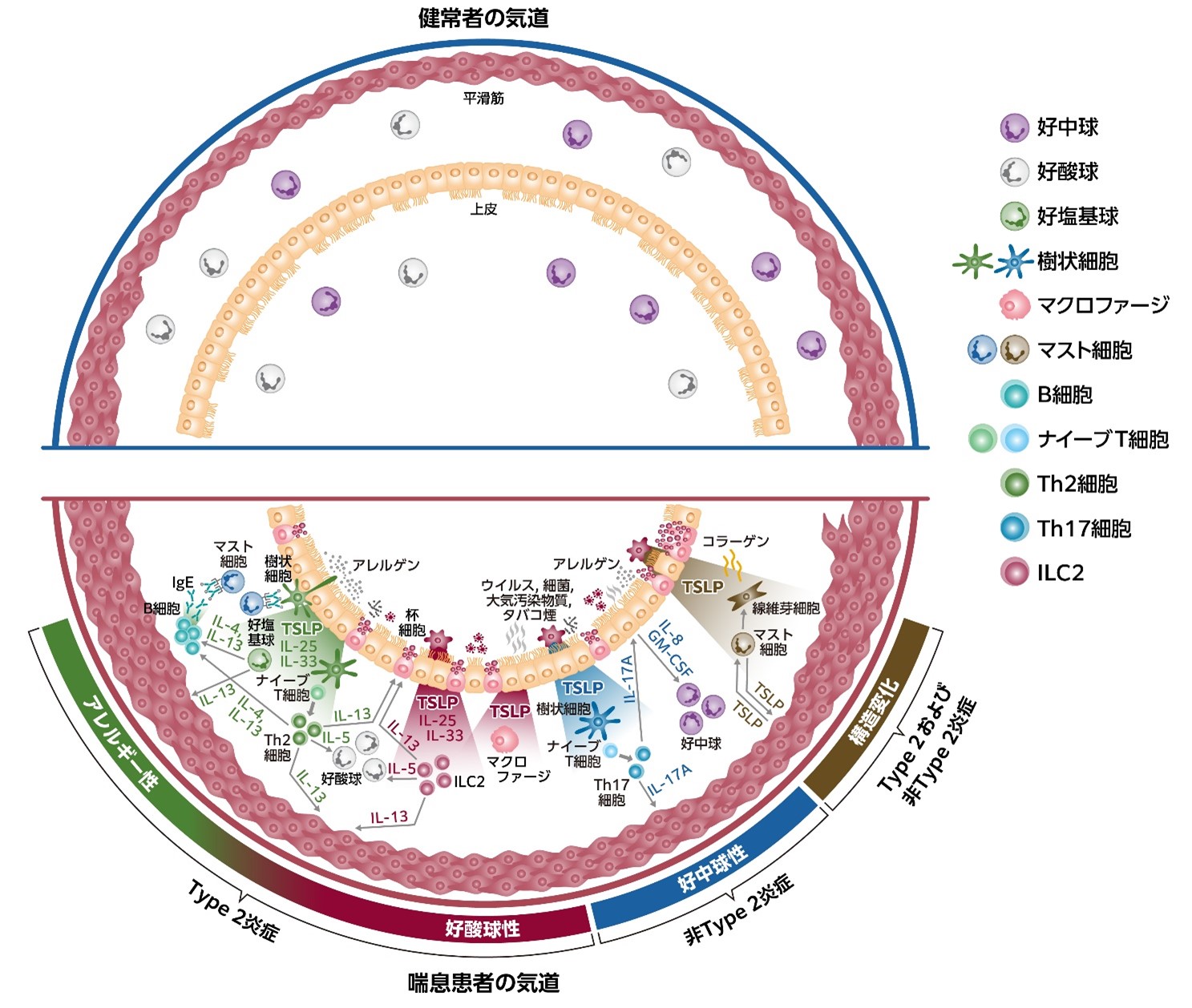
これらの広範囲なバイオマーカーの低下から,Tezepelumabは炎症カスケードの上流でTSLPを阻害することにより,下流の多様な免疫細胞を抑制し,幅広いタイプの重症喘息患者に対して有効性を示す可能性が示唆された。なお,血中好酸球の速やかな低下は,Tezepelumabが獲得免疫経路だけでなく,ILC2を中心とする自然免疫経路にも作用していることを反映した結果と考えられる[13]。
2.重症喘息患者における気道過敏性に対する有効性
CASCADE試験では,マスト細胞などからのメディエーター産生を通じて気道を収縮させるマンニトールの刺激による気道過敏性に対するTezepelumabの有効性も評価された[21]。本試験では,Tezepelumab投与によるマスト細胞数の変化は認められなかったものの,気道過敏性は,プラセボ群に対し有意な低下が認められた(p<0.05)(図3)。また,Tezepelumabによる気道過敏性の低下は,軽症アレルギー性喘息患者を対象とした海外のアレルゲン吸入誘発試験でも報告されており,投与開始83日目において,プラセボ群と比較し,有意な低下が認められている(p<0.05)[24]。
Tezepelumabは重症喘息の気道過敏性を低下する可能性が示された。
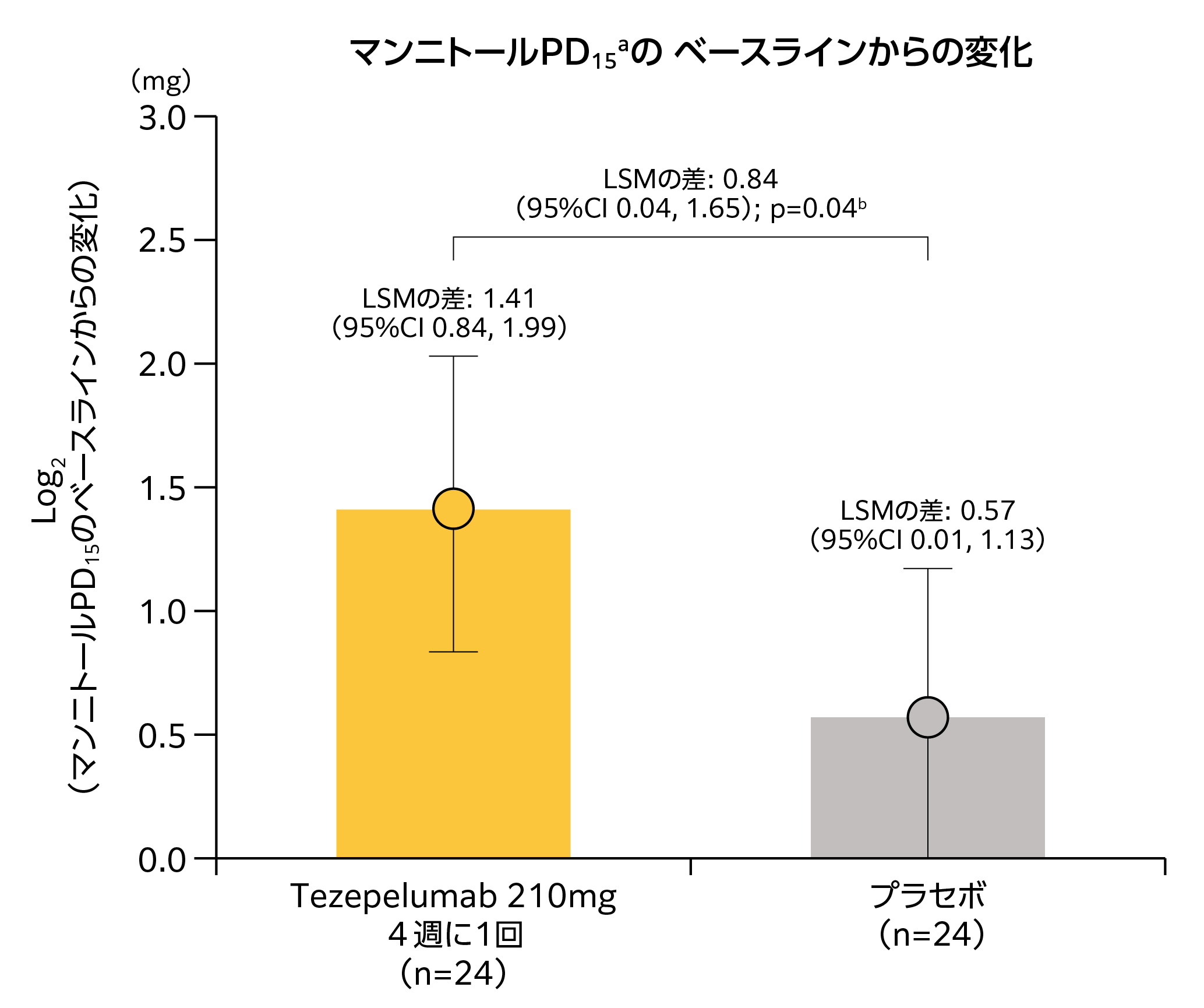
図3 マンニトール刺激による気道過敏性の変化(CASCADE試験)
aベースライン(0mg)からFEV1を15%以上低下させるマンニトール用量または連続的な用量間(>0mg)においてFEV1を10%以上低下させるマンニトール用量と定義する。PD15マンニトール用量は,FEV1低下を誘発する初回の陽性反応用量とみなされる。b名目上のp値。
CI:信頼区間,LSM:最小二乗平均
(文献21より,許諾を得て転載)
3.重症喘息患者における喘息増悪および呼吸機能に対する有効性
NAVIGATOR試験では,全体集団においてTezepelumab群はプラセボ群に対し年間喘息増悪率(AAER)を56%有意に抑制した(p<0.001)[20]。ベースライン時の好酸球数別AAERでは,好酸球数300cells/µL未満のサブグループにおいて,AAERが41%減少し,プラセボ群に対し有意な抑制が認められた(p<0.001)(図4)。また,Tezepelumab群は,ベースライン時のFeNOおよびIgE値によらず,プラセボ群よりもAAERを抑制していた。
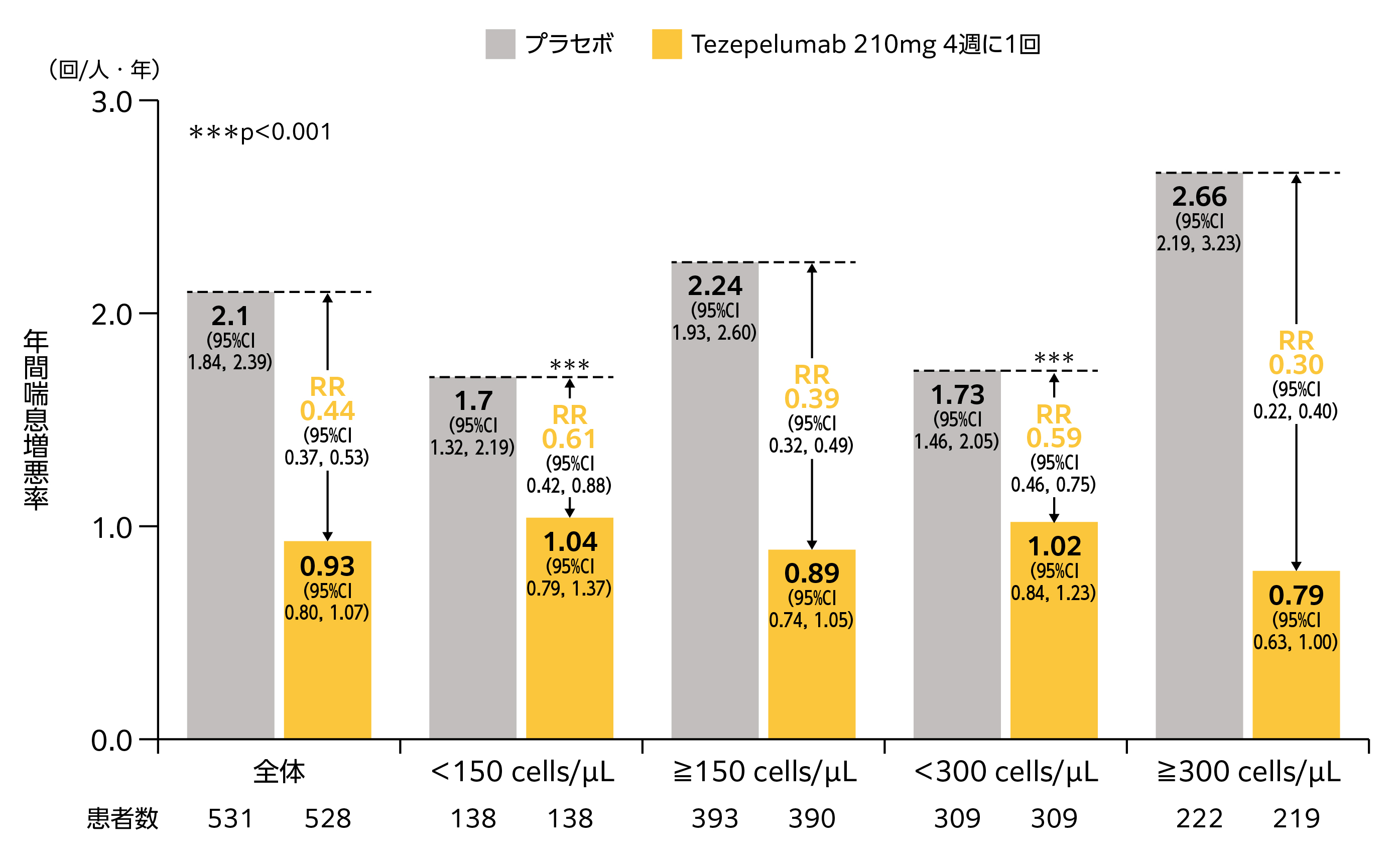
図4 ベースライン時の血中好酸球数別の年間喘息増悪率(AAER)(NAVIGATOR試験)
ベースライン時の血中好酸球数で層別化解析し,AAERを算出した。
CI:信頼区間,RR:プラセボ群に対するリスク比
(文献20より,許諾を得て転載)
©2021 Massachusetts Medical Society. All rights reserved. Translated with permission.
気管支拡張薬投与前のFEV1についても,Tezepelumab群は開始2週時点の早期からFEV1を改善し,52週時点において,プラセボ群に対しFEV1の有意な改善が認められた(p<0.001)。ベースライン時の好酸球数別FEV1においても,好酸球数150cells/µL以上および300cells/µL以上のサブグループにおいて,プラセボ群に対しFEV1の有意な改善が認められている〔プラセボ群との差(95%信頼区間),150cells/µL以上:0.17(0.11,0.23)L,300cells/µL以上:0.23(0.15,0.31)L〕。このようにTezepelumabは,Type2炎症の程度によらない重症喘息患者における喘息増悪および呼吸機能に対して有効性が示された。
4.重症喘息患者におけるOCSの減量に対する有効性
TezepelumabのOCS減量効果を検討した海外第3相SOURCE試験では,ICSとLABAによる継続治療に加え,OCSを継続的に必要とする重症喘息患者に,Tezepelumab 210mgを4週に1回,48週間投与したが,Tezepelumab群とプラセボ群の間でOCSの減少率に有意差は認められなかった[25][26]。なお,主要評価項目であるOCSの減少率は達成しなかったが,探索的評価項目であるベースライン時の好酸球数が150cells/µL以上および300cells/µL以上のサブグループにおける解析では,Tezepelumab群は,プラセボ群と比べて,顕著なOCS減量が認められた〔累積オッズ比(95%信頼区間),低値:2.58(1.16~5.75)倍,高値:3.49(1.16~10.49)倍〕。
複数の基礎研究において,TSLPがコルチコステロイド耐性のメディエーターである可能性が示唆されており,TezepelumabのOCS減量効果については更なる検討が予定されている[27][28]。