藤原清宏
なにわ生野病院呼吸器内科(〒556-0014 大阪府大阪市浪速区大国1-10-3)
A case of acute exacerbation of interstitial lung disease during treatment with methotrexate and filgotinib for rheumatoid arthritis
Kiyohiro Fujiwara
Department of Respiratory Medicine, Naniwa Ikuno Hospital, Osaka
Keywords:関節リウマチ,薬剤性肺炎,メトトレキサート,フィルゴチニブ/rheumatoid arthritis, drug-induced pneumonia, methotrexate, filgotinib
呼吸臨床 2023年7巻5号 論文No.e00171
Jpn Open J Respir Med 2023 Vol. 7 No.5 Article No.e00171
DOI: 10.24557/kokyurinsho.7.e00171
受付日:2023年3月6日
掲載日:2023年5月1日
©️Kiyohiro Fujiwara. 本論文はクリエイティブ・コモンズ・ライセンスに準拠し,CC-BY-SA(原作者のクレジット[氏名,作品タイトルなど]を表示し,改変した場合には元の作品と同じCCライセンス[このライセンス]で公開することを主な条件に,営利目的での二次利用も許可されるCCライセンス)のライセンシングとなります。詳しくはクリエイティブ・コモンズ・ジャパンのサイト(https://creativecommons.jp/)をご覧ください。
症例:74歳,女性。
主訴:呼吸困難,発熱。
既往歴:70歳時にアルコール性肝障害で入院歴あり。2年前から肩関節痛,膝関節痛,腰痛,手指関節痛があり,近医の整形外科にてRAと診断され,内服治療中であった。
家族歴:特記事項はない。
生活歴:喫煙歴 18歳から70歳まで20本/日。飲酒歴 18歳から70歳まで連日飲酒。
職業歴:60歳まで飲食業。
吸入歴:特記事項なし。
ペット飼育歴:特記事項なし。
現病歴:2年前から整形外科にてRA治療のため,MTX 4mg 週1回,プレドニゾロン 5mg/日を投与され,1年前からフィルゴチニブ200mg/日を処方され,関節痛は軽快していた。1カ月前から呼吸困難を自覚していたが,次第に増悪し,発熱も自覚するようになり,当院に救急搬送され入院となった。
入院時現症:身長156cm,体重55kg。意識清明。体温38.0℃。脈拍80/分,血圧116/77mmHg,呼吸数20回/分。聴診上,胸部両側に乾性ラ音を聴取した。心音は整で心雑音は聴取せず。SpO2 90%(室内空気)。神経学的所見は異常なく,ばち指なし。下腿浮腫を認めなかった。
入院時の検査所見(表1):末梢血液像については白血球数5,100/μL,赤血球数309×104/μL,血小板数16.3×104/μLで,白血球増多は認められなかった。生化学検査については尿素窒素19.4mg/dL,クレアチニン0.82mg/dL,AST 188 IU/L,ALT 39IU/L,Na 135mEq/L,K 3.3mEq/L,Cl 95IU/L,LDH 555U/L,BNP 71.5pg/mL,CRP 15.76mg/dLであった。免疫学的検査ではKL-6 604U/mL(基準値500未満),SP-D 758ng/mL(110未満),SP-A 167ng/mL(43未満),抗核抗体40倍未満,抗リウマチ因子定量15U/mL(15以下),抗CCP抗体0.5U/mL未満(0.5未満),MMP-3 328.5ng/mL(17.3〜59.7),アスペルギルス抗原陰性,β-D-グルカン5.0pg/mL未満(20.0以下)であった。鼻咽頭ぬぐい液によるSARS-CoV-2等温核酸増幅法陰性,HIV(抗原・抗体)陰性,結核菌特異的IFN-γ陰性,サイトメガロウイルスpp65抗原(C7-HRP)陰性。喀痰検査では一般細菌として緑膿菌,Klebsiella pneumoniae検出,抗酸菌は塗抹陰性,Pneumocystis jirovecii DNA陰性であった。
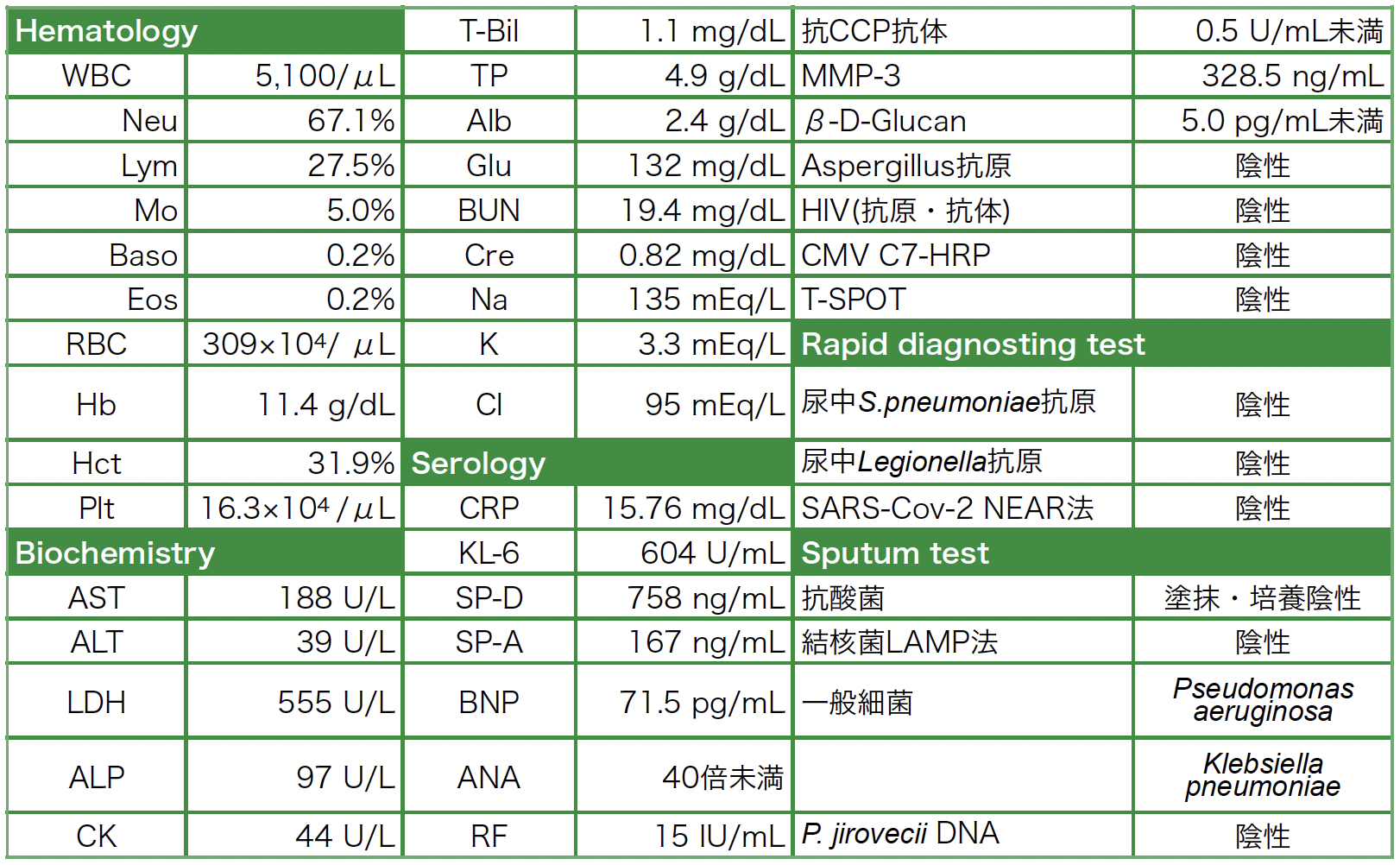
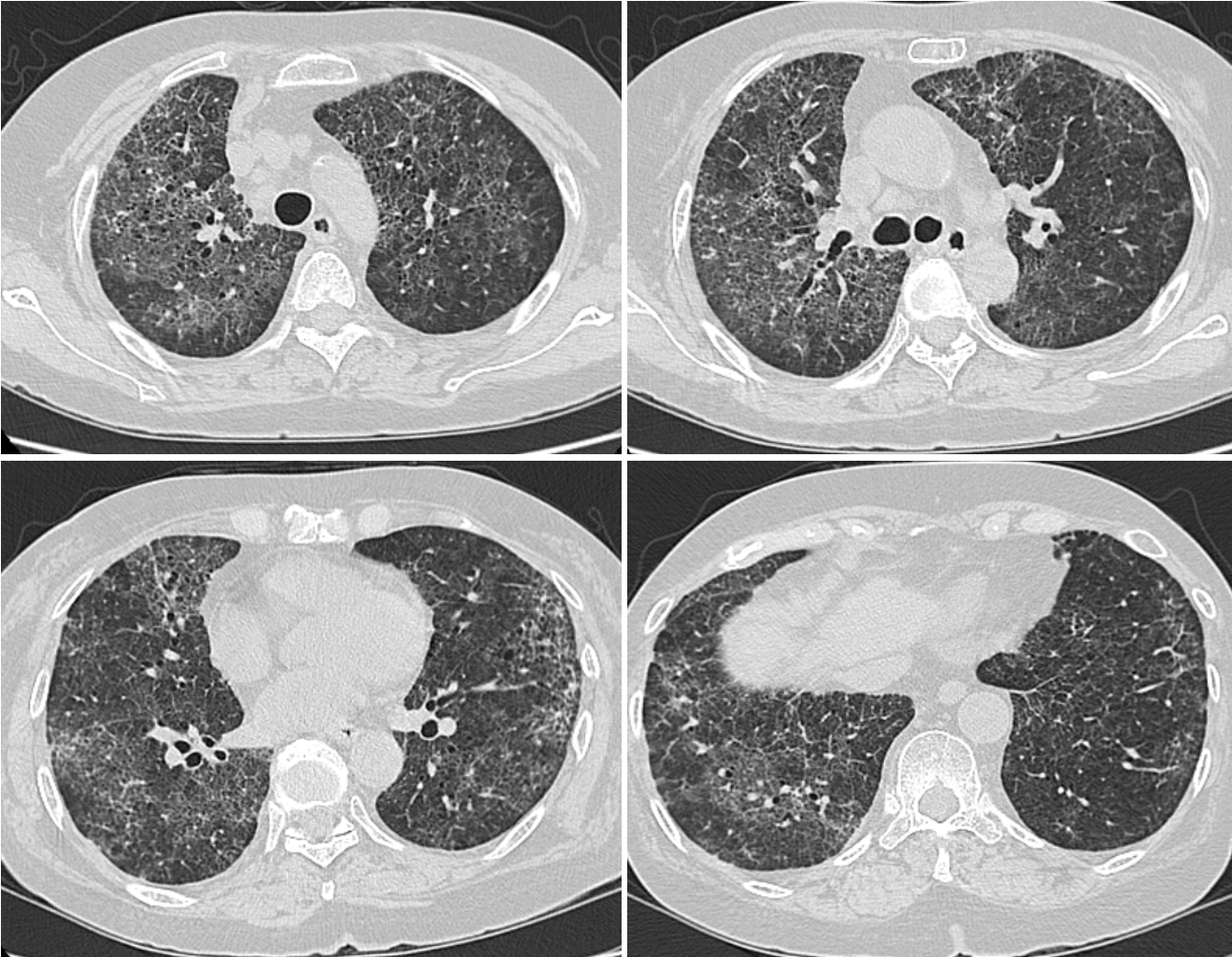
入院時の胸部CT像(図1):全肺野において斑状にすりガラス陰影と小葉間隔壁の肥厚と小葉中心性粒状影が認められ,すりガラス陰影は胸膜下の領域は比較的回避されていた。また,小葉中心性肺気腫も認められた。MTX投与1年後でフィルゴチニブ投与6カ月後における胸部CT(図2)を後方視的に読影すると,両側胸膜下に軽度の網状影が認められた。
図1 当院入院時の胸部CT像
全肺野において斑状にすりガラス陰影と小葉間隔壁の肥厚,小葉中心性粒状影が認められ,すりガラス陰影は胸膜下の領域は比較的回避されている。
図2 前医における胸部CT像
MTX投与1年後でフィルゴチニブ投与6カ月後における胸部CTを後方視的に読影すると,両側胸膜下に軽度の網状影が認められる。
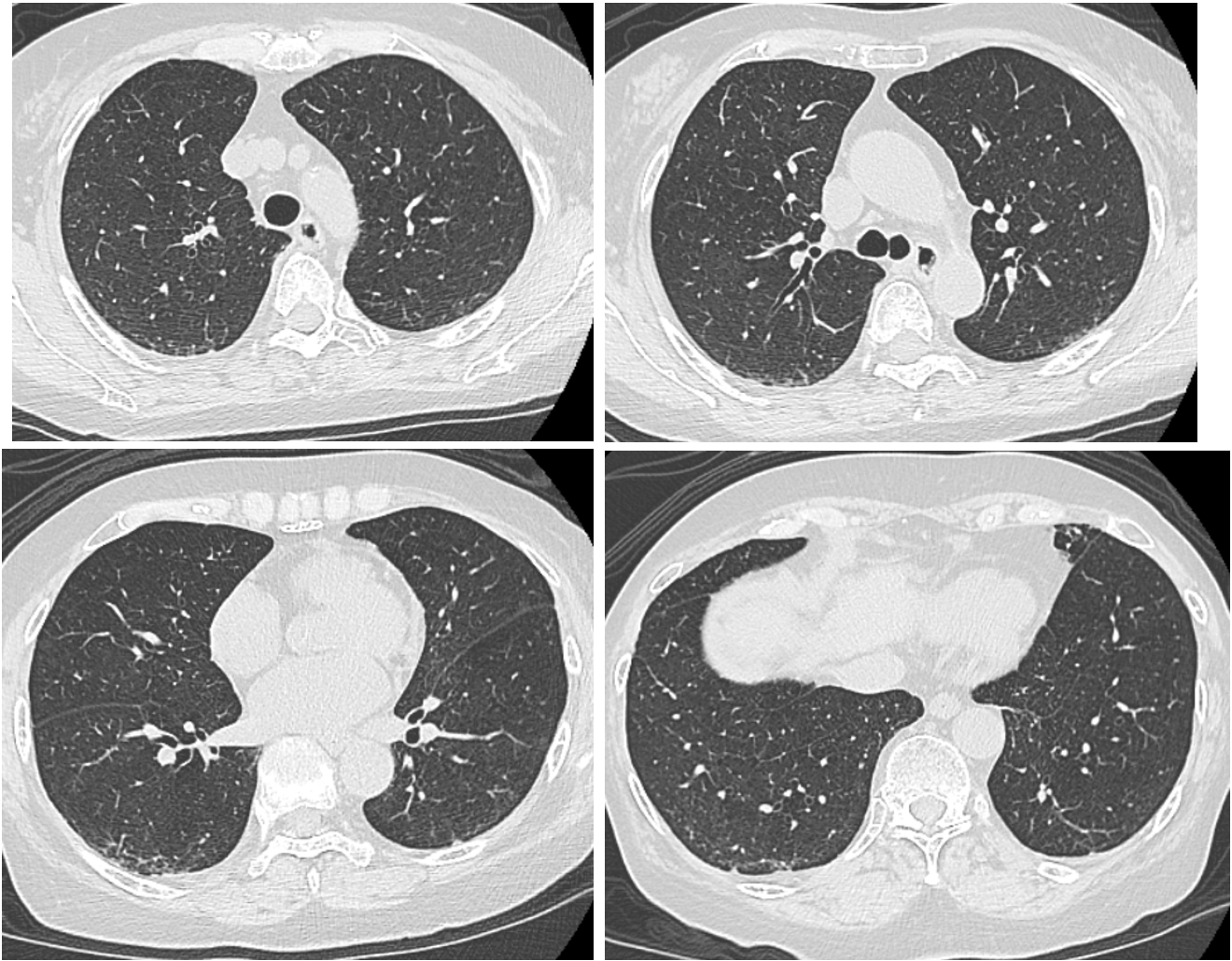
入院後経過(図3):間質性肺疾患のうち,第一に薬剤性肺炎を考え,MTXとフィルゴチニブを中止し,プレドニゾロン50mg/日から投与を開始し,7日間継続した後,漸減する方針とした。また,ニューモチスチス肺炎も否定できないため,検査結果が出るまで,スルファメトキサゾール・トリメトプリム9g/日の内服も7日間行った。また,細菌性肺炎の可能性を考慮してセフトリアキソン1g×2/日を7日間投与したが,後日,喀痰から緑膿菌などが検出されたため,セフタジジム1g×2/日に変更し,8日間投与した。酸素吸入は経鼻カニューレ4L/分で開始し,第2病日 2L/分,第3病日には1L/分に減量し,ほぼSpO2 96%で維持された。後日,β-D-グルカン陰性,Pneumocystis jirovecii DNA陰性を確認したため,11病日からスルファメトキサゾール・トリメトプリムは予防的投与とし,1g/日週3回とした。ステロイドの漸減については,プレドニゾロン40mg/日 4日間,30mg/日 5日間,20mg/日 7日間,15mg/日 7日間投与としつつ,退院後については病診連携をはかり,かかりつけの整形外科にて,10mg/日 7日間から5mg/日に減量とし,MTXとフィルゴチニブの投与はしない方針となった。入院後18病日における胸部CT像(図4)では両側肺のすりガラス影の濃度は改善していたが,牽引性気管支拡張が認められた。酸素吸入は入院後15日目まで行い,関節痛の再燃もなく,入院後27病日に退院した。
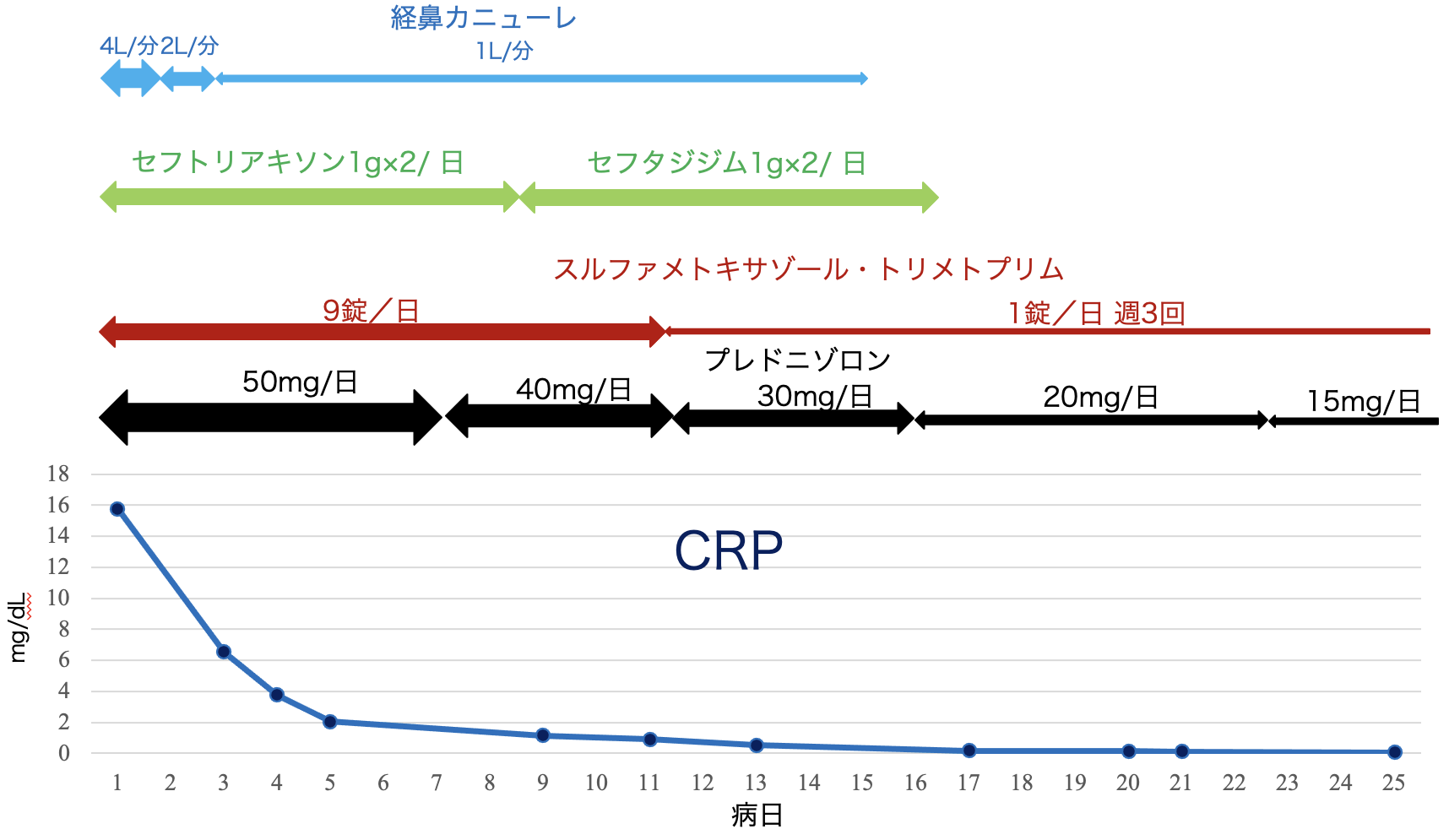
図3 入院後治療経過
図4 入院後18病日の胸部CT像
両側肺のすりガラス影の濃度は改善していたが,牽引性気管支拡張が認められる。
自験例の間質性肺炎の急性増悪については,原因として,第一に疑われたのは,薬剤性肺炎であり,第二に感染症も鑑別を要した。MTXまたはフィルゴチニブか,あるいは両者が薬剤性肺炎の原因と疑われるが,さらなる原因薬剤の確定診断は困難であった。また,RA-ILDの急性増悪も否定できないが,関節痛が軽減しており,自験例ではRA-ILDと相関すると言われるRAの活動性は乏しかった。Englandら[2]のレビューによるとRAの症例の5〜10%が重症のILDを発症し,20〜30%は呼吸器については無症状の可能性があり,RA-ILDの危険因子としては,男性,高齢,喫煙,RAの活動性,リウマチ因子や抗シトルリン化タンパク抗体が挙げられている。Sparksら[3]はRAの活動性はRA-ILD発症の危険因子としていて,高/中程度の疾患の活動性は,寛解/軽度の疾患の活動性と比較して,2倍のRA-ILDのリスクの増加と関連しているとしている。
MTX少量間欠投与による薬剤性肺炎は1983年にCannonら[4]やEngelbrechtら[5]により報告されていて,Barreaら[6]のレビューによると
0.3〜11.6%と報告されている。また,投与期間,投与量,総投与量と明らかな相関はなく,用量依存性でもないとされている[7]。MTX肺炎の中には急性の経過で,ステロイド治療にもかかわらず死亡する症例も報告されている[8]。関節リウマチ診療ガイドライン2020[9]によると,MTXの使用に関しては,ILDが軽度である場合には慎重に経過をみながら投与する。高度な呼吸器障害を有する患者〔①低酸素血症の存在(室内空気でPaO2<70 Torr),②呼吸機能検査で%VC<80%の拘束性障害,③胸部画像検査で高度の肺線維症の存在〕へのMTX投与は禁忌であるとしている。
RAに対するフィルゴチニブの作用機序について以下のように説明されている[10]。すなわち,JAK1は自然免疫及び獲得免疫に関与する複数のサイトカイン,成長因子及びケモカイン受容体の下流にあるシグナル伝達の重要なメディエーターであり,JAK1の阻害により,IL-6等の炎症性サイトカインを介したシグナル伝達が阻害され,RAの発症に関与するリンパ球の活性化及び増殖が抑制されるとしている。独立行政法人医薬品医療機器総合機構によると,臨床試験では間質性肺疾患について治験薬との因果関係が否定できない重篤な事象が発現しており,200mg/日投与例2例において死亡に至った事象も認められていることを踏まえると既承認のJAK阻害薬と同様に間質性肺疾患の発現リスクについて注意喚起するとともに間質性肺炎の既往を有する患者に対しては,本剤のリスク・ベネフィットバランスを考慮の上,慎重に投与の適否を検討するよう注意喚起する必要があるとしている[10]。一方,RA-ILDの症例に対するJAK阻害薬のうちトファシチニブとバリシチニブについて検討されており,胸部CTにおいて,線維化の病変は不変であったが,すりガラス陰影の病変は有意に減少が認められ,RA-ILDの急性増悪はなかったとしている[11]。フィルゴチニブの投与により薬剤性肺炎を発症した症例について詳細な報告例は検索した限りではなく,今後の症例の積み重ねが必要であろう。
RA患者では,免疫抑制療法を用いていることが多いことから,感染症を合併している可能性も高い[12]。KL-6に関しては薬剤性肺炎やニューモチスチス肺炎において,いずれも高値を示すことが多いため,β-Dグルカン高値は早期のニューモチスチス肺炎の鑑別診断に有用であることは報告されている[13]。MTX肺炎における画像所見はびまん性,斑状のすりガラス陰影が主体であり,時に小葉間隔壁の肥厚や網状影,小葉中心性の粒状影を伴う[14][15]。ニューモシスチス肺炎においてもびまん性のすりガラス陰影が主体であり,Tokudaら[16]は両者の画像上の鑑別は困難であることが多いとしている。
抗リウマチ薬の服用中におけるRA患者の間質性肺炎に対する正確な鑑別診断法はないため,臨床経過,画像,検査所見を総合して,早期に可能性の高い疾患治療にあたる必要があり,経過中に治療法を絞っていくべきである。自験例では,胸部CTにおいて比較的時相が均質なすりガラス陰影が両側性に認められ,胸膜下をスペアしていて,非特異性間質性肺炎類似の所見を有すると考えられ,プレドニゾロン1mg/kg/day程度で開始し,良好な結果が得られた。
A 74-year-old woman with rheumatoid arthritis was urgently admitted to our hospital due to dyspnea. The patient received methotrexate at a dose of 4 mg/week, filgotinib at 200 mg/day and prednisolone at 5 mg/day. On admission, chest CT findings showed diffuse ground glass attenuation in both lung fields; we diagnosed acute exacerbation of interstitial lung disease. Treatment was initiated with prednisolone at 60mg/day; the dose was tapered as the patient’s condition improved. Drug-induced pneumonia was suspected in this case based on laboratory data and clinical course; however, it was difficult to differentiate whether the causative agent was methotrexate, filgotinib, or both.