【投稿/症例報告】掻痒の治療に難渋した抗TIF1-γ抗体陽性皮膚筋炎を合併した小細胞肺癌の1例

鎌倉栄作*1,古川佳奈子*2,大友悠太郎*2,小澤達志*2,安部豪眞*2,大川宙太*2,東 盛志*2,髙山幸二*2,花田仁子*2,瀧 玲子*2
*1新潟大学医学部医学科総合診療学講座(〒951-8510 新潟県新潟市中央区旭町通1-757)
*2武蔵野赤十字病院呼吸器科
A case of small cell lung cancer with TIF1-γ antibody-positive dermatomyositis with difficulty in treatment of pruritus
Eisaku Kamakura*1, Kanako Furukawa*2, Yutaro Otomo*2, Tatsushi Kozawa*2, Takemoto Abe*2, Chuta Okawa*2, Seishi Higashi*2, Koji Takayama*2, Satoko Hanada*2, Reiko Taki*2
*1Department of General Medicine, Niigata University School of Medicine, Niigata
*2Japanese Red Cross Musashino Hospital
Keywords:肺癌,皮膚筋炎,抗TIF1-γ抗体,腫瘍随伴症候群,掻痒,かゆみ/lung cancer, dermatomyositis, anti-TIF1-gamma antibody, paraneoplastic syndrome, pruritus, itch
呼吸臨床 2023年7巻8号 論文No.e00178
Jpn Open J Respir Med 2023 Vol. 8 No.6 Article No.e00178
DOI: 10.24557/kokyurinsho.7.e00178
受付日:2023年3月20日
掲載日:2023年8月31日
©️Eisaku Kamakura, et al. 本論文はクリエイティブ・コモンズ・ライセンスに準拠し,CC-BY-SA(原作者のクレジット[氏名,作品タイトルなど]を表示し,改変した場合には元の作品と同じCCライセンス[このライセンス]で公開することを主な条件に,営利目的での二次利用も許可されるCCライセンス)のライセンシングとなります。詳しくはクリエイティブ・コモンズ・ジャパンのサイト(https://creativecommons.jp/)をご覧ください。
72歳の男性。全身の掻痒を伴う紅斑と筋力低下が出現し,数日の経過で歩行困難となり救急外来を受診した。胸部CT上,右肺下葉に腫瘤性病変があり,経気管支生検を施行し小細胞肺癌と診断した。また皮膚生検により皮膚筋炎と診断,抗TIF1-γ抗体が陽性だった。肺癌に対し化学療法を施行したところ腫瘍は縮小し,筋力および皮膚所見は改善した。しかし肺癌が増悪すると掻痒のみ再燃し,治療に難渋した。睡眠の妨げになるなど,QOLを損なうほどであった。当初は皮膚筋炎の皮疹による掻痒と判断していたが,その後の経過で皮膚所見と掻痒症状が乖離しており,腫瘍随伴症候群としての掻痒である可能性を考えた。
皮膚筋炎と悪性腫瘍の合併はよく知られているが,特に抗TIF1-γ抗体陽性の場合は,その頻度が高い。また掻痒は皮膚筋炎の症状の1つであるが,本症例では皮膚所見が改善後も肺癌の増悪とともに掻痒のみ増悪し,その治療に難渋した。肺癌の病勢と皮膚所見,掻痒の経過が乖離しており,興味深い経過と考え,文献的考察を加えて報告する。
症例:72歳,男性。
主訴:全身の皮疹,歩行困難。
既往歴:高血圧症,小児喘息。
アレルギー歴:特記事項なし。
家族歴:特記事項なし。
生活歴:喫煙歴40本×51年。
内服薬:アジルサルタン。
現病歴:来院1カ月前に掻痒を伴う皮疹が,来院2週間前に下肢の脱力が出現。歩行困難となり当院救急外来を受診。スクリーニングCTで肺癌が疑われ,精査加療目的に入院となった。
入院時身体所見:身長165.0cm,体重58.8kg。
聴診所見:前胸部で喘鳴を聴取した。
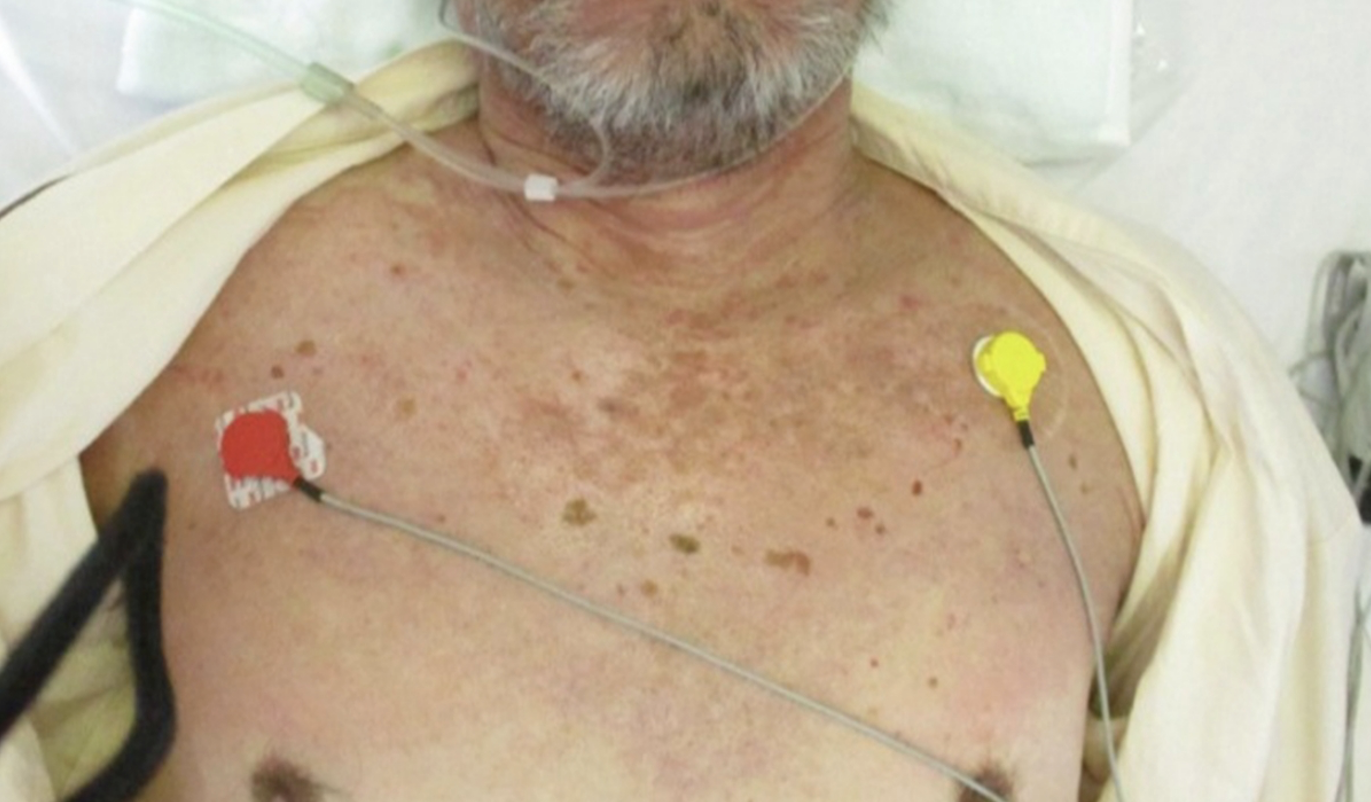
皮膚所見:顔面・頸部・体幹・四肢に分布する,掻爬痕・鱗屑・浸出液・浮腫を伴う紅斑あり(図1)。ゴットロン徴候およびショール徴候が陽性であった(図2)。一部にびらんを伴っていた。
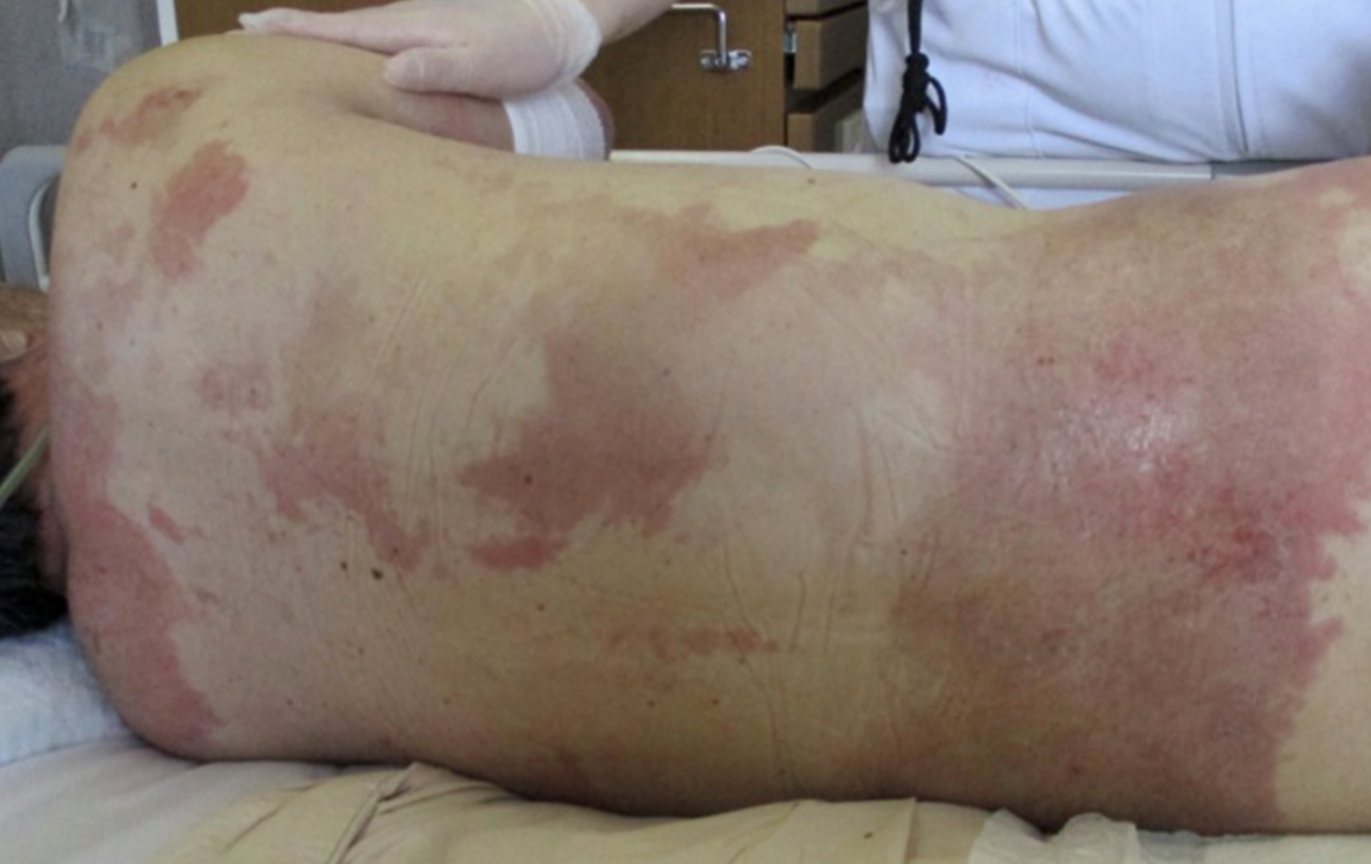
図1 初診時の皮膚所見(背部)
掻爬痕・鱗屑・浸出液・浮腫を伴う紅斑あり。一部にびらんを伴う。
図2 初診時の皮膚所見(頸部~胸部)
散在する紅斑と,ショール徴候を認める。
体表所見:頸部・腋窩・鼠径部リンパ節に,明らかな腫脹はなかった。
神経学的所見:上肢・近位筋優位の筋力低下あり(MMT;三角筋2〜3/5,上腕二頭筋3/5,上腕三頭筋3/5)。左右差はなかった。
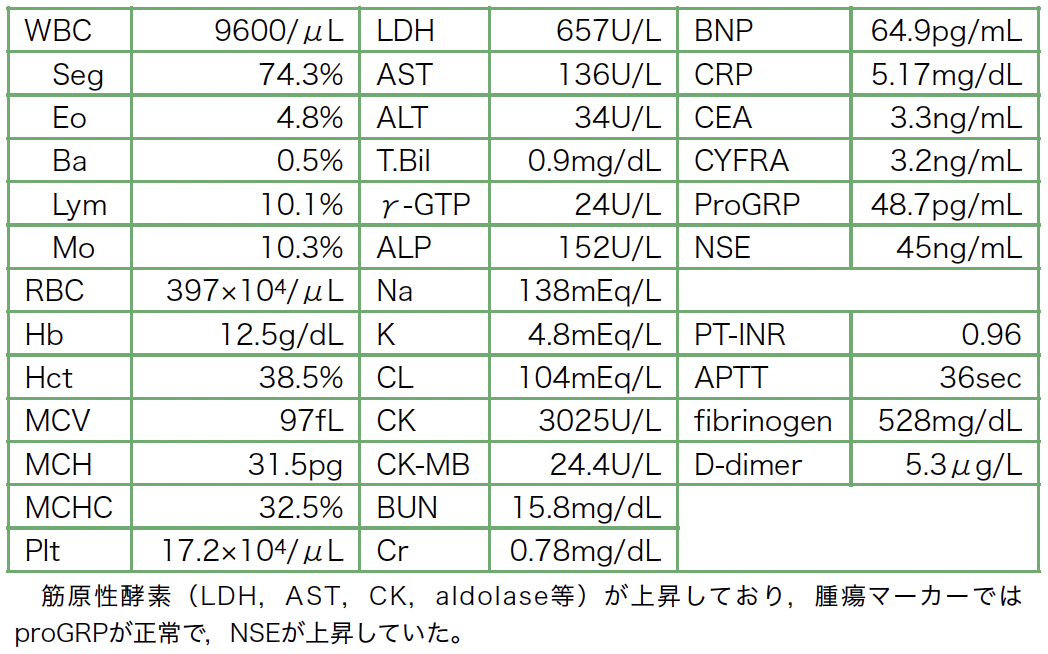
入院時検査所見(表1):筋原性酵素(LDH,AST,CK,aldolase等)が上昇しており,腫瘍マーカーではproGRPが正常で,NSEが上昇していた。
表1 初診時検査成績
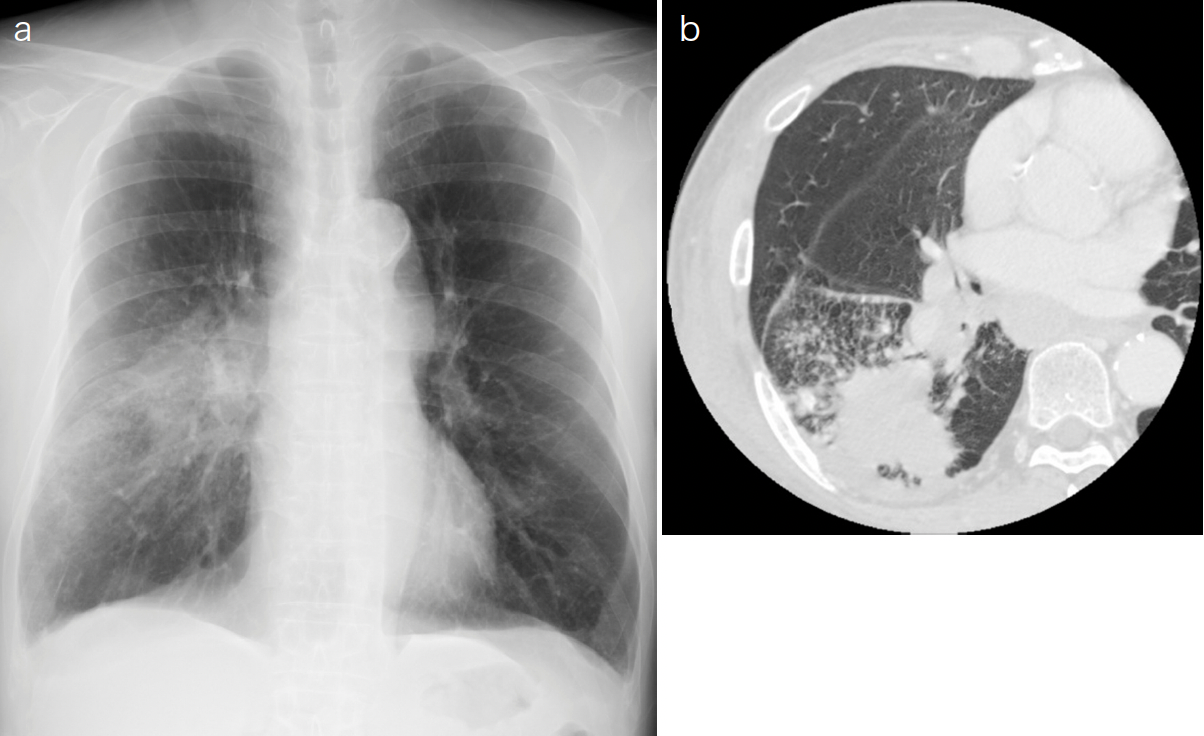
画像所見(図3):胸部X線では,肺門部から右下肺の末梢にかけて分布する浸潤影を認めた。一部で透過性が低く,腫瘤様にも見えた。肋横隔膜角は鈍であった。胸部CTでは右肺下葉に腫瘤影を認め,また少量胸水および縦隔リンパ節の腫大を認めた。
図3 初診時胸部画像所見
a. 胸部X線:胸部X線。肺門部から右下肺の末梢にかけて分布する浸潤影あり。一部透過性が低く,腫瘤様でもある。肋横隔膜角は鋭。
b. 胸部CT:右肺下葉に腫瘤影を認め,また少量胸水および縦隔リンパ節の腫大を認めた。
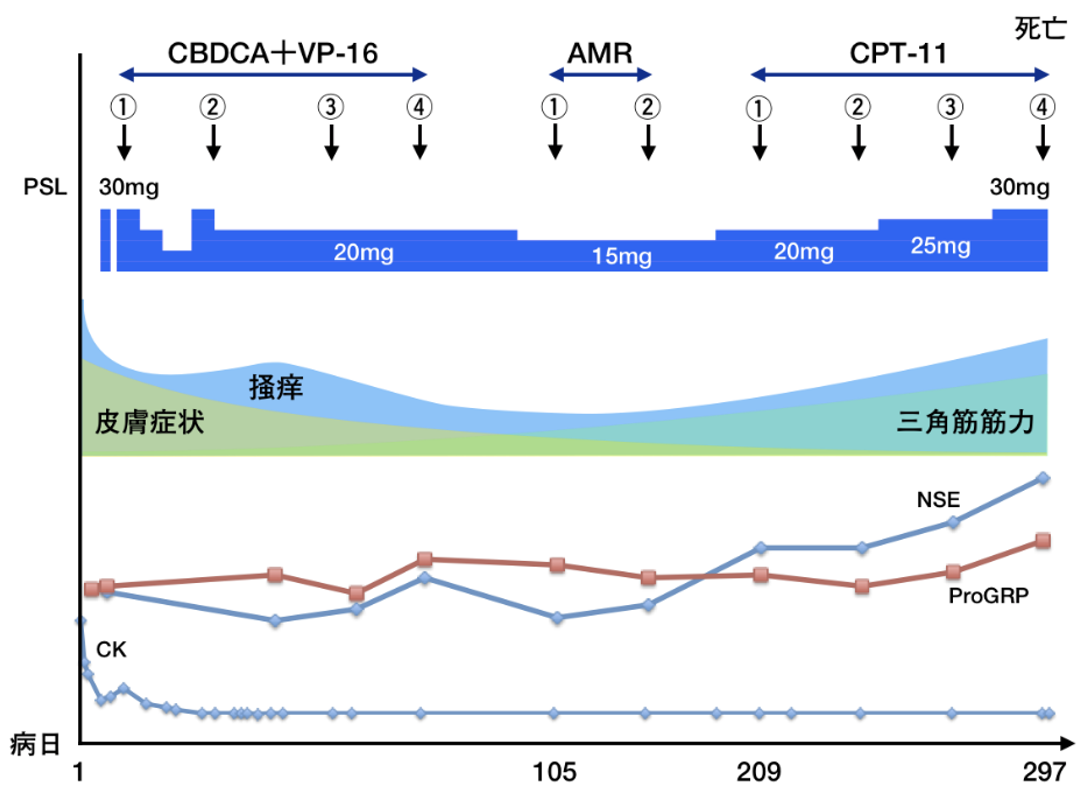
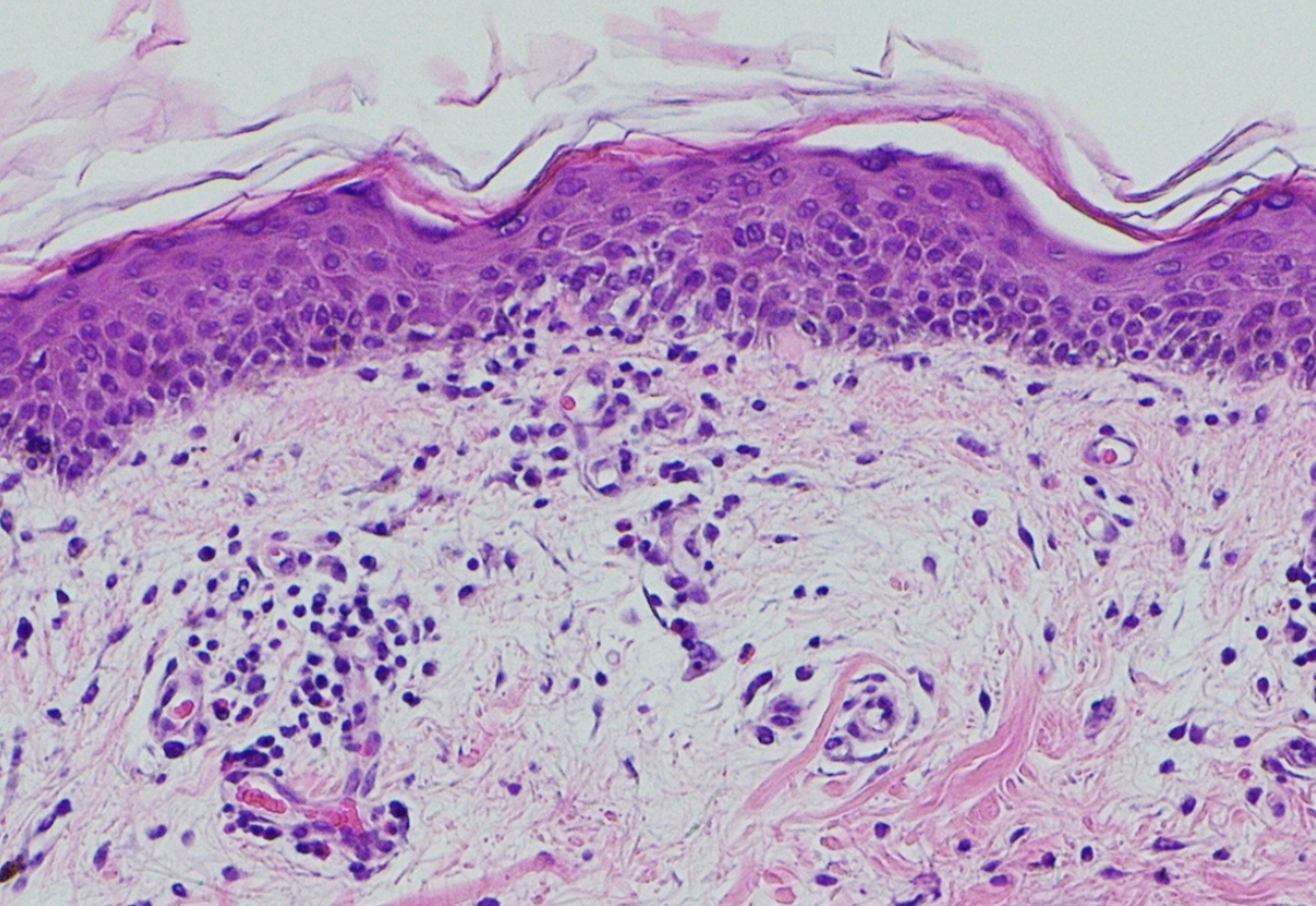
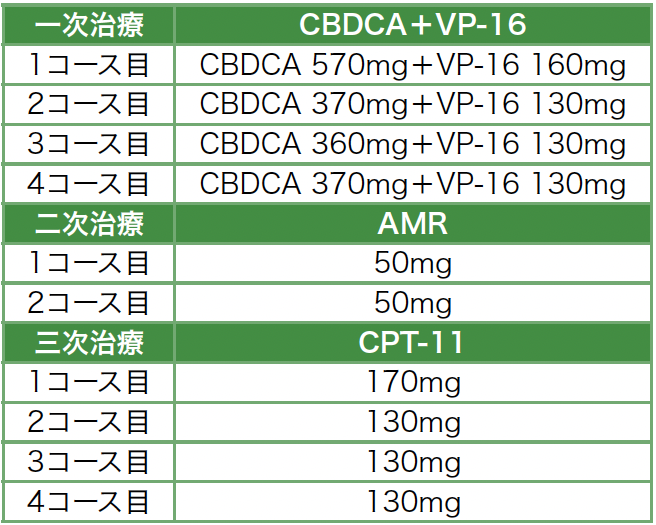
臨床経過(図4):右肺下葉の腫瘤性病変に対し経気管支生検を行い,画像検査と合わせて進展型小細胞肺癌(T3N3M1a,stage IVA)と診断した。また大腿の皮膚生検を行ったところ,真皮上層の血管周囲にリンパ球と組織球が浸潤しており,表皮真皮境界部には角化細胞の空胞変性を認め,炎症性皮膚疾患の像として矛盾しなかった(図5)。身体所見および生検の結果より,厚生労働省の診断基準(2019)[1]と照らし合わせて皮膚筋炎と診断した。後日,抗TIF1-γ抗体が陽性と判明した。肺癌の診断直後よりカルボプラチン+エトポシド(CBDCA+VP-16)による抗がん化学療法(表2)を施行し,腫瘍の縮小傾向を認めた。図1および図2で示した皮疹は改善傾向だったものの,掻痒が残ったため可及的に対症療法を行った。外用鎮痒薬,鎮痛薬および抗ヒスタミン薬の内服,またprednisolone(以下PSL)の内服を30mg/day(約0.5mg/kg/day)で開始した。化学療法の開始後に皮膚症状や筋力が改善し,CKも正常化した。CBDCA+VP-16療法を2コース終了した時点でPR(partial response)と判定し,合計4コースを実施したが,その後1カ月で増悪した。2次治療としてアムルビシン(AMR),3次治療としてイリノテカン(CPT-11)療法を施行するも,いずれもPD(progressive disease)と判定した。皮疹の再燃やCKの上昇はなかったものの,肺癌の進行に従い睡眠を妨げるほどに掻痒が悪化した。対症療法としてデュロキセチン・トラネキサム酸・ナルフラフィンなども使用しつつ,最終的には漸減していたPSLを再び増量して対応したが,効果は不十分であった。肺癌の病勢は悪化の一途をたどり,初診から第297病日に死亡した。
図4 臨床経過
化学療法を開始すると,肺癌に対する治療効果が現れるとともに症状や検査値が改善した。その後,病勢の再燃に従い掻痒が悪化した。
図5 大腿の皮膚生検
真皮上層の血管周囲にリンパ球と組織球が浸潤しており,表皮真皮境界部には角化細胞の空胞変性を認めた。
表2 化学療法のレジメンと用量
皮膚筋炎に悪性腫瘍が合併しやすいことは,1950年代の報告以来,よく知られている[2]。近年では皮膚筋炎に特異的な自己抗体の解明が進んでおり,約70%の患者で陽性になると言われている[3]4]。自己抗体の種類によって,症状や併存疾患のスペクトラムが異なる。悪性腫瘍が合併した皮膚筋炎では皮膚症状が重症化しやすく,むち打ち様紅斑(掻爬によるケブネル徴候)やびらんを来すという特徴もあり[5],病理学的には苔癬反応のうちの空胞変性の関与が示唆されている[6]。転写因子であるTIF1-γの変異や過剰発現は,感染・環境・遺伝などの要因とともに,皮膚筋炎の発症に関わるとされる[7]。皮膚筋炎は腫瘍随伴症候群(paraneoplastic syndrome:PNS)としても知られるが,肺癌の先行は稀であるとされている。他の癌腫と比較して肺癌は予後が不良であり,皮膚筋炎の発症まで生存に至らないことが理由として挙げられている[8]。本症例での特徴として,まず肺癌と皮膚筋炎が同時期に発症したこと,そして肺癌が悪化しても皮膚筋炎の再燃はなかったことが挙げられる。同時期の発症で抗TIF1-γ抗体が陽性であり,肺癌治療により皮膚筋炎も改善したことは,PNSとして合致する所見である。一方でPNSは必ずしも原疾患の病勢と連動せず,悪性腫瘍と抗TIF1-γ抗体陽性皮膚筋炎の病勢が一致したのは59%(34例中20例)だったという報告もあることから[9],本症例で肺癌が増悪しても皮膚筋炎の再燃がなかったことについては,PNSの経過として矛盾しないと考えた。
本症例のもう1つの特徴として,皮膚所見と掻痒が乖離しコントロールに難渋したことが挙げられる。当初,皮膚筋炎による掻痒として治療を開始し,抗がん化学療法に加え副腎皮質ステロイド薬の全身投与を行ったところ,皮膚所見と掻痒は共に改善傾向を呈した。しかし肺癌が増悪した際には,皮膚炎は再燃しなかった一方で,掻痒のみが増悪,遷延した。
一般的に,掻痒の原因は多岐に渡り,皮膚そのものの異常によるもの,胆汁うっ滞や透析患者で見られる全身疾患に伴うもの,ヘルペスウイルス感染などで起こる神経障害によるもの,痛覚過敏や異痛症(allodynia)のような神経障害性疼痛ないし心因性のものなどに分類される[10]。近年では難治性の掻痒の原因として,バリア機構の破綻で神経線維が表皮に侵入して起こるような,新たな機序も明らかになりつつある[11][12]。本症例では胆道系酵素の優位な上昇はなく,胆汁うっ滞患者で見られる四肢末梢型の掻痒[13]でもなかった。腎機能の悪化や尿毒素の蓄積もなかった。担癌状態による免疫力低下は否定できないものの,皮膚所見・神経学的所見・血液検査などからは,積極的にウイルス感染などを疑うものではなかった。神経障害性疼痛の要素も考えてデュロキセチン(SNRI)を使用したが,効果は限定的であった。
また,掻痒そのものがPNSであるとするparaneoplastic itch(PI)という概念がある[14]。血液悪性腫瘍における発生割合が高く[15],固形悪性腫瘍ではカルチノイドが知られるが,稀ながら肺癌での報告例もある(表3)。また悪性腫瘍の治療の際に現れる掻痒もあり,分子標的治療薬や免疫チェックポイント阻害薬における報告が散見される。それらは皮膚症状を欠くなどの特徴を持つが,機序の解明には至っておらず,特異的な治療も確立されていない[16]。本症例では皮膚筋炎よる掻痒と判断していたが,その後の経過で皮膚所見と掻痒症状が乖離しており,PIとしての掻痒であると考えた。悪性腫瘍に合併し皮膚所見と掻痒に乖離がある場合には,PNSの一症状である可能性を検討する必要がある。
表3 肺癌におけるparaneoplastic itch(PI)の報告
本論文は第189回日本肺癌学会関東支部学術集会(2021年3月27日)で発表したものである。
利益相反:開示すべき利益相反はない。
A 72-year-old man presented to the emergency department with pruritic erythema and difficulty walking. Chest CT showed a tumorous lesion in the right lower lobe of the lung. We performed a transbronchial biopsy (TBB) and diagnosed small cell lung cancer of the lung. A skin biopsy was added and a diagnosis of dermatomyositis was made. Furthermore, the blood test for anti-TIF1-γ antibodies was positive. His dermatitis improved with tumor response to chemotherapy, but then the pruritus recurred after tumor regrowth and interfered with sleep. Dermatomyositis is well known as paraneoplastic syndrome (PNS), and it was difficult to deal with pruritus in this case. We had judged that the itching was due to dermatomyositis, but later on, the skin findings and itching symptoms diverged, and we thought that the itching was due to paraneoplastic itch. When there is a discrepancy between skin findings and itching in a patient with a malignant tumor, it is necessary to consider the possibility that this is a symptom of paraneoplastic syndrome.
- 多発性筋炎・皮膚筋炎診療ガイドライン(2020 年暫定版). 自己免疫疾患に関する調査研究班・厚生労働科学研究費補助金難治性疾患等政策研究事業.
- Barnes BE. Dermatomyositis and malignancy; a review of the literature. Ann Int Med. 1976; 84: 68-76. doi: 10.7326/0003-4819-84-1-68.
- Rohit A, et al. Dermatomyositis-Associated Autoantibodies: TIF1-γ, NXP2, and MDA5. Managing Myositis. In: Rohit A, et al., editors. Managing Myositis, 1st ed. Springer, 2020; 193-8.
- 沖山奈緒子. 筋炎特異的自己抗体による皮膚筋炎のサブグループ. 生体の科学. 2020; 71: 579-84. doi: 10.11477/mf.2425201287.
- 藤本学. 皮膚筋炎. 皮膚科の臨床. 2017; 59: 1261-8.
- Okiyama N, et al. Distinct histopathologic patterns of finger eruptions in dermatomyositis based on myositis-specific autoantibody profiles. JAMA Dermatol. 2019; 155: 1080-2. doi: 10.1001/jamadermatol.2019.1668.
- Kotobuki Y, et al. Transcriptional intermediary factor 1 (TIF1) and anti-TIF1γ antibody-positive dermatomyositis. Immunol Med. 2020: 1-7. doi: 10.1080/25785826.2020.1791402.
- 米嶋康臣, ほか. 肺癌の再発を契機に筋炎症状が顕在化した皮膚筋炎合併小細胞肺癌の1例. 日呼吸器会誌. 2010; 8: 118-122.
- Hanbo Y, et al. Identification of multiple cancer-associated myositis-specific autoantibodies in idiopathic inflammatory myopathies: a large longitudinal cohort study. Arthritis Res Ther. 2017; 19: 259. doi: 10.1186/s13075-017-1469-8.
- Gil Y, et al. Itch: From mechanism to (novel) therapeutic approaches. J Allergy Clin Immunol. 2018; 142: 1375-1390. doi: 10.1016/j.jaci.2018.09.005.
- Mitsutoshi T. Itch and nerve fibers with special reference to atopic dermatitis: Therapeutic implications. Dermatol. 2014; 41: 205-212. doi: 10.1111/1346-8138.12317.
- Sonoko T. Homeostatic pruning and activity of epidermal nerves are dysregulated in barrier-impaired skin during chronic itch development. Sci Rep. 2019; 9: 8625. doi: 10.1038/s41598-019-44866-0.
- Youkyung SR, et al. Itch: Epidemiology, clinical presentation, and diagnostic workup. J Am Acad Dermatol. 2022; 86:1-14. doi: 10.1016/j.jaad.2021.07.076.
- Elke W, et al. Paraneoplastic itch: an expert position statement from the Special Interest Group (SIG) of the International Forum on the Study of Itch (IFSI). Acta Derm Venereol. 2015; 95: 261-265. doi: 10.2340/00015555-1959.
- Valerie AL, et al. Association between itch and cancer in 16,925 patients with pruritus: Experience at a tertiary care center. J Am Acad Dermatol. 2019; 80(4): 931-937. doi: 10.1016/j.jaad.2018.08.044.
- Brandon R, et al. Paraneoplastic Itch Management. Curr Probl Dermatol. 2016; 50: 149-54. doi: 10.1159/000446060.