【投稿/レビュー】重症喘息における環境因子制御の重要性

永田真*1,2,森脇知子*3
*1埼玉医科大学呼吸器内科
*2埼玉医科大学病院アレルギーセンター
*3アストラゼネカ株式会社メディカル本部呼吸器・免疫疾患領域部〔〒530-0011 大阪府大阪市北区大深町3-1 グランフロント大阪タワーB 19F〕
The importance of controlling environmental factors in severe asthma
Makoto Nagata*1,2, Tomoko Moriwaki*3
*1Department of Respiratory Medicine, Saitama Medical University
*2Allergy Center, Saitama Medical University Hospital
*3Medical, Respiratory & Immunology, AstraZeneca K.K.
Keywords:重症喘息,環境因子,免疫応答,免疫寛容,アレルゲン免疫療法,生物学的製剤/severe asthma, environmental factor, immune response, immune tolerance, allergen immunotherapy, biologics
呼吸臨床 2024年8巻6号 論文No.e00192
Jpn Open J Respir Med 2024 Vol. 8 No. 6 Article No.e00192
DOI: 10.24557/kokyurinsho.8.e00192
受付日:2024年4月8日
掲載日:2024年6月28日
©️Makoto Nagata, et al. 本論文はクリエイティブ・コモンズ・ライセンスに準拠し,CC-BY-SA(原作者のクレジット[氏名,作品タイトルなど]を表示し,改変した場合には元の作品と同じCCライセンス[このライセンス]で公開することを主な条件に,営利目的での二次利用も許可されるCCライセンス)のライセンシングとなります。詳しくはクリエイティブ・コモンズ・ジャパンのサイト(https://creativecommons.jp/)をご覧ください。
近年,重症喘息の病態形成に複数の環境因子が関与することが明らかとなってきた。本稿では,重症喘息の病態形成において中心的な役割を担う免疫細胞やサイトカインについて,環境因子との関わりから改めて整理した。その上で,重症喘息の病態制御を目指す治療を考える一環として,環境因子回避の重要性と実際の対応や,アレルゲン免疫療法や生物学的製剤などの意義について諭説する。
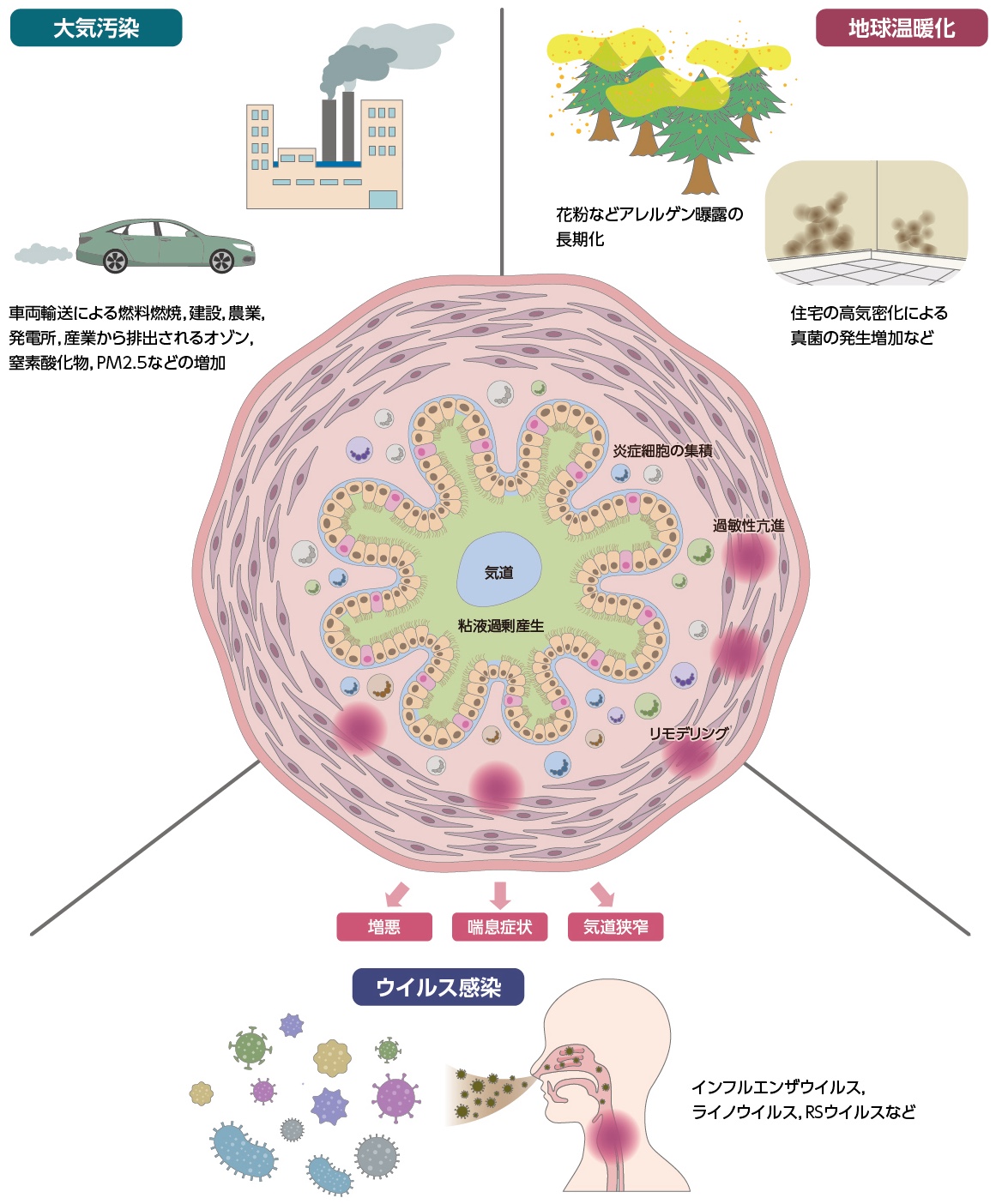
喘息の増悪につながる環境因子として感作アレルゲンや,ウイルスなどを含む各種の呼吸器感染症,大気汚染,気象,喫煙などが列挙される[1]。アレルゲンに関しては,例えば家塵ダニ(house dust mite:HDM)あるいはスギ花粉などはその感作状況にかかわらず,好酸球のエフェクター機能を直接的に活性化する作用があり,これらへの曝露は非アトピー型の喘息の病態にも寄与しえる[2][3]。近年認められる喘息を含むアレルギー疾患の増加は,遺伝的因子のみでは説明できず,大気汚染物質の増加や,地球温暖化による気候変動の影響を少なからず受けている可能性が想定される[4][5]。これらの環境因子への曝露は,増悪の引き金となるだけでなく,組織における炎症病態を修飾しえ,炎症細胞の集積,気道過敏性(airway hyperresponsiveness:AHR),粘液産生そして気道リモデリングを亢進させるなど,喘息の重症化につながるものと推定される(図1)[1][4][6]。
図1 喘息を増悪させる環境因子の曝露
近年のアレルギー疾患の増加は,遺伝的因子だけでなく,大気汚染物質の増加や地球温暖化による気候変動などによる環境因子の関与も想定される。またウイルスなどによる気道感染は喘息増悪との関連が示されている。環境因子の曝露は,気道の炎症細胞の集積,過敏性の亢進,粘液過剰産生,リモデリングの亢進など,喘息の重症化につながると推定される。
(文献1,4,6を参考に作成)
国内の喘息患者を対象としたアンケート調査では,患者が考える喘息症状誘発因子の多くが感冒,ほこり,天候などの環境因子であった[7]。また,重症喘息患者を対象とした米国の観察研究では,症状発現および増悪の引き金となる環境因子は多岐にわたること,個々の患者が複数の各々異なる増悪因子を保有しており,環境因子に対する反応性が過敏となっている状況が示唆されている[8]。
難治性喘息患者に対し,環境因子を制御する重要性は,Global Initiative for Asthma(GINA)による喘息診療の国際指針において明記されている[9]。同様の方針は,日本アレルギー学会による喘息予防・管理ガイドライン2021[1]にも反映されている。本稿では,環境因子により引き起こされる重症喘息病態を整理するとともに,個々の患者の環境因子をどのように制御するかについても概説することとしたい。
喘息増悪の危険因子は,個体要因と環境要因の2つに大別しえる[1]。個体要因としては,過去の病歴,現在のコントロール状態,治療薬の不適切な使用やアドヒアランス不良,併存症などがあげられる。一方,環境要因としては,アレルゲンへの曝露,呼吸器感染症,大気汚染,気象,喫煙,薬物,アルコールなどが列挙される。また前述のHDMやスギ花粉のような環境アレルゲンもこれに含まれよう[2][3]。個々の患者により異なる増悪の危険因子は,問診や検査によって患者ごとに把握し対策する必要があると理解される(表1)[1]。
表1 喘息増悪の危険因子への対策
環境整備の有用性については,複数の臨床試験で検討されてきた。例えば,ダニに感作された喘息患者の住居に対して殺ダニ剤塗布を適用した二重盲検プラセボ対照試験では,患者宅を殺ダニ剤塗布群とプラセボ群に割り付け,試験開始時とその6カ月後の2回にわたり薬剤を塗布したところ,薬剤塗布群でのみ12カ月後の症状スコアが改善した[10]。また,システマティックレビューも行われており,ここでは特に包括的な環境整備の重要性が示唆されている。8項目の介入(殺ダニ剤,空気清浄機,カーペット除去,高性能エアフィルター付き掃除機,不透過性マットレスカバー,真菌除去,害虫駆除,ペット回避)を取り上げた67試験(59のランダム化比較試験,8の非ランダム化試験)のうち,単独項目へ介入した37試験のほとんどで効果が認められなかった一方,多項目へ介入した試験の一部では増悪が軽減したことが示された[11]。このように環境中の危険因子への無防備な曝露が喘息病態に及ぼす影響は明らかであり,喘息の症状をコントロールする上で環境整備は重要であると認識される。ただし,実臨床では個々の寄与因子を的確に回避することは必ずしも容易とは限らず,各喘息患者の生活環境に応じた環境整備を行っていく必要がある。
環境因子により引き起こされる免疫応答と重症喘息の病態
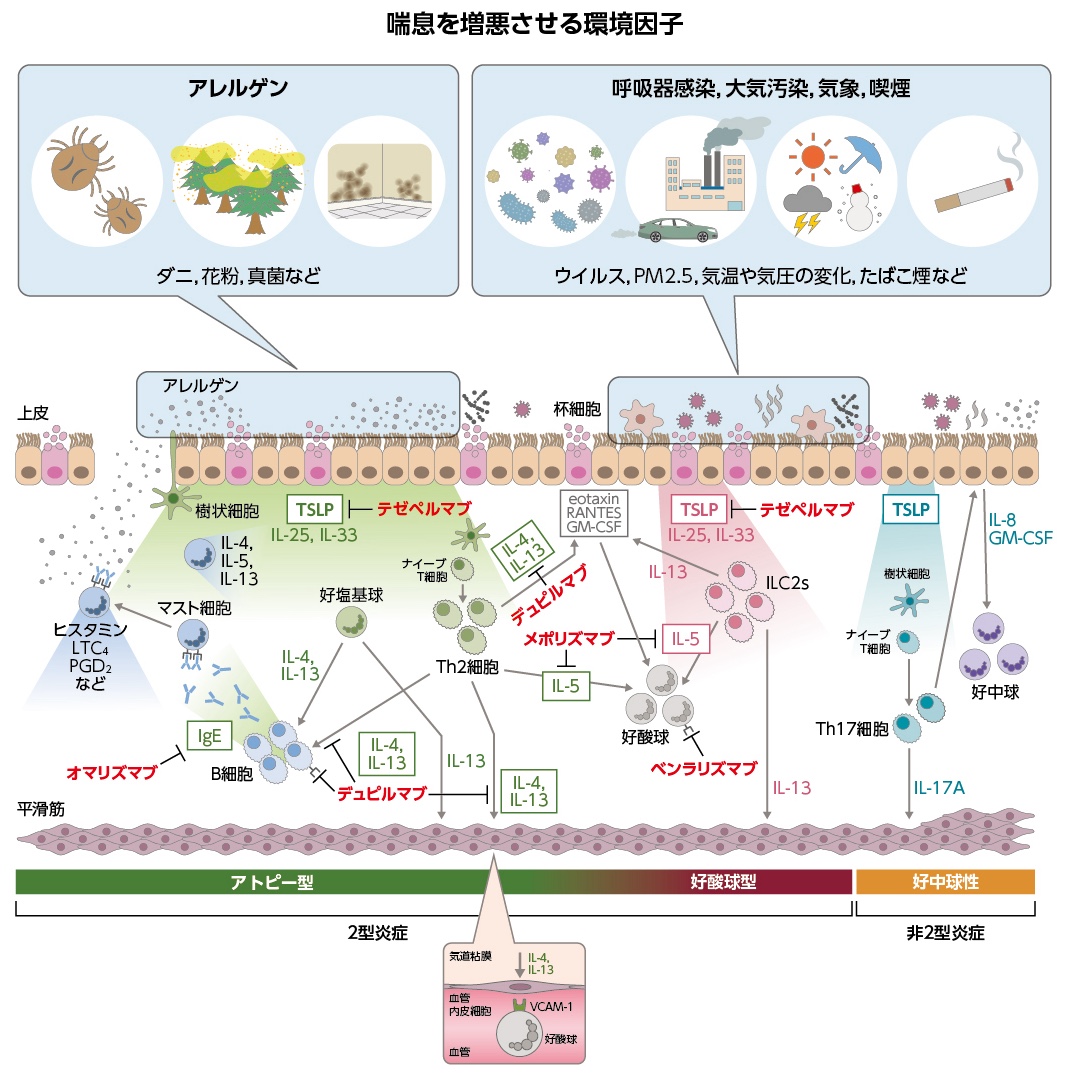
近年,重症喘息の基礎病態の中で,アレルゲン,ウイルス,大気汚染物質などの環境因子の刺激によって気道上皮から産生されるサイトカインの意義が注目されている。胸腺間質性リンパ球新生因子(TSLP),インターロイキン(IL)-25,IL-33などの気道上皮由来のサイトカインは,種々の免疫細胞に作用し複数の炎症経路に影響を及ぼす(図2)[12]。
図2 環境因子と重症喘息病態の関わり
様々な環境因子の気道上皮細胞への刺激により,気道上皮由来のサイトカインであるTSLP,IL-25,IL-33が産生あるいは放出される。これらのサイトカインは,樹状細胞あるいはILC2の活性化や生存延長などに影響する。活性化された樹状細胞は,Th2細胞などの分化を誘導する。Th2細胞,ILC2はIL-4,IL-5,IL-13を産生し2型炎症を誘導する。気道上皮由来のサイトカインは好塩基球やマスト細胞にも直接作用しえる。また,非2型炎症が主体の病態では,気道上皮由来のサイトカインの刺激を受けてTh17細胞などの活性化が寄与する可能性がある。これらの結果,産生,誘導された様々なメディエーターが重症喘息の病態を形成する。
GM-CSF:顆粒球マクロファージコロニー刺激因子,Ig:免疫グロブリン,IL:インターロイキン,ILC:自然リンパ球,LT:ロイコトリエン,PG:プロスタグランジン,Th:ヘルパーT,TSLP:胸腺間質性リンパ球新生因子,VCAM-1:血管細胞接着分子-1
(文献12より改変)
2型炎症が病態の中心となるアトピー型あるいは好酸球型の喘息では,気道上皮由来のサイトカインの刺激を受けて,ヘルパーT(Th)2細胞やグループ2自然リンパ球(ILC2)などの免疫細胞が活性化する。一方,非2型炎症が主体の喘息では,気道上皮由来のサイトカインの刺激を受けたTh17細胞などの活性化が寄与する可能性がある。また,気道上皮由来のサイトカインはリンパ球のほかに,好塩基球やマスト細胞にも作用し,それらの細胞における炎症関連分子の産生あるいは放出に貢献しえる。
環境因子のうち感作アレルゲンが喘息の病態に関与する場合,その機序として,アレルゲンを認識した樹状細胞による,ナイーブT細胞のTh2細胞への分化誘導が重要である。活性化したTh2細胞は,IL-4,IL-5,IL-13などの2型サイトカインを産生する[12]。このうちIL-5は,好酸球の分化や生存延長,またエフェクター機能亢進などを介して,好酸球性炎症を増強する[1][12]。好酸球のエフェクター機能はIL-5を含む好酸球増殖因子によって制御されるのみならず,自身が発現するパターン認識受容体を介しても,さまざまな刺激により直接的に活性化されうる[2][3]。IL-4やIL-13は,血管内皮細胞を刺激して好酸球に対する強力な接着誘導活性を示す血管細胞接着分子(VCAM)-1の発現を誘導し,一方で気道上皮細胞などからのCCケモカインの産生を誘導することで好酸球の組織内への遊走を促進する[13]。IL-13は,気道平滑筋の収縮能に寄与するほか気道上皮における粘液産生を増加させる[12]。さらに,IL-4やIL-13は,気道上皮において誘導型の一酸化窒素合成酵素(NOS)の発現を亢進するため,喘息患者においては通常,呼気中一酸化窒素濃度(FeNO)の上昇が認められる[14]。IL-4やIL-13はまた,B細胞からのアレルゲン特異的な免疫グロブリンE(IgE)産生を促進する[12]。B細胞から分泌されたIgEは,マスト細胞あるいは好塩基球上の高親和性IgE受容体(FcεRI)に結合する[12]。IgEによる感作後にマスト細胞などが感作アレルゲンに曝露されると,特異的IgEを介してFcεRIが架橋されこれらの細胞が活性化する[12]。マスト細胞は活性化すると,システィニル・ロイコトリエン(CysLT)やプロスタグランジンD2(PGD2)などの複数の炎症性メディエーターを放出するが,これらCysLTやPGD2は気道平滑筋の収縮を誘導する[1]。一連の反応は,アレルゲン吸入誘発試験における喘息患者の気道反応で確認することができる。アレルゲン吸入後,数分から30分前後に認められる即時型喘息反応(IAR)は主としてマスト細胞などからの炎症メディエーター放出およびそれに伴う気道平滑筋の収縮を反映する。続いて,数時間から12時間後に認められる遅発型喘息反応(LAR)は気道で好酸球性気道炎症が生じていることなどが反映されている。
カーペットの使用や喫煙者の存在,また動物飼育などがあると,環境中の病原微生物に由来するリポ多糖(LPS)濃度が上昇する場合がある[15]。この増加したLPSは,好中球を活性化し,好酸球の基底膜通過遊走反応を誘導しえるため,気道内へ好酸球が集積する機序が推定される[13]。またウイルス感染時などでは気道上皮からIL-8が産生されるが,産生されたIL-8による好中球の遊走自体が,好酸球の基底膜通過遊走反応を誘導する[16]。
重症喘息の病態解明が進み,環境因子に対する免疫応答を介して複数の気道炎症経路が活性化することが明らかとなったが,その一方で,これらの病態と拮抗する免疫寛容のメカニズムについての知見も徐々に集積されつつある。
免疫寛容のメカニズムとして,高濃度のアレルゲンを取り込んだ樹状細胞が抑制性のサイトカインであるIL-10やトランスフォーミング増殖因子β(TGF-β)を産生し,Th1細胞や制御性T(Treg)細胞,制御性B(Breg)細胞を誘導することが知られている[17]。誘導されたTreg細胞やBreg細胞は,IL-10,TGF-β,IL-35などの抑制性サイトカインを産生し,Th2細胞やB細胞の過剰な活性化とアレルギー炎症の発動を抑制する[17]。さらに特異的IgG4が誘導され,特異的IgEに拮抗してマスト細胞や好塩基球からのメディエーター遊離を抑制することで,アレルギー症状を改善すると考えられている。
環境因子による病態を制御するためには,アレルゲン免疫療法や生物学的製剤といった異なる作用機序や作用点を有する複数の治療法から,個々の患者の病態に適した治療を選択する必要がある。
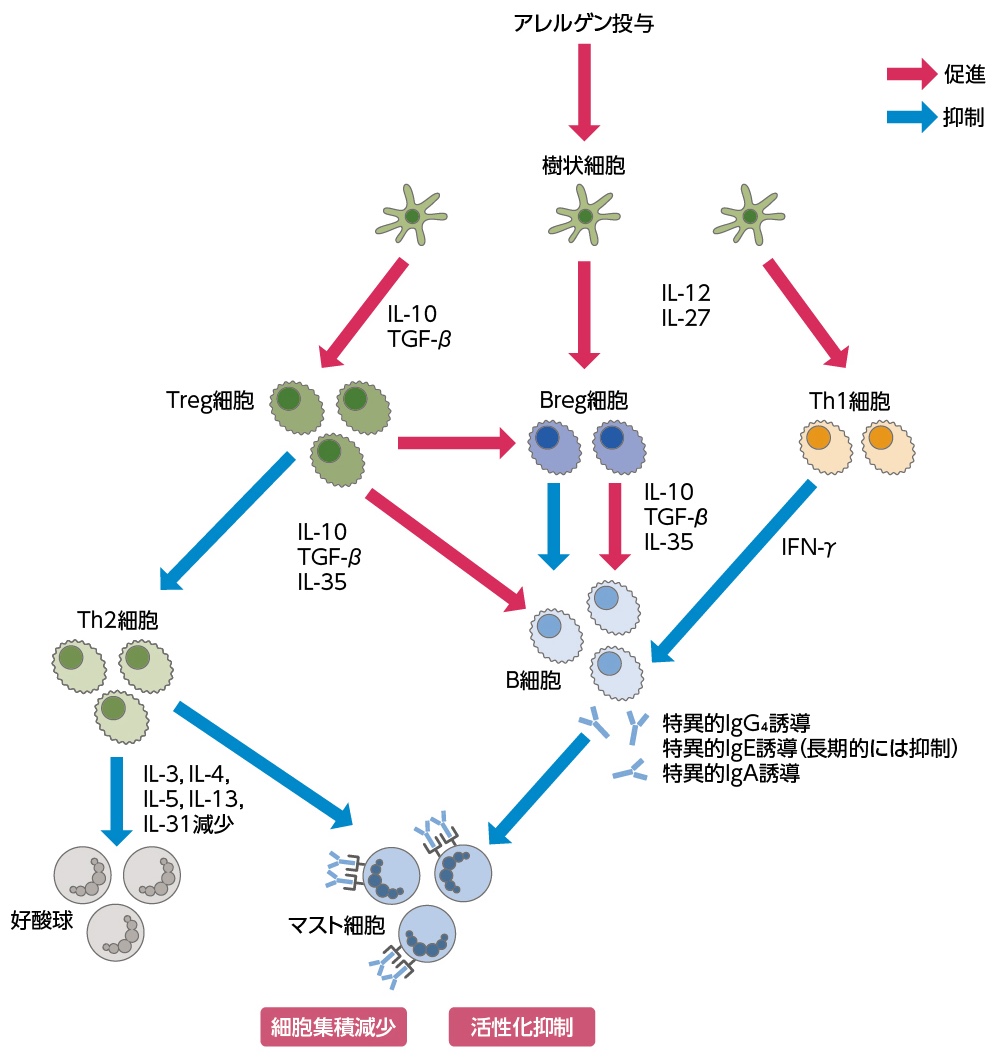
アレルゲン免疫療法は,病因となるアレルゲンを徐々に増量して投与し,症状の緩和を目指す治療法である(図3)[17]。アレルゲンに対する免疫寛容の誘導を本質としており,即効性を期待して行う薬物療法とは異なり,アレルギー疾患の自然経過に対する修飾効果と全身的かつ包括的な臨床効果を期待した年単位の長期療法で,標準治療施行中でも追加効果のあることが示されている[17]。アレルゲン免疫療法としては,注射による皮下免疫療法(SCIT)と舌下免疫療法(SLIT)※1がある。
図3 アレルゲン免疫療法の作用
アレルゲン免疫療法により,アレルゲン特異的なTh2型免疫応答の緩和,Th1型免疫反応の誘導,Treg細胞の誘導,アレルゲン特異的IgG4抗体の産生などの免疫学的変化の発現が期待できる。また,Breg細胞の誘導やアレルゲン特異的IgA抗体が産生されるとの報告もある。これらの作用が複合的に関与して臨床効果に貢献すると考えられる。
Breg細胞:制御性B細胞,IFN-γ:インターフェロン-γ,Ig:免疫グロブリン,IL:インターロイキン,TGF:トランスフォーミング増殖因子,Th:ヘルパーT,Treg細胞:制御性T細胞
(文献17より転載)
日本では,2015年にダニ抗原に感作された気管支喘息患者を対象としたSCIT用の標準化HDMアレルゲンが承認され,HDM感受性喘息患者を対象としたSCITが承認された[17][18]。SCITを施行したHDM感受性喘息患者は,未治療の対照群に比べて経過は良好であり,治療ステップのステップダウンが得られることが確認されている。また,SCIT施行群において,HDMアレルゲン刺激による末梢血単核球のIL-5やIL-13産生量は,SCIT実施前と比較してSCIT実施後に有意に減少したことから,SCITはHDMにより誘導されるTh2炎症反応を抑制し臨床的改善をもたらすと考えられる[18]。メタ解析からも,アレルゲン免疫療法はアトピー型喘息の臨床症状とAHRを改善し,薬物減量効果を有することが示されている[17]。喘息におけるアレルゲン免疫療法は低肺機能では適応外となるため,特に重症喘息ではその点に注意を要する。
近年,重症喘息治療薬として相次いで登場した生物学的製剤もまた,環境因子による病態の制御を目指す上で有用と期待される。日本では,抗IgE抗体製剤オマリズマブ,抗IL-5抗体製剤メポリズマブ,抗IL-5受容体α鎖(IL-5Rα)抗体製剤ベンラリズマブ,抗IL-4受容体α鎖(IL-4Rα)抗体製剤デュピルマブ,抗TSLP抗体製剤テゼペルマブの5製剤が承認され,患者ごとに異なる病型と主要な炎症反応のタイプに応じ臨床で用いられている(図2)[12][19][20]。
オマリズマブは,遊離IgEのCε3領域に結合して,IgEのFcεRIへの結合を阻害する。その結果,IgEを介したマスト細胞や好塩基球からの炎症性メディエーターの放出が抑制される[19][20]。基本的な適応は通年性の環境アレルゲンに感作されたアトピー型の重症喘息である。重症花粉症および蕁麻疹にも適応があり,これらの合併例で選択される場合が多い[19]。
メポリズマブは,IL-5に特異的に結合し,好酸球の細胞表面に発現するIL-5RαへのIL-5の結合を阻害する[19]。ベンラリズマブは,好酸球表面のIL-5Rαに特異的かつ高い親和性で結合しIL-5のIL-5Rαへの結合を阻害することで好酸球に対する作用を抑制する[20][21]。また,ベンラリズマブは,Fcドメインのフコース欠損により抗体依存性細胞傷害活性が増強されているため,IL-5Rαを発現する好酸球や好塩基球のアポトーシスを誘導して,これら血球を効率的に除去することができる[21]。これら抗IL-5系の製剤は基本的に好酸球増多例に適用される。
デュピルマブは,IL-4とIL-13が共有する受容体であるIL-4Rαに結合して,IL-4とIL-13の両方のシグナル伝達系を抑制する[20]ことで,重症喘息患者のFeNOや血清総IgEを低下させることが確認されている[22]。一般にFeNOが高値の場合に選択されることが多い。またアトピー性皮膚炎および鼻茸を伴う慢性副鼻腔炎にも適応があり,これらの合併例で選択される場合が多い[19]。
テゼペルマブは,TSLPに結合して,TSLP受容体との結合を阻害することで,Th2細胞,B細胞,ILC2などの免疫細胞の分化や活性化を阻害するため,重症喘息病態の複数の炎症経路を抑制しえる[12][20]。
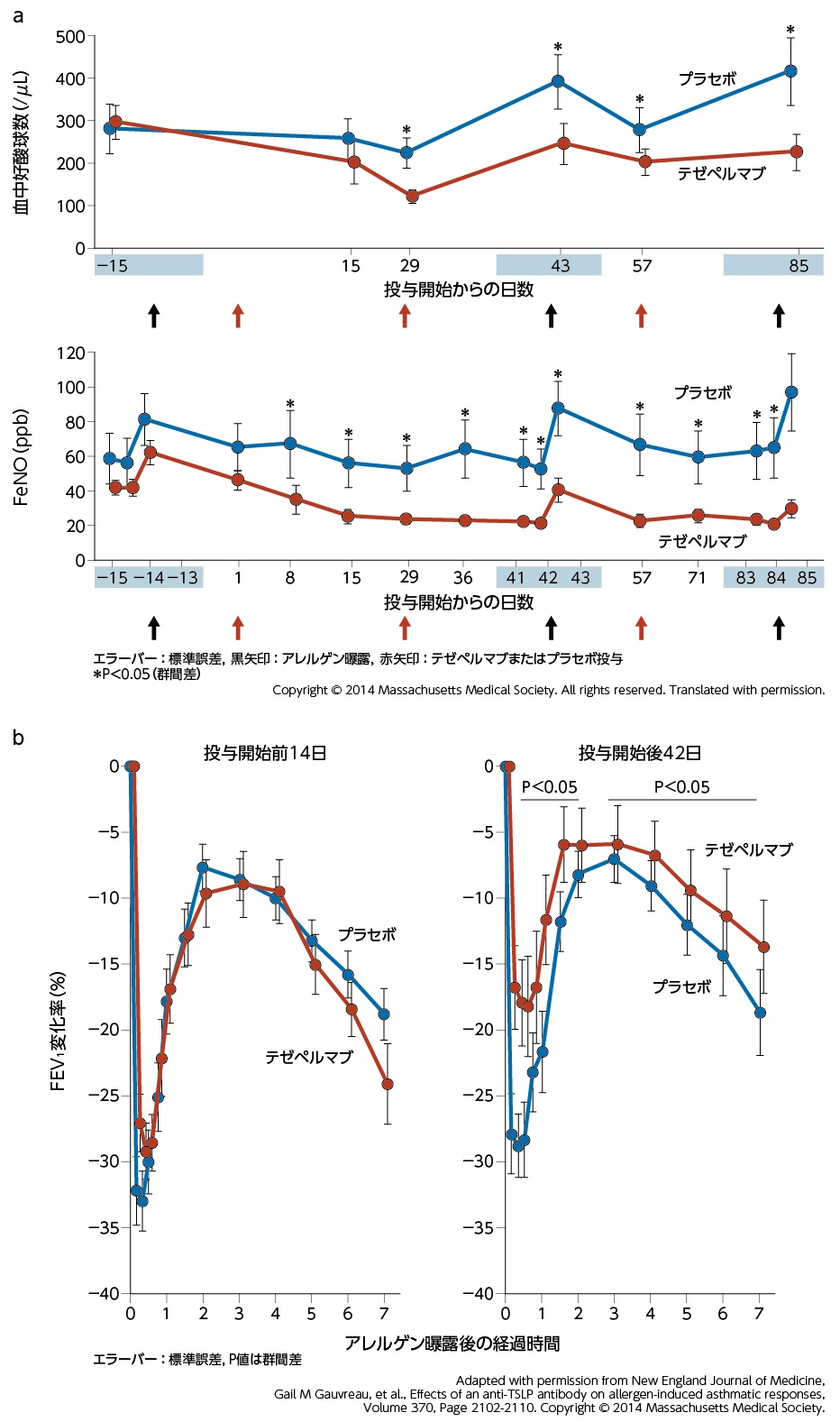
これらの生物学的製剤の選択にあたっては,血中好酸球数,FeNO,血清総IgE,アレルゲン特異的IgE抗体などのバイオマーカーを測定し,かつ併存疾患を考慮して喘息の病型ごとに最適な薬剤選択を行う必要がある[19]が,この既存の選択指針に加えて環境因子の存在を考慮することで,さらなるコントロールの向上が期待できる症例もあると推測される。例えば,アトピー型喘息では従来から抗IgE抗体製剤が頻用されてきたが,抗TSLP抗体テゼペルマブについても,軽症例の検討ではあるがアトピー型喘息患者に対して,HDMなどのアレルゲン曝露による血中好酸球数の増加,FeNOの上昇とIARとLARによる1秒量(FEV1)の減少に対して部分的な抑制効果を示すことが明らかにされている(図4)※2, [23]。
図4 アレルゲン吸入による血中好酸球数およびFeNO上昇,呼吸機能低下(IAR, LAR)とテゼペルマブによる抑制
軽症アトピー型喘息患者にテゼペルマブ700mgまたはプラセボを28日間隔で3回静脈内投与し,好酸球数およびFeNOを評価,投与42日目および84日目にアレルゲン吸入を行い,FEV1最大減少率を評価した。
テゼペルマブ群ではプラセボ群と比較し血中好酸球数は投与29日目に,FeNOは投与8日目に有意に減少した(a)。
アレルゲン吸入後のIARおよびLARについて,投与42日目におけるFEV1最大減少率はプラセボ群と比較しテゼペルマブ群で有意に抑制された(IAR; P=0.05,LAR; P=0.09)(b)。
IAR:即時型喘息反応,FeNO:呼気中一酸化窒素濃度,FEV1:1秒量,LAR:遅発型喘息反応
(文献23より転載)
また,喘息の増悪頻度は季節的な誘因により年間を通じて変動するが,オマリズマブ,メポリズマブ,ベンラリズマブ,デュピルマブ,テゼペルマブにおいて,季節性の喘息増悪を軽減させたことが報告されている[24]〜[28]。オマリズマブは,投与後にインターフェロン-α産生能が増加したことが,ライノウイルス感染を抑え,喘息増悪の減少に関与した可能性が指摘されている[24]。一方,テゼペルマブ投与前後の喘息患者から採取した気道上皮細胞を用いた実験においては,ウイルスの類似物質Poly (I:C) 刺激によるIL-33やIL-4,IL-13,IL-17Aの産生をテゼペルマブが減弱させたことから,テゼペルマブはウイルス感染による気道上皮におけるサイトカインの過剰発現を軽減する可能性があると考えられる[29]。
前述の通り,個々の重症喘息患者が保有している環境因子は多岐にわたっているため[8],複数の炎症メカニズムが同時に惹起され増悪につながっているケースが想定される。実際,International Severe Asthma Registryに登録された重症喘息患者の59%において,血中好酸球数高値(300/μL以上),FeNO高値(25ppb以上),血清総IgE高値(75kU/L以上)の3つのうち,2つまたは3つ以上のバイオマーカーが高値であったと報告されている[30]。最近ベンラリズマブが,好酸球型喘息でFeNO高値例を多く含む重症喘息集団においても優れた臨床効果を発揮することが報告された[31]。テゼペルマブも重症喘息患者を対象とした試験において幅広い2型炎症バイオマーカー(血中好酸球数,FeNO,血清総IgE,IL-5,IL-13,ペリオスチン)の減少効果が報告され,特に好酸球高値,FeNO高値,通年性感作アレルゲン陽性がそれぞれ重複する例では高い増悪抑制効果が認められている[32]。
重症喘息診療における環境因子制御の重要性とその対処法について概説した。バイオマーカーに基づいたフェノタイプごとの薬剤選択に加えて,個々の患者の環境因子を考慮することで,より最適な重症喘息治療につながることが期待される。
※1 本邦では,SLITは重症の喘息患者〔SLIT製剤の投与により喘息増悪(発作)を誘発するおそれがある〕では禁忌となっている。
※2 テゼペルマブの効能または効果は,「気管支喘息(既存治療によっても喘息症状をコントロールできない重症または難治の患者に限る)」である。
謝辞:本論文の作成支援を受けたEMC株式会社の喜多村春菜氏に感謝する。
利益相反:本論文の作成・投稿に関する費用はアストラゼネカ株式会社が負担した。本論文において,永田真は利益相反に関する開示事項はない。森脇知子はアストラゼネカ株式会社の社員である。
There is increasing evidence that certain environmental factors are involved in the pathogenesis of severe asthma. In this review, we discuss the involvement of the immune cells and cytokines contributing to the pathogenesis of severe asthma in relation to environmental factors. We also discuss the importance and practical avoidance of environmental factors and point that could facilitate appropriate indication of allergen immunotherapy and biologics which would provide favorable control of asthma.
- 日本アレルギー学会喘息ガイドライン専門部会 監.喘息予防・管理ガイドライン2021.東京,協和企画,2021.
- Ueda Y, et al. Dermatophagoides farinae upregulates the effector functions of eosinophils through αMβ2-integrin and protease-activated receptor-2. Int Arch Allergy Immunol. 2019; 178: 295-306. doi: 10.1159/000495008.
- Miyauchi S, et al. Japanese cedar pollen upregulates the effector functions of eosinophils. Asia Pac Allergy. 2021; 11: e26. doi: 10.5415/apallergy.2021.11.e26.
- Pham DL, et al. Environmental allergen reduction in asthma management: an overview. Front Allergy. 2023; 4: 1229238. doi: 10.3389/falgy.2023.1229238.
- WHO. WHO fact sheets. Climate Change. https://www.who.int/news-room/fact-sheets/detail/climate-change-and-health (accessed: February 15, 2024)
- Israel E, et al. Severe and difficult-to-treat asthma in adults. N Engl J Med. 2017; 377: 965-76. doi: 10.1056/NEJMra1608969.
- 永田 真,ほか.埼玉県下の気管支喘息患者2825例における治療とコントロール状態に関する自己評価の調査結果.アレルギー.2000; 49: 569-76. doi: 10.15036/arerugi.49.569.
- Chipps BE, et al. Number of patient-reported asthma triggers predicts uncontrolled disease among specialist-treated patients with severe asthma. Ann Allergy Asthma Immunol. 2023; 130: 784-90. doi: 10.1016/j.anai.2023.03.001.
- Global Initiative for Asthma, Global Strategy for Asthma Management and Prevention (2023 update). 2023. https://ginasthma.org/wp-content/uploads/2023/07/GINA-2023-Full-report-23_07_06-WMS.pdf (accessed: February 15, 2024)
- Dietemann A, et al. A double-blind, placebo controlled trial of solidified benzyl benzoate applied in dwellings of asthmatic patients sensitive to mites: clinical efficacy and effect on mite allergens. J Allergy Clin Immunol. 1993; 91: 738-46. doi: 10.1016/0091-6749(93)90193-j.
- Leas BF, et al. Effectiveness of indoor allergen reduction in asthma management: a systematic review. J Allergy Clin Immunol. 2018; 141: 1854-69. doi: 10.1016/j.jaci.2018.02.001.
- Gauvreau GM, et al. Thymic stromal lymphopoietin: its role and potential as a therapeutic target in asthma. Expert Opin Ther Targets. 2020; 24: 777-92. doi: 10.1080/14728222.2020.1783242.
- Nakagome K, et al. Involvement and possible role of eosinophils in asthma exacerbation. Front Immunol. 2018; 9: 2220. doi: 10.3389/fimmu.2018.02220.
- Alving K, et al. Basic aspects of exhaled nitric oxide. Horvath I and de Jongste JC, Exhaled Biomarkers, UK, ERS, 2010, Eur Respir Monogr. 49: 1-31. doi: 10.1183/1025448X.00028509.
- Thorne PS, et al. Endotoxin exposure: Predictors and prevalence of associated asthma outcomes in the United States. Am J Respir Crit Care Med. 2015; 192: 1287-97. doi: 10.1164/rccm.201502-0251OC.
- Kikuchi I, et al. Eosinophil trans-basement membrane migration induced by IL-8 and neutrophils. Am J Respir Cell Mol Biol. 2006; 34: 760-5. doi: 10.1165/rcmb.2005-0303OC.
- 「アレルゲン免疫療法の手引き」作成委員会,編集.日本アレルギー学会,監修.アレルゲン免疫療法の手引き.東京,日本アレルギー学会,2022.
- Uchida T, et al. Clinical evaluation of rush immunotherapy using house dust mite allergen in Japanese asthmatics. Asia Pac Allergy. 2021; 11: e32. doi: 10.5415/apallergy.2021.11.e32.
- 「アレルギー総合診療のための分子標的治療の手引き」作成WG,編集.日本アレルギー学会,監修.アレルギー総合診療のための分子標的治療の手引き.東京,日本アレルギー学会,2022.
- Brusselle GG, et al. Biologic therapies for severe asthma. N Engl J Med. 2022; 386: 157-71. doi: 10.1056/NEJMra2032506.
- Ghazi A, et al. Benralizumab – a humanized mAb to IL-5Rα with enhanced antibody-dependent cell-mediated cytotoxicity – a novel approach for the treatment of asthma. Expert Opin Biol Ther. 2012; 12: 113-8. doi: 10.1517/14712598.2012.642359.
- Wenzel S, et al. Dupilumab in persistent asthma with elevated eosinophil levels. N Engl J Med. 2013; 368: 2455-66. doi: 10.1056/NEJMoa1304048.
- Gauvreau GM, et al. Effects of an anti-TSLP antibody on allergen-induced asthmatic responses. N Engl J Med. 2014; 370: 2102-10. doi: 10.1056/NEJMoa1402895.
- Teach SJ, et al. Preseasonal treatment with either omalizumab or an inhaled corticosteroid boost to prevent fall asthma exacerbations. J Allergy Clin Immunol. 2015; 136: 1476-85. doi: 10.1016/j.jaci.2015.09.008.
- DuBuske L, et al. Seasonal variability of exacerbations of severe, uncontrolled eosinophilic asthma and clinical benefits of benralizumab. Allergy Asthma Proc. 2018; 39: 345-9. doi: 10.2500/aap.2018.39.4162.
- Peters AT, et al. Impact of dupilumab across seasons in patients with type 2, uncontrolled, moderate-to-severe asthma. Ann Allergy Asthma Immunol. 2023; S1081-1206(23)01470-9. doi: 10.1016/j.anai.2023.11.021.
- Pavord ID, et al. Tezepelumab reduces exacerbations across all seasons in patients with severe, uncontrolled asthma (NAVIGATOR). Ann Allergy Asthma Immunol. 2023; 131: 587-97.e1-3. doi: 10.1016/j.anai.2023.08.015.
- Jackson DJ, et al. Mepolizumab for urban children with exacerbation-prone eosinophilic asthma in the USA (MUPPITS-2): a randomised, double-blind, placebo-controlled, parallel-group trial. Lancet. 2022; 400: 502-11. doi: 10.1016/S0140-6736(22)01198-9.
- Sverrild A, et al. Tezepelumab decreases airway epithelial IL-33 and T2-inflammation in response to viral stimulation in patients with asthma. Allergy. 2024; 79: 656-666. doi: 10.1111/all.15918.
- Denton E, et al. Cluster Analysis of inflammatory biomarker expression in the international severe asthma registry. J Allergy Clin Immunol Pract. 2021; 9: 2680-8.e1-7. doi: 10.1016/j.jaip.2021.02.059. Erratum in: J Allergy Clin Immunol Pract. 2021; 9: 4182.
- Padilla-Galo A, et al. Achieving clinical outcomes with benralizumab in severe eosinophilic asthma patients in a real-world setting: ORBE II study. Respir Res. 2023; 24: 235. doi: 10.1186/s12931-023-02539-7.
- Corren J, et al. Baseline type 2 biomarker levels and response to tezepelumab in severe asthma. Allergy. 2022; 77: 1786-96. doi: 10.1111/all.15197.