【投稿/原著】当院におけるtezepelumabの臨床的有効性およびremissionの検討

大成洋二郎,神原穂奈美,高橋 広,實綿 慶
マツダ株式会社マツダ病院呼吸器内科(〒735-8585 広島県安芸郡府中町青崎南2-15)
Examination of clinical efficacy and remission with tezepelumab at our hospital
Yojiro Onari, Honami Kambara, Hiroshi Takahashi, Kei Miwata
Department of Respiratory Medicine, Mazda Hospital, Mazda Motor Corporation, Hiroshima
Keywords:重症喘息,胸腺間質性リンパ球新生因子,テゼペルマブ,寛解/severe asthma, thymic stromal lymphopoietin(TSLP), tezepelumab, remission
呼吸臨床 2024年8巻9号 論文No.e00196
Jpn Open J Respir Med 2024 Vol. 8 No. 9 Article No.e00196
DOI: 10.24557/kokyurinsho.8.e00196
受付日:2024年7月17日
掲載日:2024年9月18日
©️Yojiro Onari, et al. 本論文はクリエイティブ・コモンズ・ライセンスに準拠し,CC-BY-SA(原作者のクレジット[氏名,作品タイトルなど]を表示し,改変した場合には元の作品と同じCCライセンス[このライセンス]で公開することを主な条件に,営利目的での二次利用も許可されるCCライセンス)のライセンシングとなります。詳しくはクリエイティブ・コモンズ・ジャパンのサイト(https://creativecommons.jp/)をご覧ください。
当院におけるtezepelumabの臨床的有効性およびremissionの検討を行った。Naïve群(生物学的製剤投与歴がない患者群)ではFEV1,ACT,ACQ-5の有意な改善を認め,血中好酸球数とFeNO値の低下も認めた。12カ月での3 way remission(症状安定,増悪なし,全身性ステロイドなし)は72.7%と高率であった。特に血中好酸球数とFeNO値が高値の症例ほど有効性が高い結果であった。Type2炎症が強い患者ほどtezepelumabの有効性が高い可能性が示唆された。
喘息は気道の慢性炎症を本態とし,気道過敏性の亢進によってもたらされる変動性を持った気道狭窄により喘鳴,呼吸困難,胸苦しさや咳などの臨床症状で特徴付けられる疾患である。持続する気道炎症は,気道粘膜の傷害とそれに引き続く気道リモデリングを誘導し,非可逆的な気流制限の進行をもたらす。
喘息における基本的治療は吸入ステロイド薬(ICS)であり,多くの喘息患者はICSを中心とした吸入療法でコントロールが可能であるが,高用量ICSを用いてもコントロール不良な重症喘息患者が5~10%程度存在する[1]。わが国においては,継続的な治療を受けている喘息患者の7.8%が重症喘息であると保険データベースを利用した調査で報告されている[2]。このような重症喘息患者に対しては,免疫グロブリン(Ig)E,インターロイキン(IL)-5,IL-5受容体α,IL-4受容体αを標的とした4つの生物学的製剤が使用され臨床的有用性が認められている[3]~[11]。そして2022年11月より喘息病態に広範に関与する胸腺間質性リンパ球新生因子(TSLP)を阻害するtezepelumabが使用可能となり新たな治療選択肢として期待されている。今回我々は当院における重症喘息に対してtezepelumabを投与した症例の臨床的有効性およびremissionについて検討を行った。
2022年11月から2024年3月の間に当院を受診し,難治性喘息診断と治療の手引き2019および2023の定義に合致し重症喘息と診断した患者。この重症喘息患者で生物学的製剤の投与に同意し,主治医がtezepelumabの投与が適切と判断した患者を対象とした。
対象患者はnaïve群(生物学的製剤投与歴がない患者群)とswitch群(他の生物学的製剤が投与されたが効果不十分のためtezepelumabへ切り替えた患者群)に分けて検討を行った。tezepelumab投与前,投与後に呼吸機能検査,血中好酸球数,fractional exhaled nitric oxide(FeNO),IgEの測定を行った。また受診時にasthma control test(ACT),asthma control questionnaire(ACQ)-5による症状評価を行った。Naïve群で6カ月(14名),12カ月(11名)治療継続した患者,switch群で12カ月(5名)治療継続した患者でのremissionの検討も行った。
統計学的解析には統計ソフトStatcel-the Useful Addin Forms on Excel-4th ed.を用い,Wilcoxon符号付順位検定,Spearmanの順位相関係数,Mann-Whitney検定にて解析を行った。本研究は,当院の倫理委員会によって承認され(承認番号No.20221103-01),ヘルシンキ宣言に従って実施された。
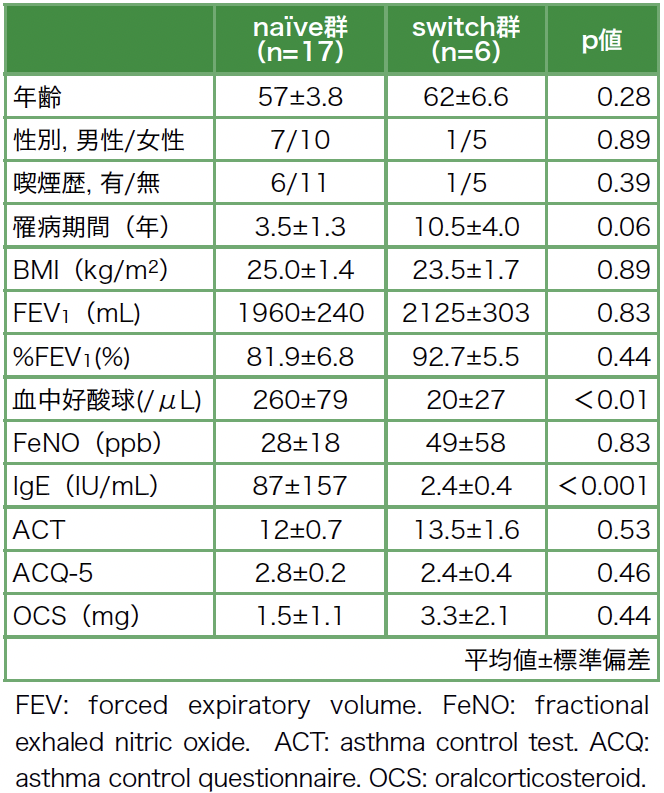
患者背景として,投与前のnaïve群とswitch群の患者背景を表1に示す。naïve群の年齢中央値は57.0歳,男性7例,女性10例であり,switch群の年齢中央値は62.0歳,男性1例,女性5例であった。喫煙歴は各6例,1例であり,年齢,性別,喫煙歴にnaïve群とswitch群で有意差は認めなかった。罹病期間の中央値はnaïve群3.5年,switch群10.5年であり有意差は認めなかったが明らかにswitch群で長い傾向であった。BMI,FEV1,%FEV1はnaïve群とswitch群で差は認めなかった。バイオマーカーでは,血中好酸球数とIgE値がnaïve群で有意に高値であった。血中好酸球数においてはswitch群で抗IL-5受容体α抗体薬が投与されている症例が複数存在したためswitch群で低値となったものと考えられ,前生物学的製剤投与前の血中好酸球数では両群に有意差は認めなかった。ACT,ACQ-5においては両群に差は認めず,いずれもコントロール不良例が多かった。定期OCS内服については両群とも2名内服していた。Switch群の生物学的製剤の使用歴は,抗IL-5受容体α抗体が2名,抗IL-5受容体α抗体→治験薬が1名,抗IL-5抗体が1名,抗IL-5抗体→抗IL-4受容体α抗体が1名,抗IL-4受容体α抗体→抗IgE抗体薬が1名であった。
表1 患者背景
FEV1のベースライン時からの変化は,naïve群では1カ月から18カ月まで有意な改善を維持した。Switch群では改善傾向であったが有意な改善は認めなかった(図1)。
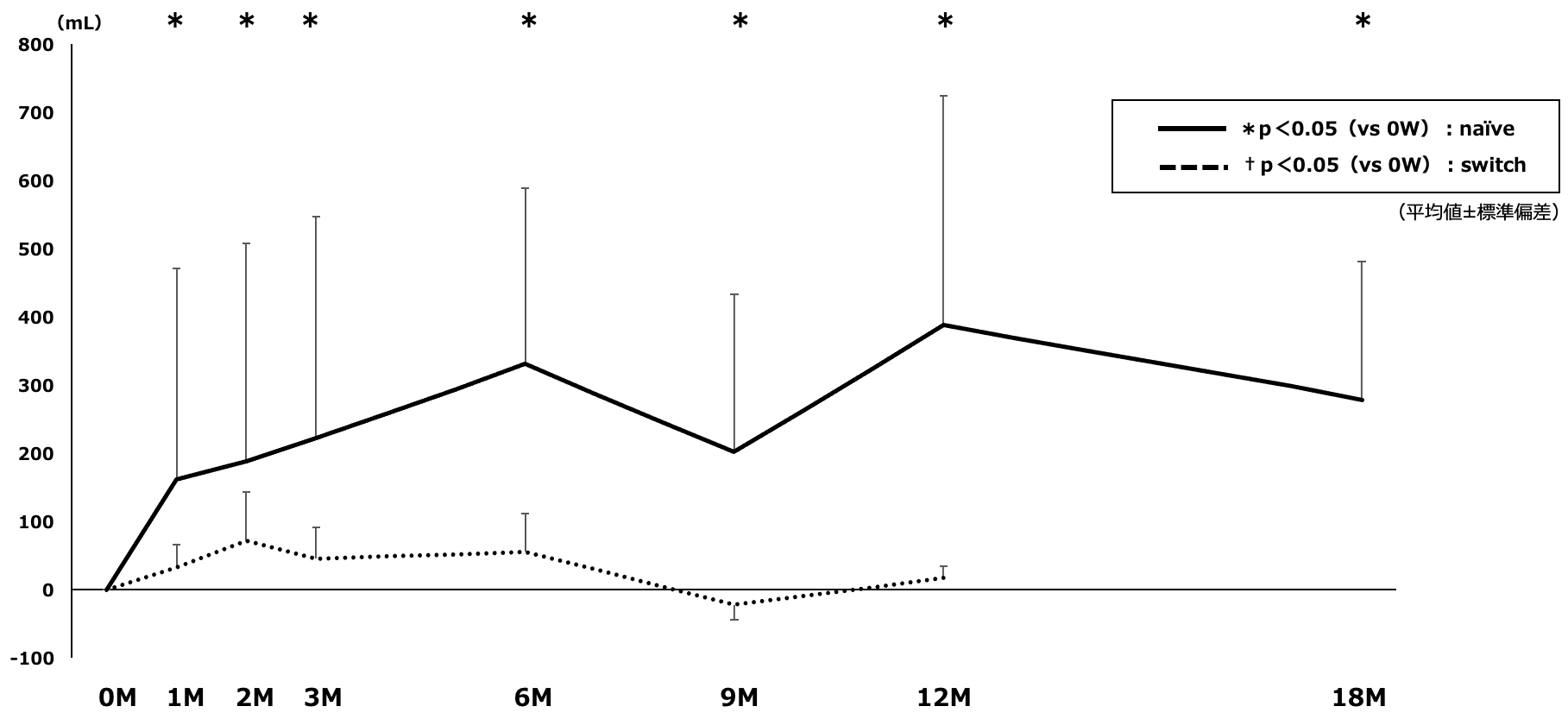
図1 FEV1のベースラインからの変化量
Naïve群では1カ月以降18カ月まで有意なFEV1改善を認めた。Switch群では改善の傾向は認めるが有意な変化は認めなかった。
ACTとACQ-5のベースライン時からの変化は,naïve群では1カ月から18カ月まで有意な改善を維持した。Switch群では有意な改善を認める月もあったが,有意な改善を認めない月もあった(図2,3)。
図2 ACTのベースラインからの変化量
Naïve群では1カ月以降18カ月まで有意な改善を維持した。Switch群では有意な改善を認める月と有意でない月が混在した。
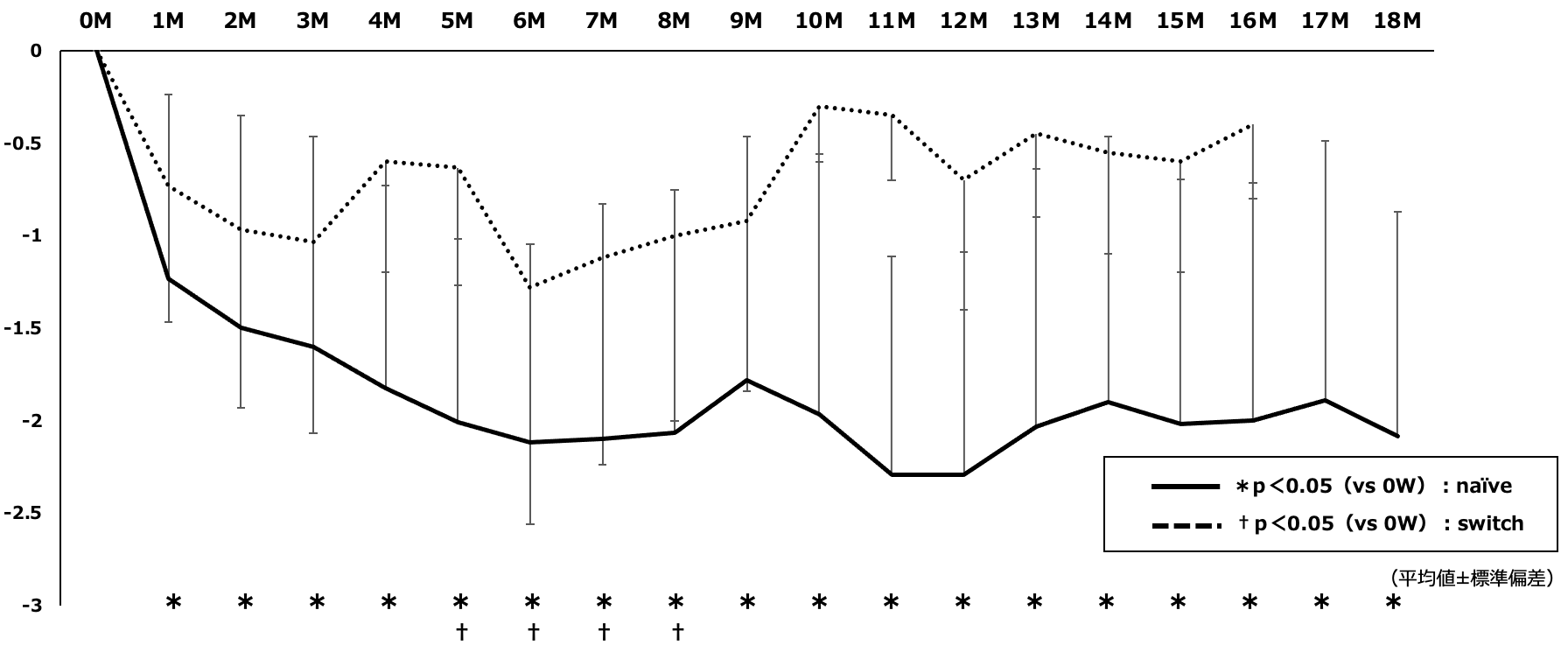
図3 ACQ-5のベースラインからの変化量
Naïve群では1カ月以降18カ月まで有意な改善を維持した。Switch群では有意な改善を認める月と有意でない月が混在した。
バイオマーカーのベースライン時からの変化は,naïve群での血中好酸球数とFeNO値は1カ月から18カ月まで有意な低下を維持した。IgEについては増減する症例を多数認め1カ月時点以外は有意な低下を認めなかった。Switch群においてはほとんどの時点で有意な変化は認めなかった(図4)。
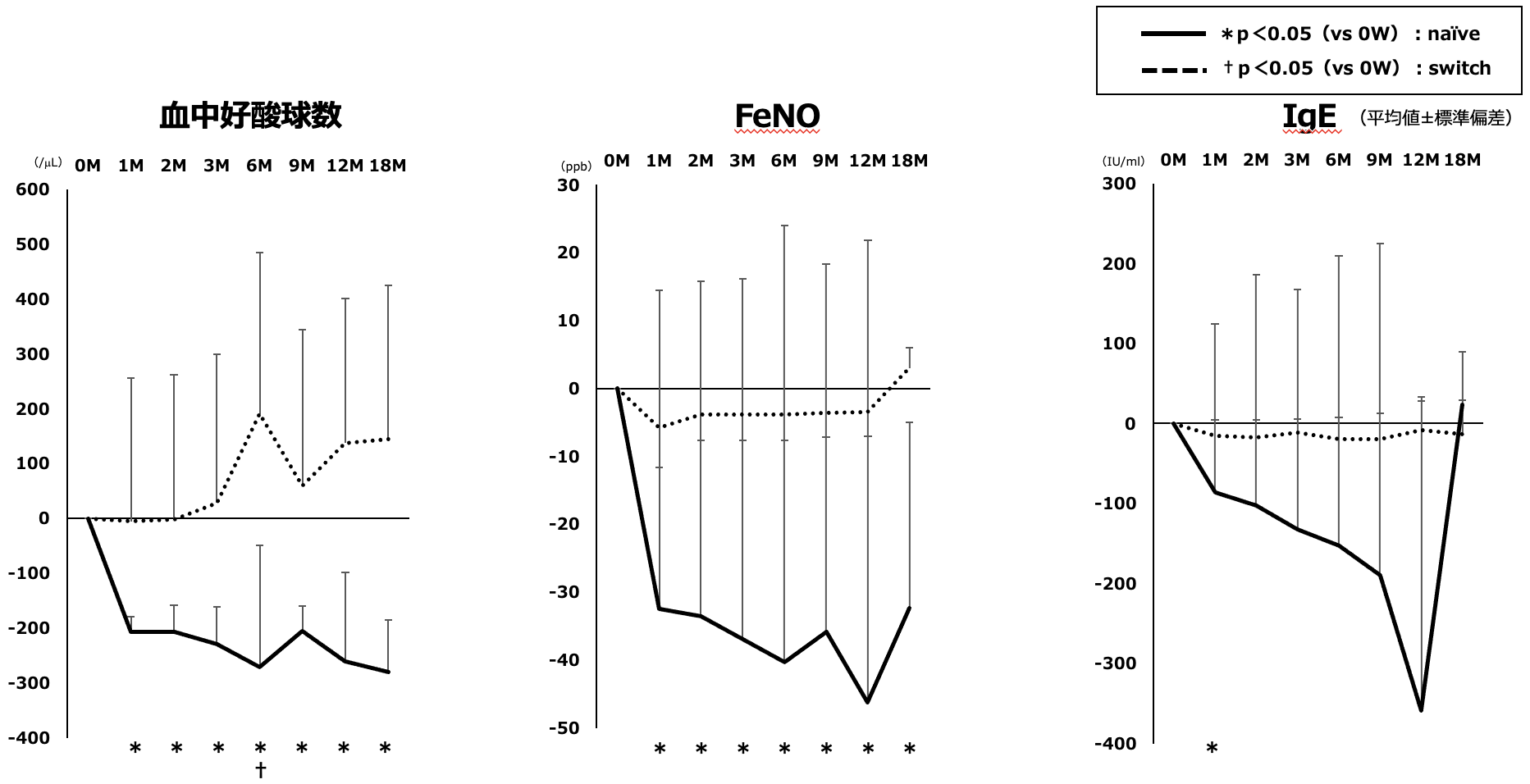
図4 バイオマーカーのベースラインからの変化量
Naïve群では血中好酸球数とFeNO値は1カ月以降18カ月まで有意な低下を維持したがIgEは1カ月目のみ有意な低下を認めた。Switch群では一時的な血中好酸球数増加以外には有意な変化は認めなかった。
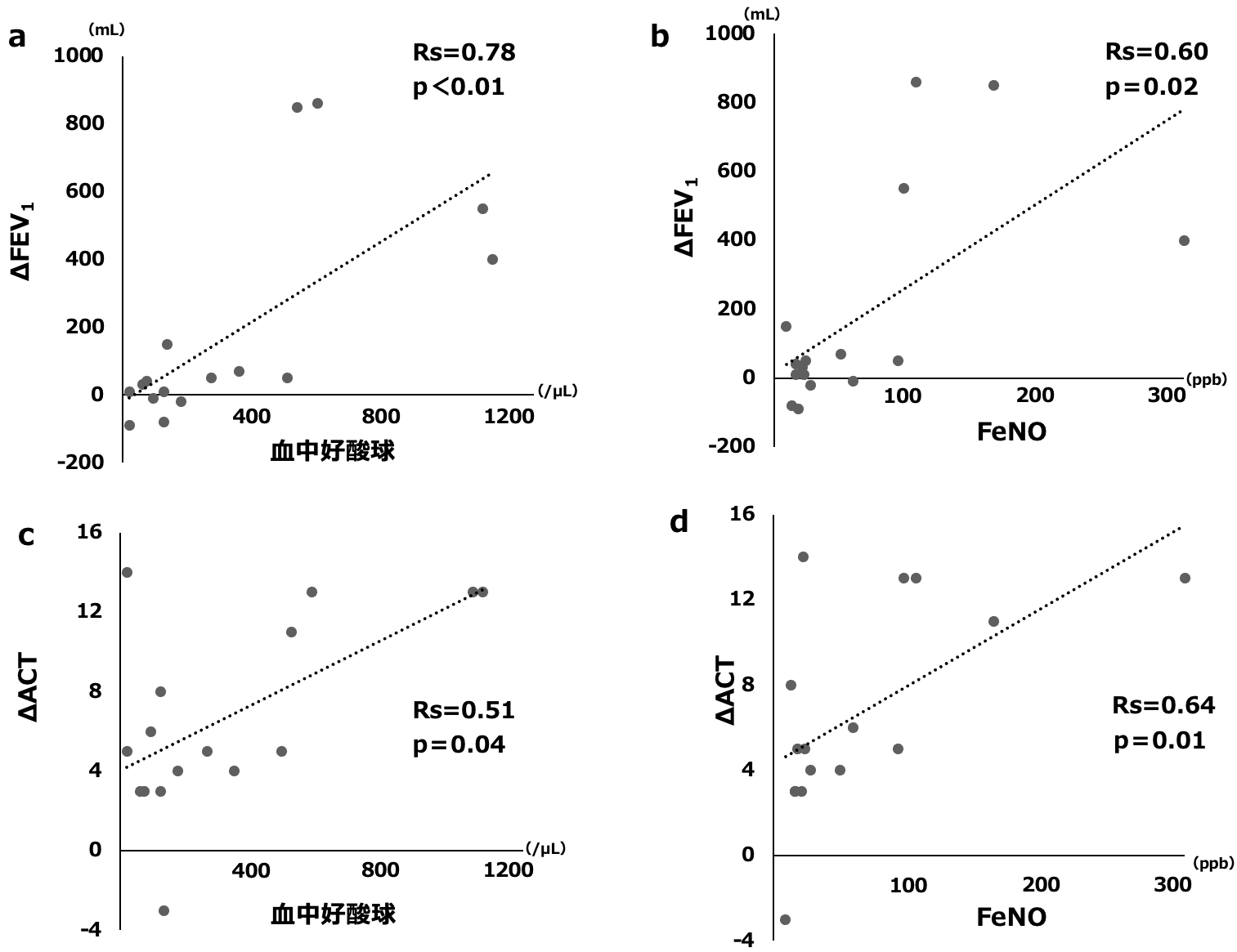
Naïve群において,投与前の血中好酸球数,FeNO値と投与開始1カ月間でのFEV1,ACTの変化量は正の相関を示した(図5)。
図5 投与開始1カ月間のFEV1とACTの変化量と投与前の好酸球数とFeNOとの相関関係(naïve群)
Naïve群では投与前の血中好酸球数とFeNO値はFEV1とACTの1カ月間での変化量と正の相関関係を認めた。
Naïve群において,3 way remission(症状の改善:ACT>20およびACT-5<1.5,OCSなし,増悪なし),4 way remission(3 way remission + 呼吸機能改善:%FEV1>80%あるいはFEV1がベースライン時より100mL以上増加),5 way remission(4 way remission + 炎症所見の改善:血中好酸球数<150/μLかつFeNO<25ppb)を6カ月(14名)と12カ月(11名)で判定を行った。6カ月の3 way remissionは71.4%,4 way remissionは64.3%,5 way remissionは42.9%の症例でremissionを達成した。12カ月の3 way remissionは72.7%,4 way remissionは72.7%,5 way remissionは45.5%の症例でremissionを達成した(図6)。
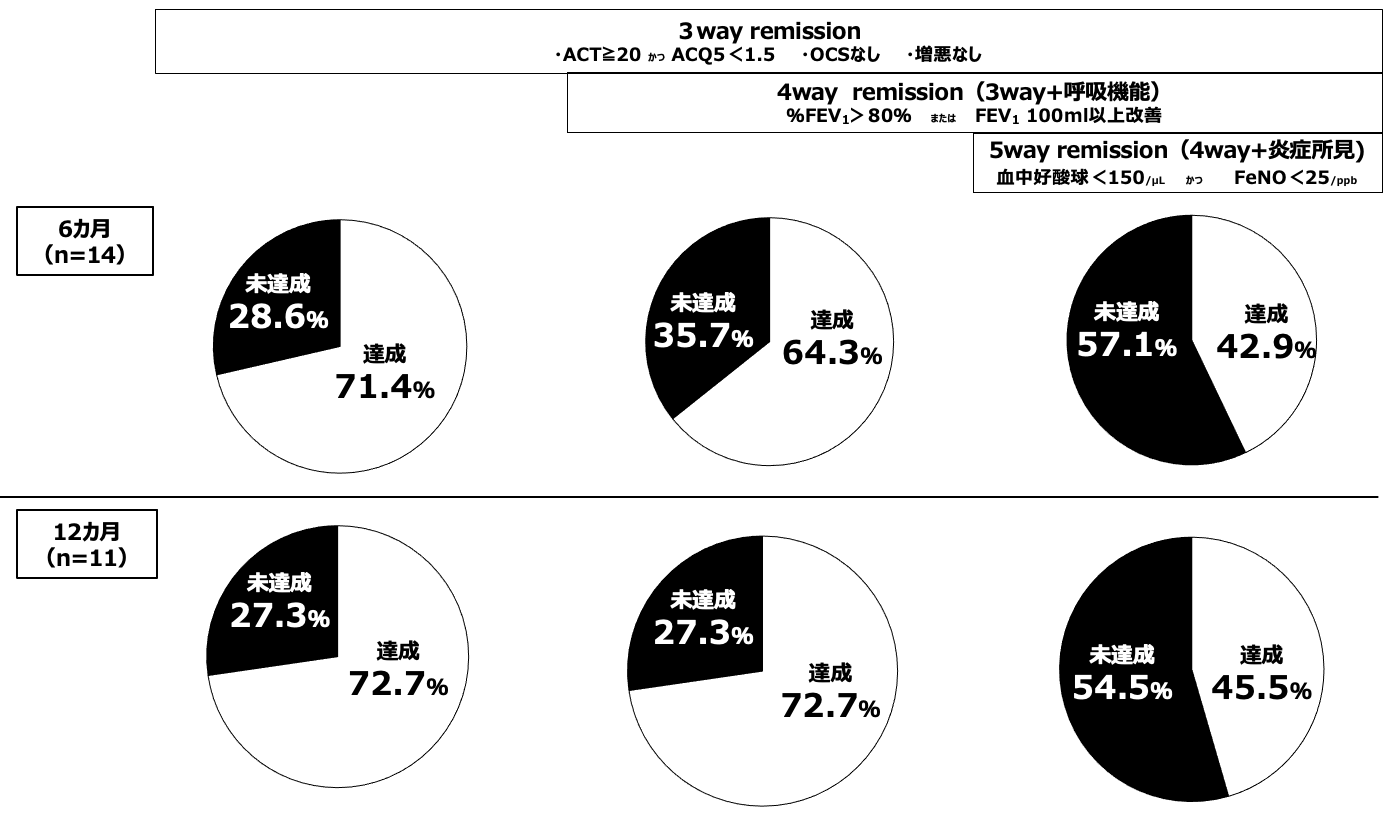
図6 6カ月,12カ月での3,4,5 way remission率(naïve群)
3 wayは6,12カ月ともに70%を超えるremission率。4 wayは6カ月では64.3%、12カ月では72.7%のremission率。5 wayは6,12カ月ともに40%台のremission率。
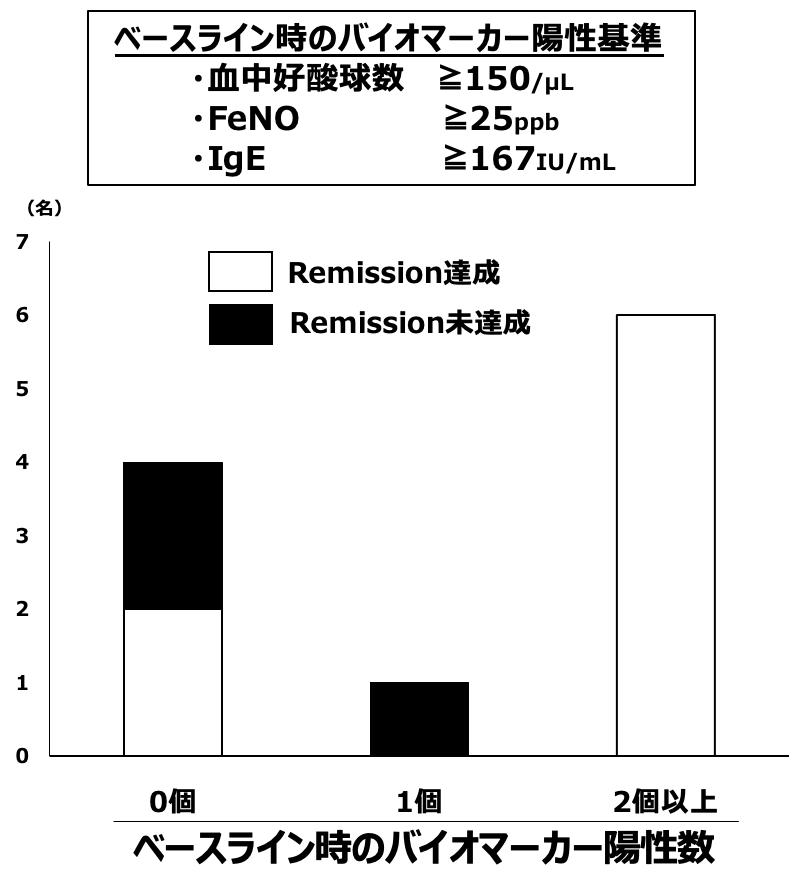
Naïve群においてベースライン時バイオマーカー陽性数(血中好酸球数 ≧150/mL,FeNO ≧25 ppb,IgE ≧167 IU/mLで陽性)別の12カ月での3 way remission達成の検討では,バイオマーカー2個以上陽性の患者は全例remission達成であった。一方でバイオマーカー0ないし1個陽性の患者ではremission未達成の患者が増加した(図7)。
図7 ベースライン時のバイオマーカー陽性数による12カ月での3 way remission達成(naïve群)
バイオマーカーが複数陽性であれば全例remission達成。バイオマーカーが0ないし1個陽性の症例ではremission未達成が増加。
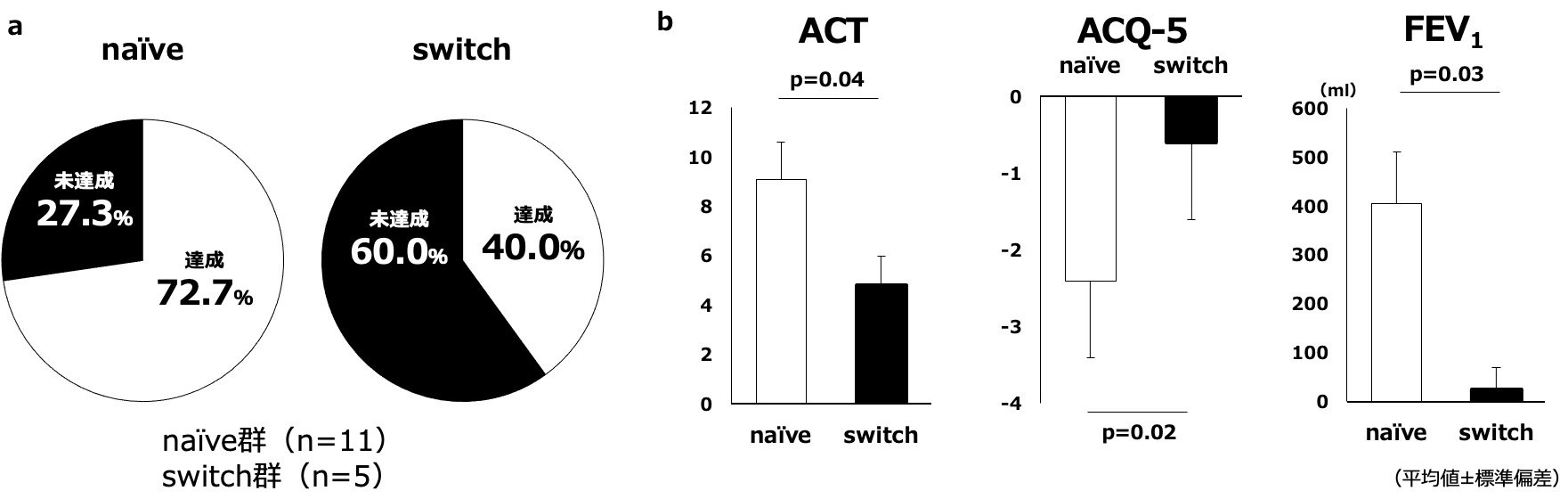
Naïve群とswitch群で12カ月でのremission率とACT,ACQ-5,FEV1の変化の比較を行った。Remission率はnaïve群で高率であった(図8a)。ACT,ACQ-5,FEV1の変化はnaïve群で有意に改善した(図8b)。
図8 12カ月でのnaïve群とswitch群の比較(remission率とACT,ACQ-5,FEV1の変化量)
Thymic stromal lymphopoietin(TSLP)はアレルゲン,ウイルス,大気汚染,タバコの煙の曝露や機械的刺激により気道上皮細胞よりの産生が促進し,type 2炎症を主体とする気道炎症を惹起する。さらにTSLPはSTAT3を活性化し,気道平滑筋細胞増生や線維芽細胞を活性化してコラーゲンⅠの産生を増加させ,気道リモデリングを促進させる。またTSLPがステロイド投与によるtype 2サイトカイン産生抑制作用やグループ2自然リンパ球(ILC2)のアポトーシス作用を抑制すること,中和抗体によりTSLPを阻害すると,コルチコステロイド感受性を回復させることが報告されておりステロイド抵抗性への関与が考えられ[12],TSLPは喘息の重症化に重要な役割を果たしている可能性が示唆された。実際に喘息患者の気管支肺胞洗浄液中のTSLP濃度は重症喘息患者ほど高値を示すことや,気管支肺胞洗浄液中のTSLP濃度とFEV1およびILC2のステロイド感受性は負の相関を示すことも報告されている[13][14]。このようにTSLPは喘息の重症化に重要な役割を有している。そしてtezepelumabはTSLPを阻害する抗TSLP抗体薬である。NAVIGATOR試験では,tezepelumab群はプラセボ群と比較して56%と有意に増悪を抑制した。血中好酸球数300cells/μL未満のサブグループにおいても年間増悪率を41%減少し,プラセボ群と比較して有意な増悪抑制効果を示した。またベースライン時のFeNOおよびIgE値によらずプラセボ群よりも増悪率を低下させたことよりtezepelumabはtype 2炎症が顕著でない重症喘息患者に対しても有効性を示す可能性が示唆された。またトラフFEV1,ACQ-6,AQLQもtezepelumab群で有意に改善を認め,血中好酸球数,FeNO,IgEはいずれも有意な低下を認めた[15]。CASCADE試験では,tezepelumab投与によりマンニトール刺激による気道過敏性に対する有効性も示された[16]。
今回,当院におけるtezepelumab投与例の臨床的有効性について検討を行った。Naïve群でFEV1,ACT,ACQ-5は1カ月の時点で著明改善する症例が複数例存在し高い臨床的有効性が認められた。著明改善例については特に血中好酸球数やFeNO高値例が多く,このことは投与前の血中好酸球数とFeNO値と投与開始1カ月間でのFEV1とACTの変化量が正の相関を示した結果とも一致する。NAVIGATOR試験ではバイオマーカー低値群でtezepelumabの有効性が示されているが,同時にバイオマーカー高値群の方がより有効性が高いことも示されている[15]。当院の実臨床の症例においてもバイオマーカー高値例で有効性が高い結果はNAVIGATOR試験とも一致する。また血中好酸球数とFeNO値が有意に低下した結果についてもNAVIGATOR試験と同様の結果であった。血中好酸球数およびFeNO値の抑制,つまりtype 2炎症を抑制することが臨床的有効性に直結しており,type 2炎症が強い患者ほどtezepelumabの効果が期待できることが推察された。
Naïve群のremissionについては6カ月,12カ月とも3 way,4 way remission達成率は60~70%台でありかなり高率であった。この結果に関しても今回の対象患者がバイオマーカー高値つまりtype2炎症が強い患者が多かったことが影響していると考えられる。ベースライン時のバイオマーカーが2個以上陽性症例では全例12カ月での3 way remissionを達成しており,この結果についてもやはりtype2炎症が強い患者ほどtezepelumabの効果が期待できることを裏付けている。5 way remission達成率は6カ月,12カ月ともに40%台でありやや低下した。ベースライン時のバイオマーカーが著明高値例ではtezepelumab投与により明らかにバイオマーカーは低下したが,血中好酸球数<150/μLとFeNO<25ppbに達さない症例が存在したためであった。しかし,バイオマーカーが正常化していなくても十分な臨床的効果を認めており,バイオマーカーの正常化の指標を今後検討していく必要がある。また,6カ月と12カ月でのremission率には大きな差を認めなかったことよりtezepelumabの効果判定は6カ月投与時点で行うことが可能かもしれない。
Naïve群とswitch群との比較でremission率や,FEV1,ACT,ACQ-5の改善は明らかにnaïve群の方が優れていた。switch群の前生物学的製剤投与前の血中好酸球数やFeNO値は両群で同等であり,今回両群で有効性に差がでた原因ははっきりしないが,switch群で罹病期間が長いことが影響していることが原因の一つとして推察される。しかし今回の検討ではswitch群は6例と少数例であり,今後さらなるデータの蓄積が求められる。また本試験は単施設後方視的研究であり,今後は前方視的研究が望まれる。
利益相反:筆頭著者はアストラゼネカ株式会社より講演料を受けている。
本論文の作成・投稿においてアストラゼネカ株式会社は関与していない。
We investigated the clinical efficacy and remission rates of tezepelumab at our hospital. In the treatment-naïve group (patients with no history of receiving biologics), significant improvements in forced expiratory volume, asthma control test, and asthma control questionnaire scores, as well as decreases in blood eosinophil counts and fractional exhaled nitric oxide (FeNO) levels, were observed. The 3-way remission (stability of symptoms, no exacerbation, no systemic steroids) rate at 12 months was high (72.7 %). Particularly, its effectiveness was higher in patients with higher blood eosinophil counts and FeNO levels. This suggests that tezepelumab may be more effective in patients with stronger type 2 inflammation.
- Chung KF, et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur Respir J. 2014; 43: 343-73. Doi:10.1183/09031936.00202013.
- Nagase H, et al. Prevalence, disease burden, and treatment reality of patients with severe, uncontrolled asthma in Japan. Allergol Int. 2020; 69: 53-60. Doi: 10.1016/j.alit.2019.06003.
- Castro M, et al. Dupilumab efficacy and safety in moderate-to-severe uncontrolled asthma. N Engl J Med. 2018; 378: 2486-96. doi: 10.1056/ NEJMoa1804092.
- FitzGerald JM, et al. CALIMA study investigators. Benralizumab, an anti-interleukin-5 receptor α monoclonal antibody, as add-on treatment for patients with severe, uncontrolled, eosinophilic asthma (CALIMA): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet. 2016; 388: 2128-41. doi: 10.1016/S0140-6736(16)31322-8.
- Laviolette M, et al. Effects of benralizumab on airway eosinophils in asthmatic patients with sputum eosinophilia. J Allergy Clin Immunol. 2013; 132: 1086-96. e5. doi: 10.1016/j.jaci.2013.05.020.
- Castro M, et al. Benralizumab, an anti-interleukin 5 receptor α monoclonal antibody, versus placebo for uncontrolled eosinophilic asthma: a phase 2b randomised dose-ranging study. Lancet Respir Med. 2014; 2: 879-90. doi: 10.1016/S2213-2600(14)70201-2.
- Pham TH, et al. Reductions in eosinophil biomarkers by benralizumab in patients with asthma. Respir Med. 2016; 111: 21-9. doi: 10.1016/j.rmed.2016.01.003.
- Ortega HG, et al. Mepolizumab treatment in patients with severe eosinophilic asthma. N Engl J Med. 2014; 371: 1198-207. doi: 10.1056/ NEJMoa1403290.
- Haldar P, et al. Mepolizumab and exacerbations of refractory eosinophilic asthma. N Engl J Med. 2009; 360: 973-84. doi: 10.1056/NEJMoa0808991.
- Humbert M, et al. Benefits of omalizumab as addon therapy in patients with severe persistent asthma who are inadequately controlled despite best available therapy (GINA 2002 step 4 treatment): INNOVATE. Allergy. 2005; 60: 309-16. doi: 10.1111/j.1398-9995.2004.00772.x.
- Berger P, et al. Omalizumab decreases nonspecific airway hyperresponsiveness in vitro. Allergy. 2007; 62: 154-61. doi: 10.1111/j.1398-9995.2006.01243.x.
- Kabata H, et al. Thymic stromal lymphopoietin induced corticosteroid resistance in natural helper cells during airway inflammation. Nat Commun. 2013; 4: 2675.
- Li Y, et al. Elevated expression of IL-33 and TSLP in the airways of human asthmatics in vivo : a potential biomarker of severe refractory disease. J Immunol. 2018; 200: 2253.
- Liu S, et al. Steroid resistance of airway type2 innate lymphoid cell from patients with severe asthma: The role of thymic stromal lymphopoietin. J Allergy Clin Immunol. 2018; 141: 247.
- Menzies-Gows A. et al. Tezepelumab in adults and adolescents with severe, uncontrolled asthma. N Engl J Med. 2021; 384: 1800.
- Gauvreau GM, at al. Effects of an anti-TSLP antibody on allergen-induced asthmatic responses. N Engl J Med. 2014; 370: 2102.