【投稿/症例報告】広範な浸潤影を呈した関節リウマチ患者の非結核性抗酸菌症

結城将明*1,徳田 均*2,永井博之*2,茂田光弘*2,江本範子*2,笠井昭吾*2,大河内康実*2
*1東京大学医学部付属病院呼吸器内科(〒113-8655 東京都文京区本郷7-3-1)
*2独立行政法人地域医療機能推進機構東京山手メディカルセンター呼吸器内科
Three cases of rheumatoid arthritis complicated with nontuberculous mycobacterial disease showing extensive consolidation in chest imaging
Masaaki Yuki*1, Hitoshi Tokuda*2, Hiroyuki Nagai*2, Mitsuhiro Moda*2, Noriko Emoto*2, Shogo Kasai*2, Yasumi Ookouchi*2
*1Department of Respiratory Medicine, The University of Tokyo Hospital, Tokyo
*2Respiratory Medicine, Tokyo Yamate Medical Center, Japan Community Health Care Organization, Tokyo
Keywords:関節リウマチ,非結核性抗酸菌症,浸潤影,免疫応答,ステロイド/rheumatoid arthritis, nontuberculous mycobacterial disease, consolidation, immune response, corticosteroid
呼吸臨床 2020年4巻2号 論文No.e00096
Jpn Open J Respir Med 2020 Vol. 4 No. 2 Article No.e00096
DOI: 10.24557/kokyurinsho.4.e00096
受付日:2019年12月17日
掲載日:2020年2月20日
©️Masaaki Yuki, et al. 本論文はクリエイティブ・コモンズ・ライセンスに準拠し,CC-BY-SA(原作者のクレジット[氏名,作品タイトルなど]を表示し,改変した場合には元の作品と同じCCライセンス[このライセンス]で公開することを主な条件に,営利目的での二次利用も許可されるCCライセンス)のライセンシングとなります。詳しくはクリエイティブ・コモンズ・ジャパンのサイト(https://creativecommons.jp/)をご覧ください。
関節リウマチ患者に発症した非結核性抗酸菌症で,通常とは異なった広範な肺炎様の浸潤影を呈し,通常の抗酸菌治療に対して抵抗性であった3症例を経験した。強力な治療にもかかわらず滲出性病変が拡大の一途をたどり,広範な空洞形成に至った例もあった。3例中2例で,抗菌薬に加えてステロイドを投与することで,良好な治療効果が得られた。この病態には関節リウマチ患者特有の過剰な免疫応答が関与している可能性も考えられた。
近年,関節リウマチ(Rheumatoid arthritis:RA)の治療中に非結核性抗酸菌症(nontuberculous mycobacterial disease:NTM症)を合併する例が増加している[1]。国立病院機構免疫異常ネットワークのリウマチ性疾患データベース(National Database of Rheumatic Diseases in Japan:NinJa)の報告では,2013年のRA患者のNTM症の罹患率は173.2,有病率は987.6(人口10万対)と,いずれも一般人口の推定罹患率,有病率の約10倍という高率であり,非常に広範かつ深刻な様相を呈している[2]。NTM症は,結核症同様,宿主の免疫応答により病像が異なるとされており[3][4],RAという免疫異常宿主に発症するNTM症にはRA特有の病像及び治療上の問題があり得るが,これまでまとまった検討は少ない。われわれはRA患者において,急速な進展と病状の重篤化を伴い,胸部画像検査にて広範な浸潤影を伴い,通常の治療に対して抵抗性であったNTM症3症例を経験したので,その重症化の機序や適切な治療について考察する。
患者:70歳,女性
主訴:発熱
既往歴:57歳時にRAと診断,ステロイドおよびサラゾスルファピリジンの投与にて症状は安定していた。
喫煙歴:なし
現病歴:200X−2年(RA診断10年後)頃,胸部画像上右上葉の浸潤影を指摘され,喀痰よりMycobacterium avium(M. avium)が検出され,NTM症(MAC症)と診断された。クラリスロマイシン(CAM)400mg/day,レボフロキサシン(LVFX)500mg/day,リファンピシン(RFP)450mg/dayで治療が行われたが病状は増悪し,200X−1年9月よりエタンブトール(EB)500mg/dayが追加され,さらに同年12月よりカナマイシン(KM)0.5g/2回/週の投与が開始された。しかし画像所見の悪化および持続する炎症反応高値は制御されず,200X年11月当院に紹介入院となった。
入院時現症:身長159 cm,体重37.6 kg,BMI 14.9。体温36.2℃,血圧115/71 mmHg,脈拍数106/分・整,呼吸回数18回/分,SpO2 98%(室内気)。胸部;呼吸音・左右上肺野にて軽度crackles聴取。四肢;手指の変形・疼痛なし。
血液検査:白血球11,800/µL,CRP 8.6mg/dL,血沈60分値111mmと炎症反応の上昇を認めた。
細菌検査:喀痰の抗酸菌検査ではチールネルゼン染色にてガフキー3号相当の塗抹陽性,PCRでM. avium陽性,培養では3週間でコロニー数20個であった。
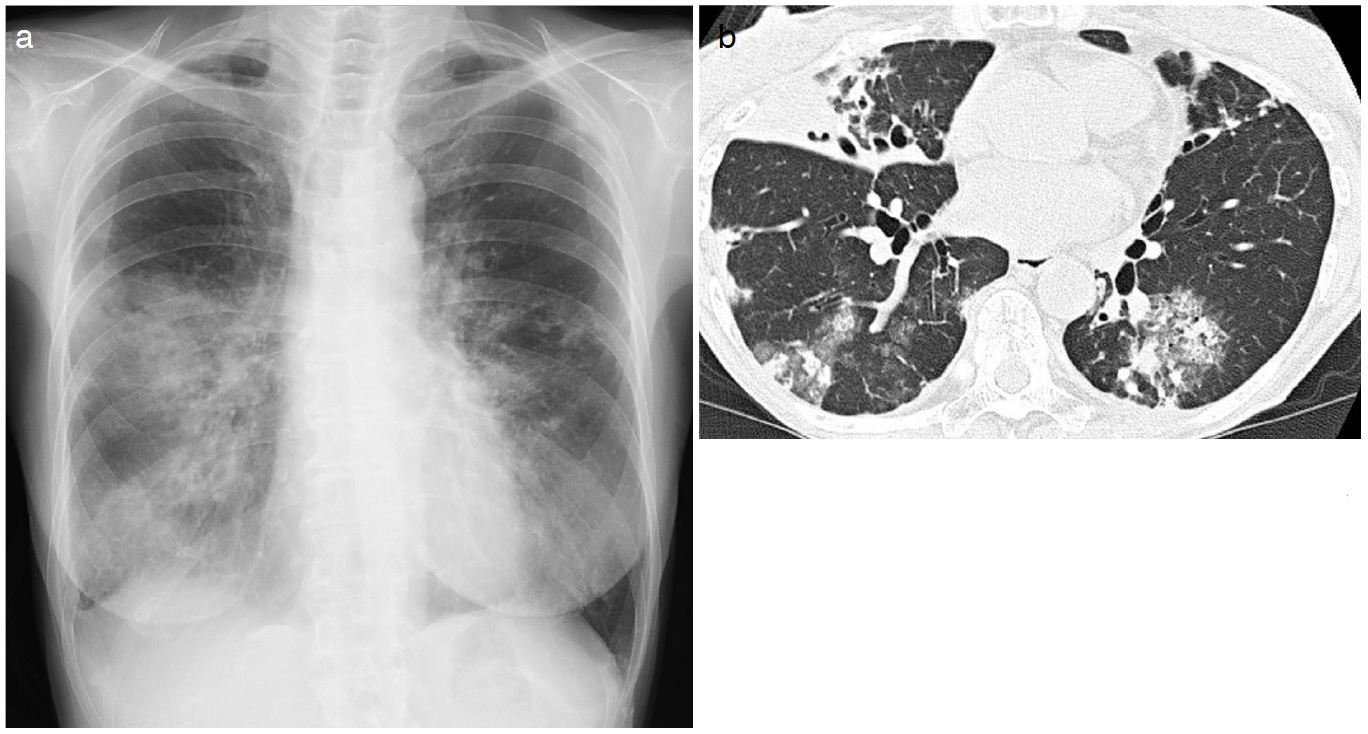
画像所見:胸部単純X線写真では右上肺野に巨大空洞とその周囲の浸潤影あり,また左肺野にも同様の所見があった(図1a)。胸部CTでは,びまん性に気管支拡張の所見あり,右肺上葉・中葉に大小の空洞影があり,周囲に浸潤影と散布影を伴っていた(図1b)。RA特有の間質性肺炎の所見は認めなかった。
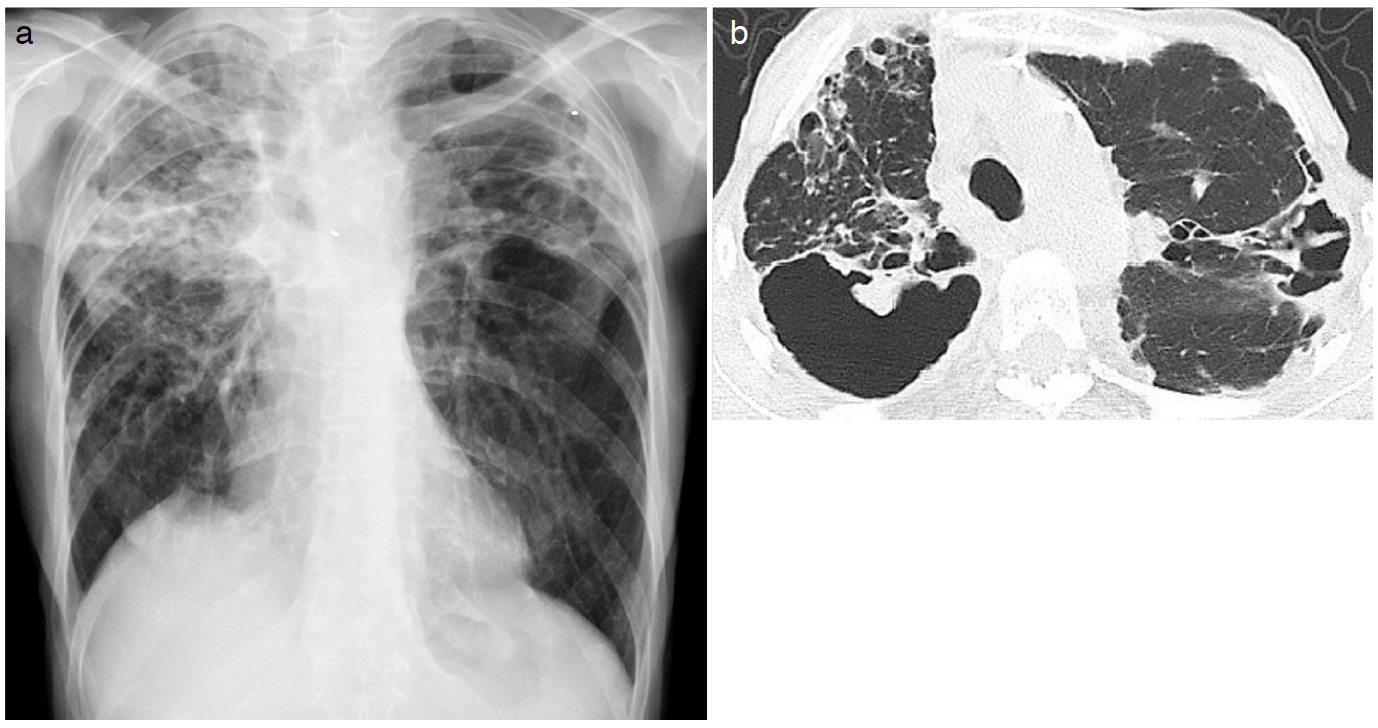
図1 70歳女性,2年前よりMAC症が悪化
a. 右肺上肺野に巨大空洞とその周囲の浸潤影あり,また左肺野にも同様の所見あり。
b. 右肺上葉と左肺上葉に大小の空洞影があり,周囲に浸潤影と散布影を伴っている。また気管支拡張の所見も認める。
入院後経過:入院後よりLVFXをモキシフロキサシン(MFLX)400mg/dayに変更,また週2回ストレプトマイシン(SM)0.3gのネブライザー吸入を開始した。治療開始後咳,痰は改善したが,食思不振は改善せず,炎症制御の目的でmethylprednisolone(mPSL)125mg×3日を2コース投与したところ食思不振は改善し,体重も1kg増加し,退院となった。
退院後経過:外来ではCAM+EB+MFLXで加療を継続した。しかし3~4カ月毎に悪化,入院治療を繰り返し,排菌量も徐々に増加,画像では,各肺葉の空洞のいずれもが拡大した(図2a,b)。抗菌薬を中心にさまざまな治療を行ったが改善は得られず,紹介元の地元の病院へ転医した。200X+2年死亡が確認された。
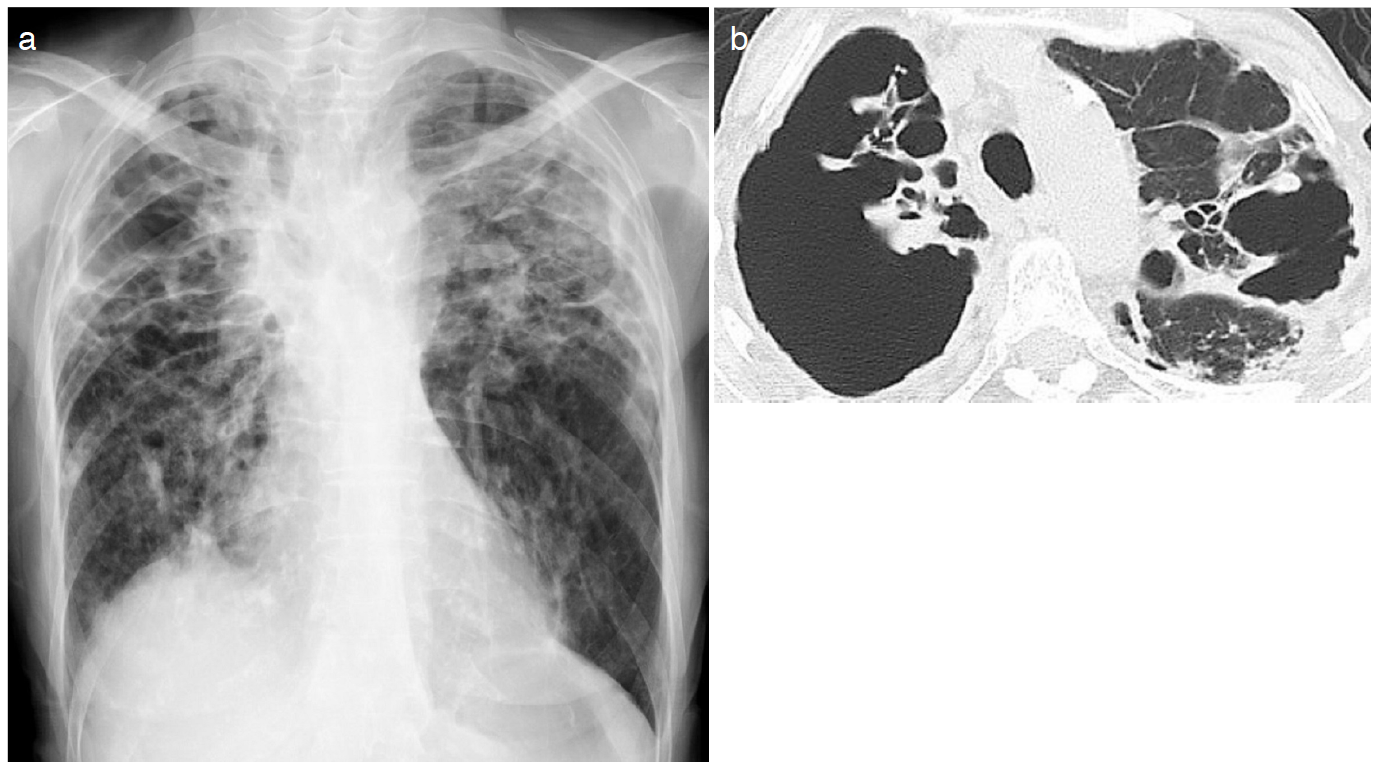
図2 2年後さらに増悪
a. 右肺上肺野の空洞が拡大し,左肺上肺野の浸潤影も拡大。
b. 右肺上葉と左肺上葉の空洞影がさらに拡大。
本例は発病初期より適切な抗菌療法が投与され,また菌のCAMへの感受性は良好であったにもかかわらず,次々と発熱と共に新たな浸潤影が出現,それがやがて空洞化し,さらに次の悪化が起こるという経過を取り,進行を制御できなかった。この様な経過は一般宿主のMAC症でもまれであるが報告されており[5],その機序に関心が持たれる。
患者:66歳,女性
主訴:労作時呼吸困難(修正MRC II度)
既往歴:37歳時にRAと診断,メトトレキサート(MTX)およびタクロリムスにて治療され安定していた。
喫煙歴:なし
現病歴:200X−3年にMAC症と診断。CAM 600mg/dayおよびEB 500mg/dayの投与を1年間受けた。その後安定していたが,200X年4月より労作時呼吸困難が出現,同年12月に精査加療目的にて当院へ入院となった。
入院時現症:身長151 cm,体重36.5 kg,BMI 16.1。体温36.0℃,血圧139/96 mmHg,脈拍数83/分・整,SpO2 97%(室内気)。胸部;呼吸音・清。四肢;両手指の尺側偏位,両足の外反母趾を認める。
血液検査:CRP 1.5mg/dL,血沈60分値100mmと炎症反応の上昇を認めた。
細菌検査:喀痰および気管支洗浄液の一般培養検査よりPseudomonas aeruginosaを検出。抗酸菌検査ではチールネルゼン染色にてガフキー3号相当の塗抹陽性,PCRでM. avium陽性,培養は3週間でコロニー数50個であった。
画像所見:胸部単純X線写真では右中下肺野に広範な浸潤影があり,また左中肺野には粒状影を認めた(図3a)。CTではびまん性に気管支拡張および気管支壁肥厚の所見あり,中葉に広範な浸潤影,両下葉に斑状影およびすりガラス様陰影の散在を認めた(図3b)。RA特有の間質性肺炎の所見は認めなかった。
図3 66歳女性,3年前よりMAC症を指摘
a. 右中下肺野に広範な浸潤影があり,また左中肺野には粒状影を認める。
b. 中葉に広範な浸潤影,両下葉に斑状影およびすりガラス様陰影の散在を認める。また気管支拡張および気管支壁肥厚の所見も認める。
入院後経過:当初細菌性肺炎を疑い,抗菌薬セフピロム(CPR),パズフロキサシン(PZFX)1g/day,メロペネム(MEPM)1.5g/dayをそれぞれ順に約1週間ずつ投与したが,まったく改善は得られなかった。MAC症の肺炎型と考え,一般抗菌薬は中止とし,CAM 600mg/day,シタフロキサシン(STFX)100mg/day,EB 500mg/day,アミカシン(AMK)200mg・2回/週の投与を開始した。また,炎症鎮静の目的でmPSL 125mg×3日を1コース投与し,その後プレドニゾロン(PSL)10mg/dayの内服を開始した。画像所見および炎症反応は速やかに改善し退院となった。
退院後経過:PSLを5mg/dayまで漸減し,CAM+EB+STFX+PSLで経過良好で6カ月後に抗菌化学療法を終了とした。3カ月後に再燃が起こったが,1年間の抗菌化学療法を行い,その後安定し,最終治療終了後1年7カ月後の現在まで肺MAC症の再発はない。
患者:69歳,男性
主訴:発熱,咳嗽,食思不振
既往歴:高血圧症,66歳時にRAと診断,ステロイドおよびMTXの投与を受けてコントロールは良好であった。
喫煙歴:20歳代に数本,5年
現病歴:RA診断後1年の胸部単純CTで両肺の気管支拡張像と中葉の結節影を指摘されたが経過観察となっていた。2年後の200X年3月より咳嗽が出現,同年8月から増悪した。前医で胸部画像上左肺野に広範な浸潤影,すりガラス影があり,細菌性肺炎と診断され,抗菌薬タゾバクタム/ピペラシリン(PIPC/TAZ)の投与を受けたが改善は得られなかった。器質化肺炎の合併と判断されPSL 30mg/dayが開始されたところ画像所見は軽快傾向となり,外来にて引き続きPSLが漸減投与されていた。2カ月後の200X年10月に突然39℃台の発熱,咳が出現し,当院へ紹介,入院となった。
入院時現症:身長169 cm,体重56.9 kg,BMI 19.9。意識清明,体温39.3℃,血圧115/76 mmHg,脈拍数79/分・整,呼吸回数18回/分。胸部;呼吸音・右背部にて軽度coarse crackles聴取。四肢;手指の変形・疼痛なし。
血液検査:白血球数9,180/µL,CRP 8.4mg/dL,血沈60分値83mmと炎症反応の上昇を認めた。
画像所見:胸部単純X線写真では左中下肺野に浸潤影と散布性結節影を認めた(図4a)。胸部CTでは左上葉と下葉にそれぞれ区域性の汎小葉性の浸潤影が出現し,左下葉には粒状影も出現していた(図4b)。左上葉に気管支拡張の所見あるが,RA特有の間質性肺炎の所見は認めなかった。
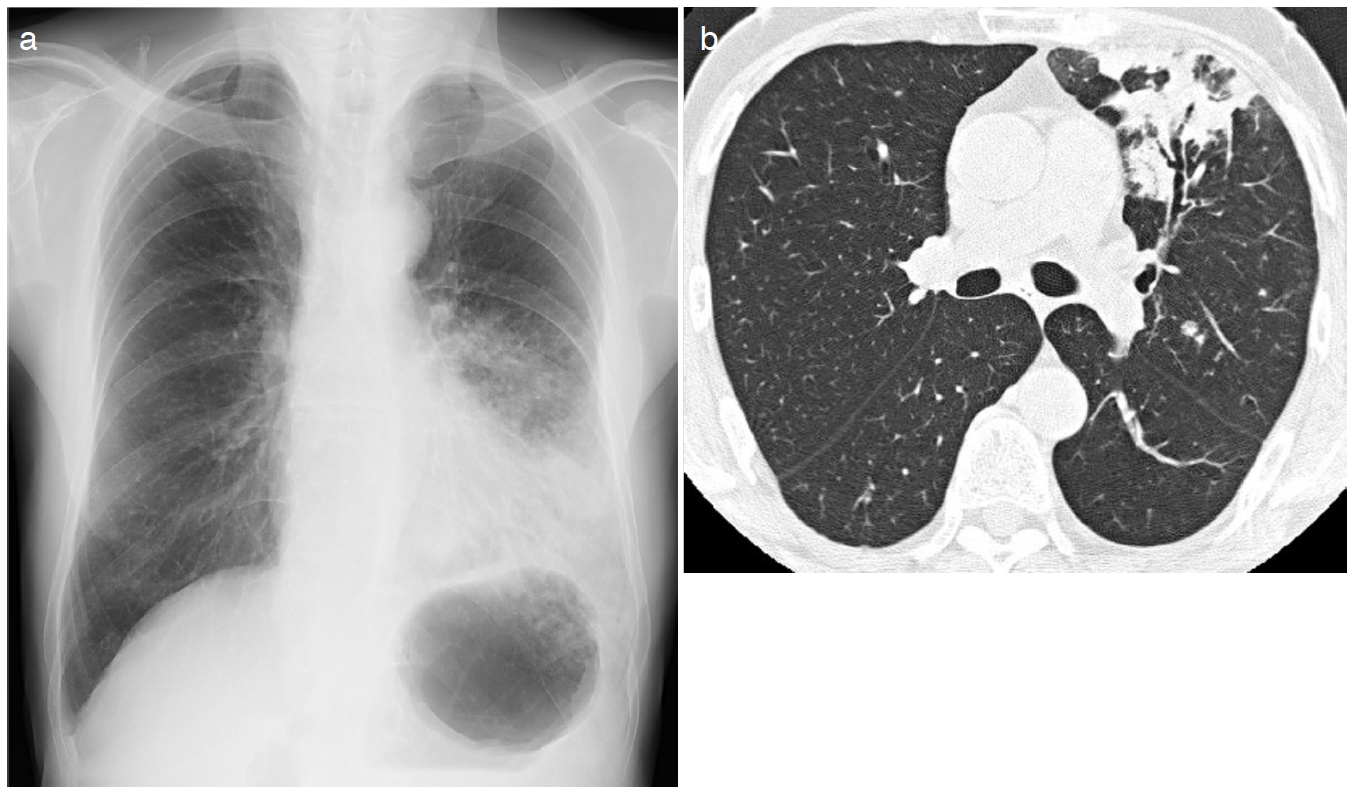
図4 69歳男性:2カ月前より肺炎様の陰影を指摘されてきた
a. 左中下肺野に浸潤影と散布性結節影を認める。
b. 左上葉に区域性の汎小葉性の浸潤影が出現し,左下葉には粒状影も認める。
入院後経過:当初高熱を伴う広範な汎小葉性の浸潤影であり,細菌性肺炎,結核性肺炎などを疑ったが,喀痰の細菌検査で一般細菌は有意なものを検出せず,一方喀痰および胃液より抗酸菌塗抹陽性(ガフキー10号相当),PCR検査にてM. tuberculosisは陰性,またM. intracellulare陽性を確認したため,肺炎型のMAC症と診断した。入院後CAM 800mg/day,STFX 100mg/day,EB 750mg/day,AMK 500mg・2回/週の投与にて治療開始した。肺野の浸潤影が広汎であり,症例1の経験からその領域の乾酪壊死,空洞形成を懸念し,それを防止するために,mPSL 250mg/dayの点滴静注を2日間施行し,その後PSLの内服量を40mg/dayへ増量し投与した。これらの治療により画像所見,炎症反応および臨床症状の速やかな改善を得て,退院となった。PSL 5mgまでステロイドを漸減し,画像所見においてもほぼ陰影は消退したため,治療開始から8カ月後に他院に転院となった。
関節リウマチ(RA)の合併症の1つに肺感染症があり,特に生物学的製剤の使用に伴い結核,非結核性抗酸菌症(NTM症)が多発している[6]。肺NTM症は,環境の常在菌であるNTMが気管支拡張症,間質性肺炎などの肺の構造改変部に定着し,発症することが多いと考えられている。RA患者は高率に気道病変(気管支拡張症,細気管支炎),間質性肺炎を合併する[7][8]ので,抗酸菌が定着し,肺NTM症の合併(RA-NTM症)を発症しやすい。さらに,そこに生物学的製剤などの免疫抑制薬が加わって高い率での発症を起こしていると推察されている[9]。
Winthropらの米国での疫学研究によると,RA-NTM症の発症率は同年代の健常人の2倍であり,これに生物学的製剤が加わるとさらに5倍,併せて10倍であった[10]。また本邦でのNinja研究が示す年間発症数は10万人当たり173.2人にも及んでおり[2],RA-NTM症は着実に増加してきている。その予後について,NTM症自体は,かつて比較的予後良好と考えられてきたが,最近では死亡数が増加しているという報告[11]があり,またさまざまな因子によって予後が異なってくるという報告[12]もある。ただしRA-NTM症については報告が少ない。わが国では単一施設からの報告が1つあり,RA-NTM症の発症後5年での死亡率は33.9%と一般患者と比して不良であった[13]。しかし,その内訳では間質性肺炎や肺炎の死因も多くを占めており,死因がNTM症の悪化によるものは15.8%であった[13]。RA-NTM症の予後には,菌種,NTM病変の病型と広がり,既存の肺病変の有無とその広がり,副腎皮質ステロイド薬など免疫抑制薬の投与,炎症の持続,全身状態などさまざまな因子が関わるとされる。X線病型としては結節・気管支拡張型が多く,85%以上を占める。その経過は概して緩慢であり,再燃を繰り返しつつ徐々に進展するとされている。
われわれが経験した3症例は,このような緩慢な経過をとるRA-NTM症とは異なり,臨床症状および画像所見にて急性の経過を呈した。画像的には細菌性肺炎を思わせる広範な浸潤影が形成され,症例1では形成された浸潤影の内部に広範な壊死,空洞形成が起こり,その後の経過が不良であった。一般宿主の肺MAC症の経過としてこのような急激な悪化所見を観察することはまれである。
RA-NTM症の画像所見を考えるにあたり,一般宿主におけるNTM症の病理学的,画像的特徴を確認しておく必要がある。NTM症,特にMAC症の病理学的検討を行った岩井らの報告[3]によると,MAC症の病理像は結核症と類似するものの,いくつかの点で異なる。病理学的に病変は肉芽腫形成が主で,滲出性病変(肺炎型)を形成することはまれである。この病理学的特徴は画像所見にも反映され,画像上MAC症は結節影が主で,代表的な病型,結節・気管支拡張型の結節はこの肉芽腫に相当すると考えられる[14]。これに対して結核症においては,肉芽腫形成が高頻度に見られるが,一方少なからぬ頻度で滲出性病変(肺炎型)が見られ[15],中心部で空洞化が起きていく。このような滲出性病変,そしてそこからの空洞化はMAC症においてはまれである。田島らのMACで死亡した32例の剖検例についての報告では,6例が急速に進行し,広範な浸潤影,多房性巨大空洞を形成し,3年から10年の経過で死亡したとしている[5]が,これは1977年の報告で現在の実態とは異なる可能性がある。最近の国内の報告では,画像上大葉性肺炎型の陰影を呈したMAC症の報告が2例あり,1例は空洞が形成されず改善し,もう1例では空洞が残存し肺葉切除が行われている[16][17]。また海外においても,乾酪性肺炎様の病像を示し,抗菌療法に加えてのステロイド投与が奏功した症例の報告がある[18]。
ここに提示したRA-NTM症の3症例(表1)はいずれも入院時に浸潤影を呈しており,病理学的には滲出性病変と推定される。症例1においては強力な抗菌薬の処方にもかかわらず滲出性病変から空洞化に至っていた。空洞化したことは乾酪壊死の結果と考えられ,菌の撒布に対する宿主の強い免疫応答があったと考えられる。また症例2,3においては,ステロイド治療が一定の効果を示したことからやはり宿主免疫の過剰発動が示唆される。RA患者はもともとT細胞から放出されるサイトカインのバランスが崩れていると言われており[19],薬剤に対するアレルギーを起こしやすいなど,免疫の過剰な発動が起こりやすい宿主と考えられている。この3症例において滲出性病変を呈した過剰な免疫応答は,サイトカインバランスの乱れを伴うRA特有の免疫の発動が関与している可能性が考えられる。国内でも,RA患者のMAC症で滲出性病変を呈した例が報告されている[20]。
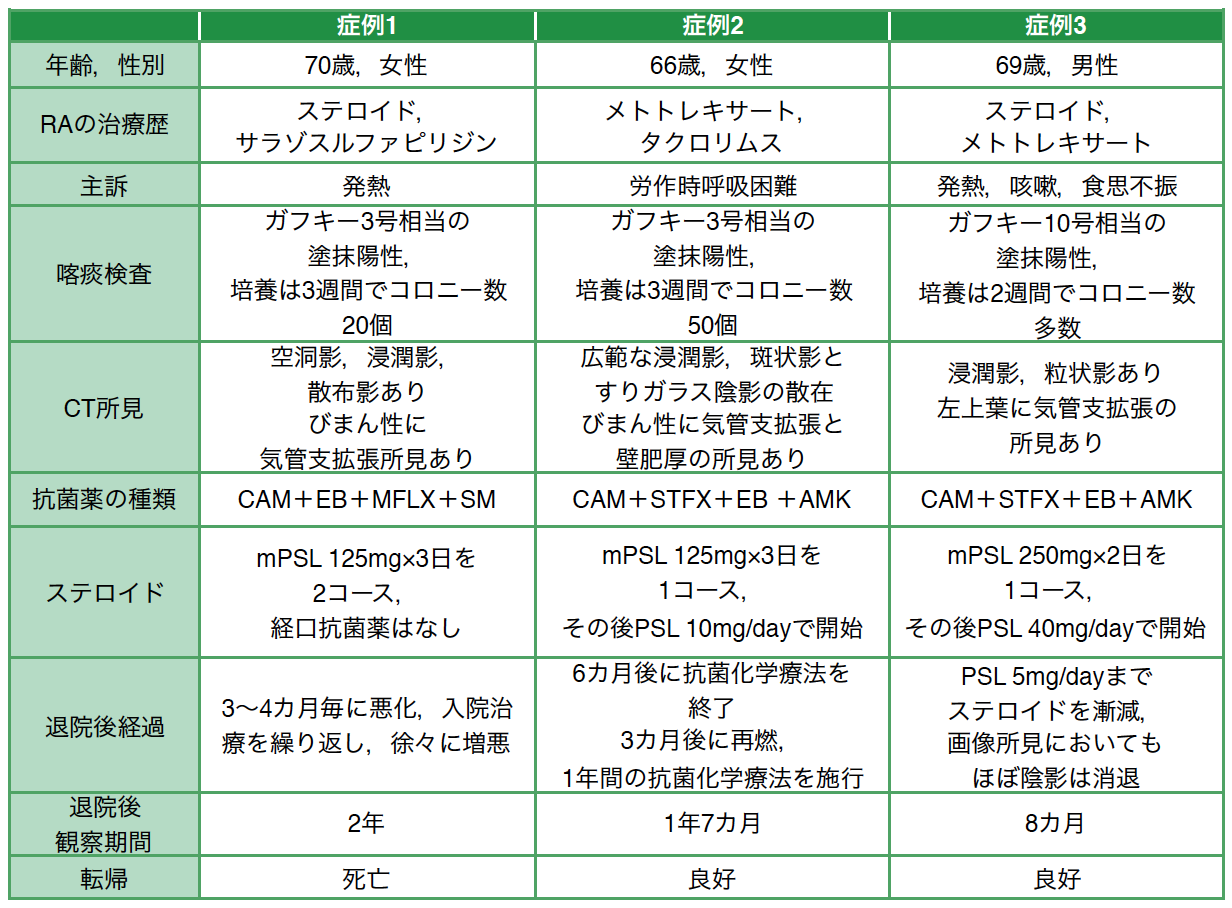
表1 3症例のまとめ
藤田らは非結核性抗酸菌症の病像を免疫動態と病理所見とから解析している[4]。MAC症の病理,画像形態の解析には,結核症において確立された組織分類である滲出性反応と増殖性反応を当てはめることができるとされる。空洞病変や滲出性反応を呈する病変ではより多くの菌体を認めておりTh2型の炎症が中心となっている(感染型)と考えられており,一方,増殖性反応に移行するに従い菌量は少なくなりTh1型による肉芽腫形成が主体となる(宿主応答型)。このように宿主の免疫応答の強弱,パターンにより,さまざまな病理所見,すなわち画像所見が形成されるとしている。
われわれの3症例は,画像から滲出性反応が主体と考えられ,藤田の言う感染型に該当すると思われる。抗酸菌感染症の病像と免疫の関連については,結核症について,肉芽腫や空洞などの病変形成過程に各種炎症細胞やサイトカインが複雑に関わっていることについて多くの研究がある。それらの過程のうち,肉芽腫形成にはTh1系が関与することはほぼ意見が一致しているが,その他の病変,滲出性病変や乾酪壊死において関与する免疫細胞,サイトカイン,メディエーターなどの詳細については議論が錯綜しており,TNFαやIL17の関与が言われるなど,いまだ定説を見るに至っていない[21]。一方MAC症における病像と宿主免疫との関連については藤田ら以外には実証的な検討はほとんど見られない。RAのMAC症についても同様である。今後の課題と思われる。
われわれの3症例において,炎症制御の目的で少量のステロイドパルスを施行し,2例において良好な結果を得た。現在のところNTM症へのステロイド投与の適応,種類,量,投与経路についてはまとまった議論を見ない。しかし結核症については,補助的ステロイド投与についての多くの研究をまとめたシステマティックレビューの中で,中等量のステロイド(cortisone 300mg)の経静脈的投与で開始,その後漸減することで予後を改善できたという報告も示されている[22]。ステロイドパルスは通常生命を脅かす急性の病態に好んで使用されるが,慢性状態における病態鎮静目的のステロイドパルス使用については,膠原病関連の間質性肺炎に対して行われ安全かつ有効であったとする報告もあり[23],今後さらなる検討が必要と思われる。
これらをふまえれば,広範な浸潤影を呈し急激な経過を取って進展するRA-NTM症をみた場合,まず一般細菌の関与をも疑うべきであるが,それらをも念頭に置きつつ抗菌化学療法を行いなお制御できない場合,肺炎型MAC症を考え,その場合,症例1のようにその後の乾酪壊死,空洞化が懸念されるので,これを防止するためにも,十分に有効な抗菌薬と併用してのステロイドの投与は試みる価値があると考えられる。
利益相反:本主題に関して利益相反はない。
With the advent of biologic therapy and their successful improvement in disease control in rheumatoid arthritis (RA) patients, respiratory infections are attracting attention as important adverse events of biologic and non-biologic therapy for RA. Among them, nontuberculous mycobacterial disease (NTM disease) is one of the most important problems. Yet its clinical and radiological features have not been well documented in contrast with non-RA patients.
We present three cases of RA patients with NTM disease, in whom computed tomography (CT) showed extensive consolidation. It is not usual as chest imaging of NTM disease, which is mainly composed of nodules, cavities and bronchiectasis. Furthermore, NTM diseases in these cases were resistant to the ordinary antimicrobial treatment. One of three patients had extensive consolidation which resulted in huge cavity formation in bilateral lung, leading to rapid and lethal progression, despite of intensive antimicrobial therapy. In other two cases, treatment with adjunctive corticosteroid was effective and resulted in complete resolution.
We hypothesize that these extensive consolidations might be caused by excessive immune response of RA patients, and suggest that antimicrobial therapy combined with additional corticosteroid might be effective in such cases.
- Takayanagi N, et al. Pulmonary infections in patients with rheumatoid arthritis. Nihon Kokyuki Gakkai Zasshi 2007; 45: 465-73. PMID: 17644942.
- 片山雅夫, ほか. NinJaを利用したRA患者における非結核性抗酸菌症の有病率, 臨床像, 危険因子の検討 NinJa2012から2014までの解析. 第60回日本リウマチ学会総会・学術集会抄録集. 2016: 552.
- 岩井和郎, ほか. 第2章, 非結核性抗酸菌症の病理学. 非定型抗酸菌症の病理学. 斎藤 肇, 監修. 非定型抗酸菌症の基礎と臨床. 東京: 医療ジャーナル社, 2015; 578-99.
- 藤田次郎. 肺非結核性抗酸菌症の多彩な臨床・病理像: 肉芽腫形成の視点から. 日サ会誌. 2019; 39: 11-7.
- 田島 洋, ほか. 肺非定型抗酸菌症32剖検例についての臨床病理学的検討. 結核. 1987; 62: 395-401.
- Winthrop KL, et al. Bedfellows: mycobacteria and rheumatoid arthritis in the era of biologic therapy. Nat Rev Rheumatol. 2013; 9: 524-31. doi: 10.1038/nrrheum.2013.82. PMID: 23797309.
- Mori S, et al. Different risk factors between interstitial lung disease and airway disease in rheumatoid arthritis. Respir Med 2012; 106: 1591-9. doi: 10.1016/j.rmed.2012.07.006. PMID: 22867979.
- Bongartz T, et al. Incidence and mortality of interstitial lung disease in rheumatoid arthritis: a population-based study. Arthritis Rheum 2010; 62: 1583-91. doi: 10.1002/art.27405. PMID: 20155830.
- Mori S, et al. Radiological features and therapeutic responses of pulmonary nontuberculous mycobacterial disease in rheumatoid arthritis patients receiving biological agents: a retrospective multicenter study in Japan. Mod Rheumatol. 2012; 22: 727-37. doi: 10.1007/s10165-011-0577-6. PMID: 22207481.
- Winthrop KL, et al. Mycobacterial diseases and antitumour necrosis factor therapy in USA. Ann Rheum Dis. 2013; 72: 37-42. doi: 10.1136/annrheumdis-2011-200690. PMID: 22523429.
- Morimoto K, et al. Nontuberculous mycobacteriosis mortality in Japan. Kekkaku. 2011; 86: 547-52. PMID: 21735860.
- Hayashi M, et al. Prognostic factors of 634 HIV-negative patients with Mycobacterium avium complex lung disease. Am J Respir Crit Care Med. 2012; 185: 575-83. doi: 10.1164/rccm.201107-1203OC. PMID: 22199005.
- Yamakawa H, et al. Prognostic factors and radiographic outcomes of nontuberculous mycobacterial lung disease in rheumatoid arthritis. J Rheumatol. 2013; 40: 1307-15. doi: 10.3899/jrheum.121347. PMID: 23588941.
- 氏田万寿夫. 肺抗酸菌症-2 非結核性抗酸菌症. 村田喜代史, ほか監. 胸部のCT 第4版. 東京: メディカル・サイエンス・インターナショナル, 2018; 407-21.
- 岩崎龍郎. 第5章, 肺結核症の発病と進展. 改訂結核の病理. 東京: 結核予防会, 1997; 97-8.
- Okuzumi S, et al. Pulmonary Mycobacterium avium infection demonstrating unusual lobar caseous pneumonia. Respirol Case Rep. 2016; 5: 1-4. doi: 10.1002/rcr2.176. PMID: 27516892.
- Nakahara Y, et al. Nontuberculous mycobacterial lung disease accompanied by organizing pneumonia. Intern Med. 2015; 54: 945-51. doi: 10.2169/internalmedicine.54.3616. PMID 25876578.
- Waller EA, et al. The expanding spectrum of mycobacterium avium complex-associated pulmonary disease. Chest. 2006; 130: 1234–41. doi: 10.1378/chest.130.4.1234. PMID: 17035461.
- Smolen JS, et al. The role of T-lymphocytes and cytokines in rheumatoid arthritis. Scand J Rheumatol. 1996; 25: 1-4. doi: 10.3109/03009749609082660. PMID: 8774548.
- 引間高太, ほか. 生物学的製剤を使用中の関節リウマチ患者に器質化肺炎と肺MAC症を合併した1例. 日農医誌. 2017; 66: 61-4. doi: 10.2185/jjrm.66.61.
- Cari Stek, et al. The immune mechanisms of lung parenchymal damage in tuberculosis and the role of host-directed therapy. Front Microbiol. 2018; 9: 2603. doi: 10.3389/fmicb.2018.02603. PMID: 30425706.
- Critchley JA, et al. Corticosteroids for prevention of mortality in people with tuberculosis: a systematic review and meta-analysis. Lancet Infect Dis. 2013; 13: 223-37. doi: 10.1016/S1473-3099(12)70321-3. PMID: 23369413.
- Yamano Y, et al. Multidimensional improvement in connective tissue disease associated interstitial lung disease: Two courses of pulse dose methylprednisolone followed by low-dose prednisone and tacrolimus. Respirology. 2018; 23: 1041-8. doi: 10.1111/resp.13365. PMID: 30011421.