【投稿/症例報告】高用量ステロイド内服中にMRSA肺炎と
侵襲性肺アスペルギルス症を同時発症した1例

島津葉月*,覺野重毅*,澤 信彦*,小原由子**
,西島正剛*,大谷賢一郎*,紙森隆雄*
*淀川キリスト教病院呼吸器内科(〒533-0024 大阪府大阪市東淀川区柴島1-7-50)
**育和会記念病院呼吸器内科
A case of concurrent onset of methicillin-resistant Staphylococcus aureus pneumonia and invasive pulmonary Aspergillosis with high-dose oral steroid
Hatsuki Shimazu*, Shigeki Kakuno*, Nobuhiko Sawa*, Yuko Ohara**, Masayoshi Nishijima*, Kenichiro Otani*, Takao Kamimori*
*Department of Respiratory Medicine, Yodogawa Christian Hospital, Osaka
**Department of Respiratory Medicine, Ikuwakai Memorial Hospital
Keywords:MRSA肺炎,侵襲性肺アスペルギルス症/MRSA pneumonia, invasive pulmonary Aspergillosis
呼吸臨床 2022年6巻8号 論文No. e00153
Jpn Open J Respir Med 2022 Vol. 6 No. 8 Article No.e00153
DOI: 10.24557/kokyurinsho.6.e00153
受付日:2022年5月31日
掲載日:2022年8月8日
©️Hatsuki Shimazu, et al. 本論文はクリエイティブ・コモンズ・ライセンスに準拠し,CC-BY-SA(原作者のクレジット[氏名,作品タイトルなど]を表示し,改変した場合には元の作品と同じCCライセンス[このライセンス]で公開することを主な条件に,営利目的での二次利用も許可されるCCライセンス)のライセンシングとなります。詳しくはクリエイティブ・コモンズ・ジャパンのサイト(https://creativecommons.jp/)をご覧ください。
症例は77歳男性。尋常性天疱瘡に対して1カ月前からプレドニゾロン30mg/日内服中。発熱,倦怠感を主訴に来院し,胸部CTで右上葉浸潤影と両肺多発空洞性陰影を認めた。喀痰培養でMethicillin-resistant
Staphylococcus aureus(MRSA),
Aspergillus fumigatus,
A. terreusを検出し,β-Dグルカン上昇も併せて,MRSA肺炎と侵襲性肺アスペルギルス症の同時発症と診断した。易感染性宿主で空洞性病変を認めた場合は細菌や真菌などを含め重複感染を考慮する必要がある。
空洞性陰影の原因は様々であり,鑑別診断には患者背景や発症経過も考慮する必要がある。発症後12週未満の急性から亜急性の場合,細菌感染や真菌感染による膿瘍,壊死性肺炎,敗血症性塞栓などが考えられる[1]。また,易感染性宿主における感染症では原因微生物は1種類とは限らず,複数の病態が混在している可能性がある。我々は尋常性天疱瘡に対してステロイド内服中の担癌患者が菌血症を伴うMRSA肺炎と侵襲性肺アスペルギルス症(invasive pulmonary Aspergillosis:IPA)を併発したが,早期の診断治療を行い奏効した1例を経験したので報告する。
症例:77歳,男性。
主訴:発熱,倦怠感。
現病歴:2年前から前立腺癌に対してビカルタミド80mg/日を内服中。2カ月前に全身に緊満性の水疱が出現し,尋常性天疱瘡の診断となり,1カ月前からプレドニゾロン30mg/日の内服を開始した.来院2日前から38℃の発熱があり呼吸困難を認めたため当院救急外来を受診した。
併存症:75歳;前立腺癌,77歳;尋常性天疱瘡,発症時期不明;2型糖尿病。
生活歴:喫煙60本/日×30年。
内服歴:プレドニゾロン30mg/日,リナグリプチン15mg/日,ビカルタミド80mg/日。
入院時身体所見:身長157.6cm,体重61kg,BMI 24.6kg/m2,体温37.5℃,血圧107/73mmHg,心拍数111/分・整,呼吸回数24回/分,経皮的動脈血酸素飽和度97%(室内気),意識はGlasgow Coma Scale(GCS)E2V3M5,胸部聴診で右上肺野吸気終末にcoarse cracklesを聴取した。口唇・体幹に緊満性の水疱を認め,一部は破綻し,びらん形成していた。
入院時検査所見(表1):白血球数は増加し,CRP,β-Dグルカンが高値であった。IgGが低値で,アスペルギルス抗原が陽性であった。喀痰培養検査でMRSA,A. fumigatus,A. terreusを検出した。血液培養検査でも2セットともにMRSAが同定された。
入院時画像所見(図1):胸部単純CTで右上葉に浸潤影と両側多発空洞性陰影と左下葉に結節性病変を認めた。
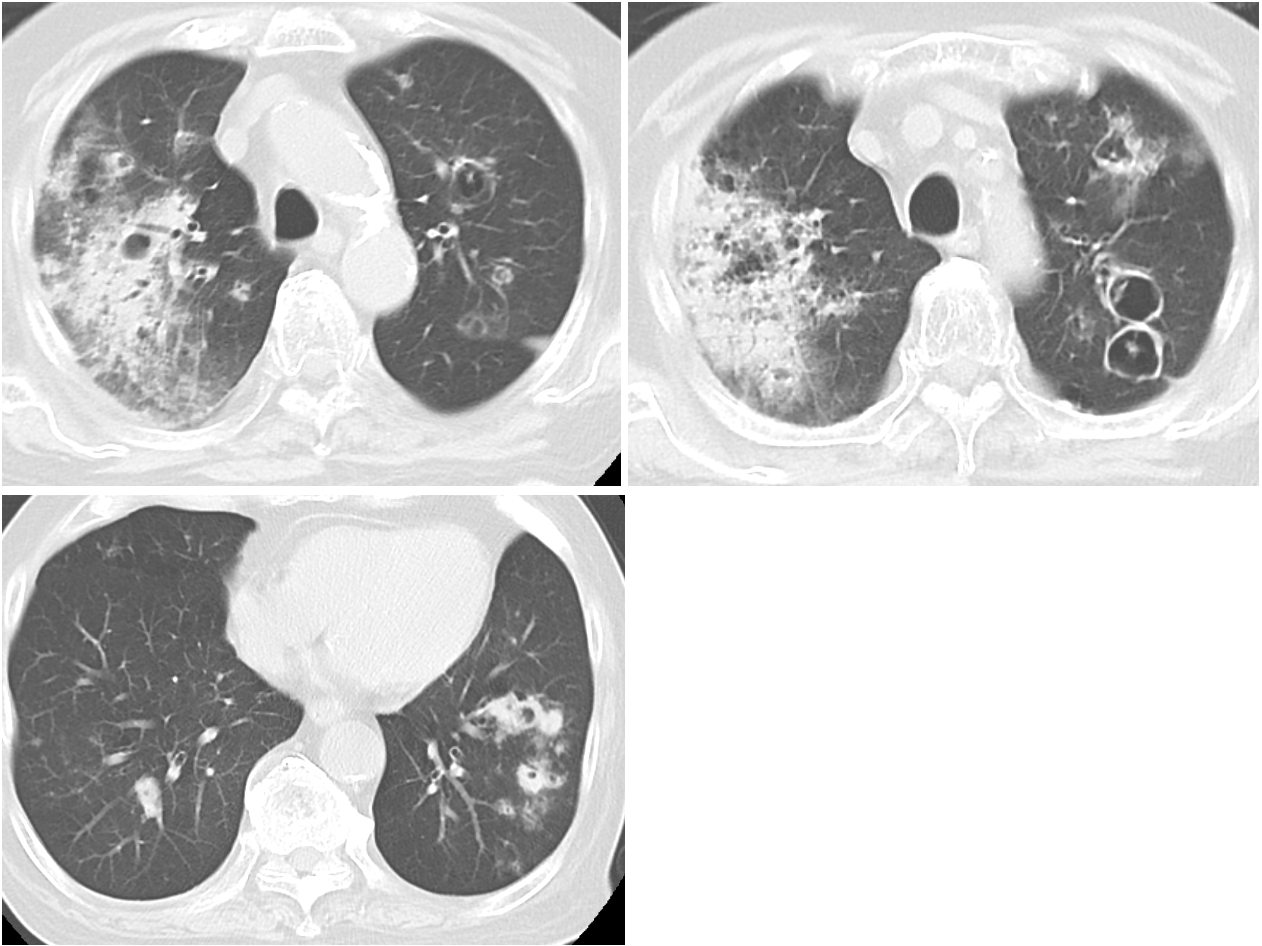 図1 入院時胸部CT所見
図1 入院時胸部CT所見
入院後経過(図2):受診時quick sequential organ failure assessment(SOFA)スコアは2点であり敗血症の状態を呈していると考えられ,タゾバクタム/ピペラシン(tazobactam/piperacillin:TAZ/PIPC)13.5g/日点滴静注を開始した。第2病日に喀痰検査からMRSAと糸状菌,血液培養検査からMRSAを検出した。空洞性陰影と喀痰,血液培養の結果からMRSA肺炎と診断し,第2病日にバンコマイシン(vancomycin:VCM)1500mg/日点滴静注を開始した。
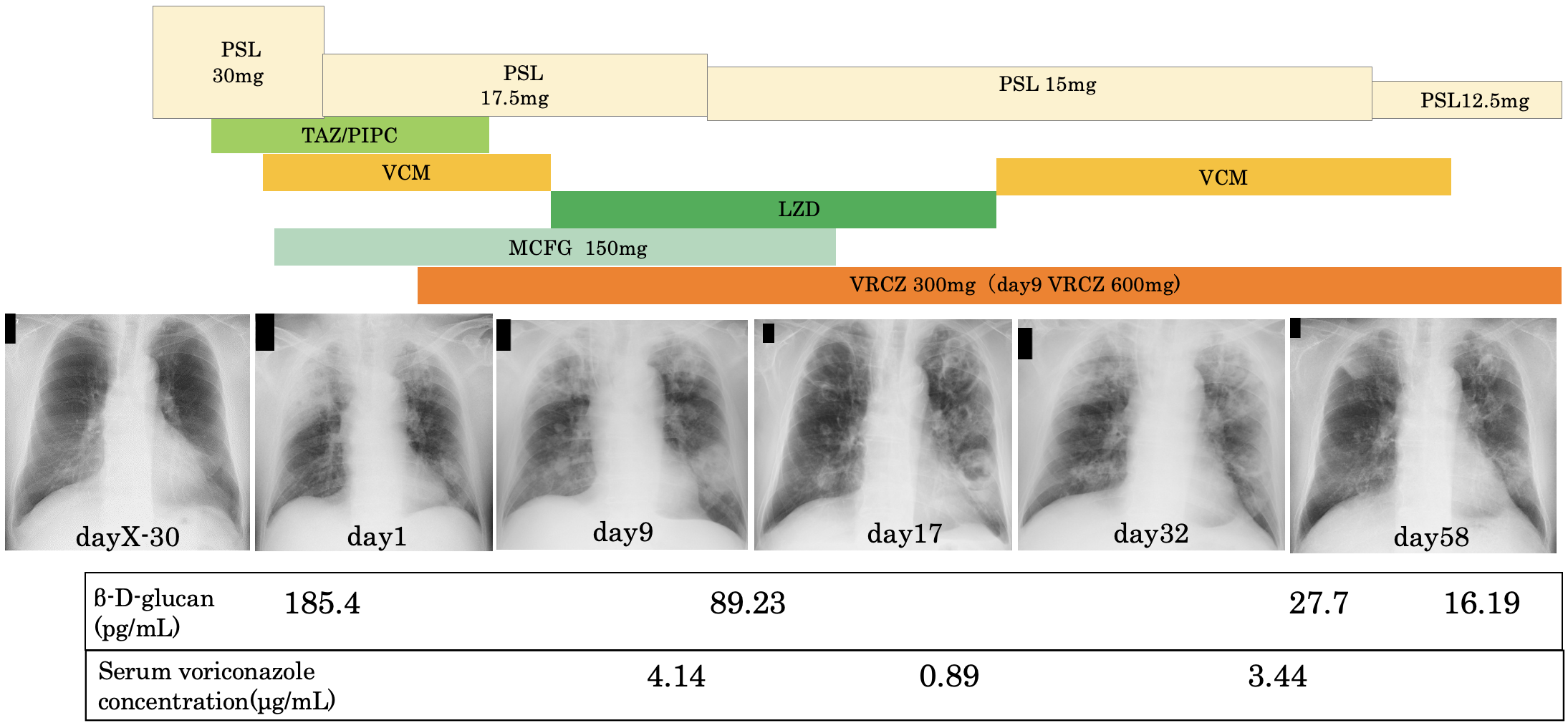
図2 入院後経過
プレドニゾロン開始前の胸部単純X線所見は正常であった。入院時胸部単純X線で多発空洞性病変を認め,治療後一時的に陰影は悪化したが治療継続により軽快した。
糸状菌について,β-D-グルカンの上昇からアスペルギルスなど真菌感染の合併が疑われ,同日ミカファンギン(micafungin:MCFG)150mg/日点滴静注を開始した。また,肺結核や悪性腫瘍の鑑別のため,第4病日に右B2bに対して経気管支生検と気管支洗浄を行い,気管・気管支粘膜に明らかな異常所見は認めず,気管支洗浄液からMRSAが検出されたが,糸状菌は検出されなかった。病理組織検査では,強い好中球浸潤とフィブリン沈着を認めた。第9病日にアスペルギルス属を疑う糸状菌と判明し,アスペルギルス抗原が陽性であったことからEORTC/MSGによるinvasive fungal diseaseの診断基準[2]でprobable fungal diseaseを満たしたためIPAを合併していると臨床診断した。IPAの初期治療としてMCFGとボリコナゾール(voriconazole:VRCZ)併用療法を選択し,VRCZを第9病日に600mg/日,第10病日以降300mg/日投与した。第13病日に血液培養が陰性であり,肺への移行性を優先し,VCMからリネゾリド(linezolid:LZD)1.2g/日に変更した。入院時にみられた皮膚の水疱形成,びらんは改善しており,プレドニゾロンを同日から漸減した。大阪市立大学臨床感染制御学に糸状菌の同定と感受性検査を依頼し,A. fumigatus,A. terreusの2菌種が同定され,両菌種ともVRCZの感受性は良好であった。VRCZの血中濃度も安定していたため第17病日にMCFGを中止した。第28病日に血小板数10.3万/µLと低下し,LZDによる副作用と考え,VCMに再度変更した。血液培養陰性確認から6週以上経過しており,全身状態も改善したため第58病日にVCMを終了した。外来でVRCZを継続する方針となり,第59病日に退院となった。
黄色ブドウ球菌による肺炎は,組織の破壊による空洞や化膿病巣,膿胸などの壊死性病変がみられることが多く[3],壊死性肺炎を呈する病原因子の1つとしてPanton-Valentine leukocidin(PVL)産生が関与しているとされている[4][5]。日本国内でPVL産生株は少ないとされていたが,近年,日本でも増加傾向とする報告がみられ[6]〜[9]ている。本症例は検索していなかったが,空洞性陰影の鑑別にPVL産生株のMRSA肺炎を留意する必要がある。空洞形成の機序は,経気道的に壊死性肺炎を起こす場合と,菌血症から敗血症性肺塞栓として肺に多発病巣を作る場合がある。本症例は,両側びまん性に空洞性陰影が見られたこと,皮膚病変があったことから,皮膚を侵入門戸としてMRSA菌血症を発症し,敗血症性肺塞栓の病型として多発空洞性陰影を呈したと考えた。
MRSA肺炎の治療はVCM,LZD,テイコプラニン(teicoplanin:TEIC)が推奨され,また,MRSA菌血症の場合,VCMとダプトマイシン(daptomycin:DAP)が推奨されている[10]。本症例では菌血症を伴うMRSA肺炎として当初VCMによる治療を行い,血液培養の陰性を確認した後に内服への切り替えも念頭にVCMと同程度の推奨であるLZDに変更した。しかし,血小板減少が生じたためVCMに再度変更し治療を行った。病態や副作用の状況に合わせて,MRSA感染症の治療を行うことが重要である。
アスペルギルスの感染防御の中心は好中球であり,好中球減少はリスク因子の代表である。好中球減少の程度および減少期間を同時に表す指標としてD-indexが知られている[11]。D-indexは好中球減少期間における好中球数をプロットして描かれたカーブと好中球500/μLで水平に引いた直線で囲まれた面積と定義され,好中球減少の程度が強く,持続時間が長いほどD-indexは高値を示す。感染症発症までの累積のD-indexとしてcumulative D-index(c-D-index)も提唱されている。c-D-indexはD-indexをリアルタイムに評価することができ,IPAの高リスク患者の感染症の発症に高い陰性適中率を有する[12]。そのため,c-D-indexが5500未満であれば発熱など症状だけで先行治療を行うのではなく,画像検査や血液検査などで真菌症を疑う所見があった場合に抗真菌薬を開始することが提案される。
またIPAの画像所見はHalo signが代表的であるが,宿主の免疫状態などにより多彩な画像を呈することも知られている[13]。
c-D-indexの程度によってみられる画像所見にも有意差があり,c-D-index≧5500の場合は血管侵襲型の頻度が高く,c-D-indexが0の場合は気道侵襲型の頻度が高いと報告されている[14]。
本症例はプレドニゾロン内服開始時である,入院30日前の好中球数が7,032/μL,入院時が7,051/μL,入院後も好中球数の減少は認められなかった。画像所見は左下葉に結節影と周囲にわずかにすりガラス影を認めるものの,典型的なhalo signではなく,右上葉の肺炎類似像と多発の空洞性陰影が主であり,気道侵襲性型に近いと考えられた。
一方でこれらc-D-indexの報告は造血幹細胞移植患者や,血液腫瘍患者に対する報告であり,ステロイド内服下では,末梢血中の好中球数は増加するため,D-index,c-D-indexともに参考にできない可能性はある。ステロイド内服下でのIPA患者では,コントロール不良な悪性腫瘍やハイリスクの化学療法などその他のリスク因子も考慮した上で画像所見や血清検査で疑われた場合に抗真菌薬を先行して投与する必要があると考えられた。
IPAの確定診断には無菌検体による培養検査,病理検査での糸状菌の確認が有用である。本症例は,気管支鏡検査を施行したが下気道検体からは糸状菌が検出されなかった。原因として,まず検査がMCFG治療開始後であったことを考えた。
また,S. aureusとA. fumigatusの共培養下ではS. aureusがA. fumigatusに接合することで分生子を構造変化させ,菌糸の成長を制限し,拮抗的相互作用をきたすと報告されており[15][16],本症例においても,気管支鏡検査を行った部位ではA. fumigatusがS. aureusの共存下で発育できず,同定されなかった可能性も考えられた。本症例は多発空洞性病変であり,検査を行った右上葉以外の部位にも繰り返し生検を行うことがIPAの診断に有用であったと考えられた。
IPAの治療の第一選択薬はVRCZである。しかし,同種移植患者を対象に,VRCZ単剤群と比較して,VRCZにキャンディン系薬剤を併用した群が治療効果を示した報告があり[17],本症例においても免疫抑制状況であると考え初期治療としてVRCZ+MCFGの併用療法を行った。
空洞性病変を呈する病変は感染症以外にも,悪性腫瘍,好酸球性多発血管炎性肉芽腫症(granulomatosis with polyangiitis:GPA)といった自己免疫性疾患も鑑別に挙げられる。特にGPAでは両側・びまん性に薄壁・厚壁問わない空洞性病変や,結節周囲にすりガラス影を呈するhalo signを呈する[18]。本症例は気管支鏡検査所見で小動静脈の有意な壊死性血管炎所見を認めず,またGPAの皮膚所見は紫斑・出血斑,皮下結節が主であり[19],本症例の緊満性水疱とは一致しなかった。しかし,GPAの空洞性陰影は気管支鏡検査のみでの診断は難しいとされている。両側肺腫瘤影に対し経気管支肺胞生検とCTガイド下肺生検を施行するも診断がつかず,発症から2カ月後に再度の経気管支肺胞生検で診断した1例も報告されている[20]。本症例では早期からの抗菌薬・抗真菌薬が奏功したため測定していなかったが,鑑別のため当初からPR3-ANCAを測定しておく意義があったと考えられた。
MRSA肺炎の危険因子にはMRSA保菌や感染症の既往,繰り返す皮膚感染症,重症肺炎患者がある。一方,IPAは臓器移植後などの免疫不全宿主に多いとされていたが,他疾患におけるステロイド大量投与や生物学的製剤投与,慢性閉塞性肺疾患などでも発症する[21]。本症例は重喫煙歴,尋常性天疱瘡で皮膚からの感染リスクが高く,前立腺癌があり,またプレドニゾロン内服による細胞性免疫の低下,IgGが460mg/dLと液性免疫低下を認め,2型糖尿病など複数の危険因子を抱えていることが同時発症に寄与したと考えられた。
MRSA肺炎,IPAはいずれも易感染性宿主で発症リスクが高く,空洞性陰影を呈するが,本症例のように複数の危険因子をもつ場合は,併発している可能性を考える必要がある。また,喀痰検査,血清マーカーに加え,状態に応じて気管支鏡検査を行い,早期に診断,治療を行うことが重要である。
謝辞:本症例の糸状菌の同定・感受性検査にご協力いただきました,大阪公立大学医学部附属病院感染制御部臨床検査技師の仁木誠先生,大阪公立大学大学院医学研究科臨床感染制御学の掛屋弘教授に深謝いたします。
利益相反:開示すべき利益相反はない。
We would like to describe the case of 77 year-old patient with the diagnosis of pemphigus vulgaris in one month ago and had been received prednisolone 30mg per day since then. When he felt fever and fatigue, he admitted our department. His chest computed tomography (CT) revealed a consolidation in his right upper lobe and multiple cavitary shadows in his bilateral lungs. Sputum culture indicated existence of methicillin-resistant
Staphylococcus aureus (MRSA),
Aspergillus fumigatus and
Aspergillus terreus. We diagnosed as a concurrent onset of MRSA pneumonia and invasive pulmonary aspergillosis in conjunction with high β-D glucan level in serology test. Coinfection of bacteria and fungus can be a possible diagnosis when immunocompromised host presents with a cavity lesion.
- Khalid G, et al. Cavitary lung diseases. A clinical-radiologic algorithmic approach. Chest. 2018; 153: 1443-65.
- De Pauw B, et al. Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study group (EORTC/MSG) Consensus Group. Clin Infect Dis. 2008; 46: 1813-21.
- Gillet Y, et al. Association between Staphylococcus aureus strains carrying gene for Panton-Valentine leucocidin and highly lethal necrotizing pneumonia in young immunocompetent patients. Lancet. 2002; 359: 753-9.
- 山崎 修. Panton-Valentine leucocidin(PVL). 岡山医会誌 2007; 119: 87-9.
- Funaki T, et al. SCCmec typing of PVL-positive community-acquired Staphylococcus aureus (CA-MRSA) at a Japanese hospital. Heliyon. 2019; 5: e01415.
- Yamaguchi T, et al. Molecular characterization of community associated methicillin-resistant Staphylococcus aureus isolated from skin and pus samples of outpatients in Japan. Microb Drug Resist. 2015; 21: 441-7.
- Mine Y, et al. Nosocomial outbreak of multidrug-resistant USA300 methicillin-resistant Staphylococcus aureus causing severe furuncles and carbuncles in Japan. J Dermatol 2011; 38: 1167-71.
- Uehara Y, et al. Molecular epidemiologic study of community-associated methicillin-resistant Staphylococcus aureus with Panton-Valentine leukocidin gene among family members in Japan. J Infect Chemother. 2015; 21: 700-2.
- Kawaguchiya M, et al. Genetic diversity of emerging Panton-Valentine leukocidine/arginine catabolic mobile element (ACME)-positive ST8 SCCmec-Iva methicillin-resistant Staphylococcus aureus (MRSA) strains and ACME-positive CC5 (ST5/ST764) MRSA strains in Northern Japan. J Med Microbiol. 2013; 62: 1852-63.
- Fowler VG, et al. Daptomycin versus standard therapy for bacteremia and endocarditis caused by Staphylococcus aureus. N Engl J Med. 2006; 355: 653-65.
- Portugal RD, et al. Index to predict invasive mold infection in high-risk neutropenic patients based on the area over the neutrophil curve. J clin Oncol. 2009; 27: 3849-54.
- Kimura S, et al. Retrospective evaluation of the area over the neutronphil curve index to predict early infection in hematopoietic stem cell transplantation recipients. Biol Blood Marrow Transplant. 2010: 16: 1355-61
- 堀之内秀仁,ほか. 肺炎類似の画像所見を呈した侵襲性肺アスペルギルス症の2剖検例. 日呼吸会誌 2009; 47: 786-92.
- Yanagawa N, et al. CT of invasive pulmonary aspergillosis (IPA) in cases with hematologic malignancy: Comparison of CT features in the group classified by the severity of neutropenia and underlying disease. Eur J Radiol. 2020; 131: 109042.
- Margalit A, et al. Bacterial interactions with Aspergillus fumigatus in the immunocompromised lung. Microorganisms. 2021; 19: 435.
- Granillo AR, et al. Antibiosis interaction of Staphylococcus aureus on Aspergillus fumigatus assessed in vitro by mixed biofilm formation. BMC Microbiology. 2015; 15: 33.
- Marr KA, et al. Combination antifungal therapy for invasive aspergillosis: a randomized trial. Ann Intern Med. 2015; 162: 81-9.
- Guzman-Soto MI, et al. From head to toe: granulomatosis with polyangiitis. Radiographics. 2021; 41: 1973-91.
- 黒沢美智子,ほか. 難治性血管炎(ウェゲナー肉芽腫症)の H16年度臨床調査個人票電子化データの分析. 難治性血管炎に関する調査研究平成17年度総括・分担 調査報告書. 2005: 124-50(レベル V).
- Asano T, et al. Difficulty in the clinical diagnosis of granulomatosis with polyangiitis: a case report. J Jpn Soc Respir Endoscopy. 2017; 39: 525-9.
- Walsh TJ, et al. Treatment of aspergillosis: clinical practice guidelines of the Infectious Diseases Society of America. Clin Infect Dis. 2008; 46: 327-60.

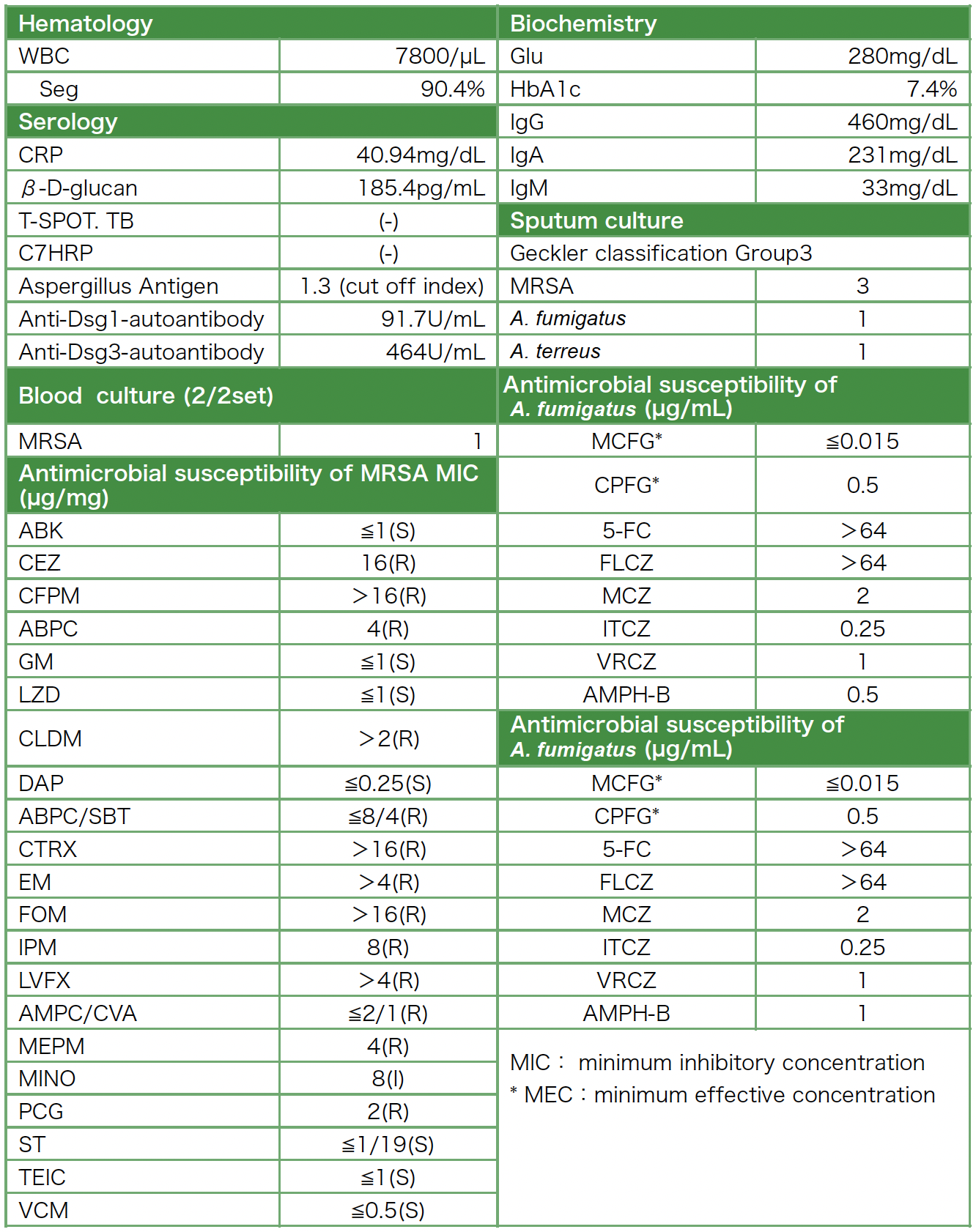
 図1 入院時胸部CT所見
図1 入院時胸部CT所見