徳田 均*
*JCHO東京山手メディカルセンター呼吸器内科(〒169-0073 東京都新宿区百人町3-22-1)
Bronchiectasis revisited(3)
Hitoshi Tokuda*
*Department of Respiratory Medicine, Tokyo Yamate Medical Center, Japan Community Health Care Organization (JCHO), Tokyo
Keywords:気管支拡張症,関節リウマチ,潰瘍性大腸炎,/bronchiectasis,rheumatoid arthritis,ulcerative colitis
呼吸臨床 2018年2巻2号 論文No.e00030
Jpn Open J Respir Med 2018 Vol. 2 No. 2 Article No.e00030
DOI: 10.24557/kokyurinsho.2.e00030
受付日:2017年12月14日
掲載日:2018年2月13日
©️Hitoshi Tokuda. 本論文の複製権,翻訳権,上映権,譲渡権,貸与権,公衆送信権(送信可能化権を含む)は弊社に帰属し,それらの利用ならびに許諾等の管理は弊社が行います。
RA患者に高率に気道病変が合併することは以前より知られていた。RA患者の肺をHRCTで精細に調べる研究は20年ほど前から始まっており,その多くが非常に高い率でのBEの合併を報告している[1]。しかしこのBE,そしてより末梢の気道病変を併せてのRAの気道病変の,RAという疾患の臨床経過における意義については,ようやく近年になって議論されるようになった[2]。現在,RAのBEは,関節に主座は置きつつ全身性に展開するRAという免疫異常疾患の関節外病変であり,RA患者特有の過剰な免疫応答が気道において現れたもの,との理解が広まりつつある。またこれらはRA患者の予後に深刻な影響を及ぼすことについても,ようやく認識が深まりつつある。筆者は別にこの主題につき解説したので,詳細はそちらを参照されたい[1][2]。ここでは概略のみを説明する。
1.疫学
近年行われた比較的大規模な前向き研究を表1に示した。いずれも30〜40%と非常に高い合併頻度を報告している。RA患者の3人に1人はBEを有するというこの数字はなかなか臨床家には受け入れ難いかも知れない。しかしRAのBEは自覚症状を訴えることが非常に少ないこと,またBEは胸部単純写真では検出されず,正確な診断はHRCTによるしかないことは国際的なコンセンサスとなっている[3]。
表1 HRCTを用いて調べたRA患者におけるBEの頻度(前向き研究)
§65例で1年以内(表中で0と表記),61例で1年以上
2.画像
RA患者のBEの多くは,両肺野,複数葉にまたがって分布するびまん性BEの像を呈する(図1a)。周囲に必ずしも肺の炎症性虚脱を伴うわけではなく,また壁の肥厚も比較的軽微な例が多く,単純X線写真では認識し難いのはおそらくこれらの理由による。末梢気道病変,すなわち細気管支炎も高頻度にみられる(図1b,c)。しばしば,主軸気管支のみならずその周囲に多数の拡張気管支,あるいは嚢胞様所見を見ることがある(図2)。これらは分枝,あるいは反回枝にも炎症,拡張が起こっているためと解釈される。
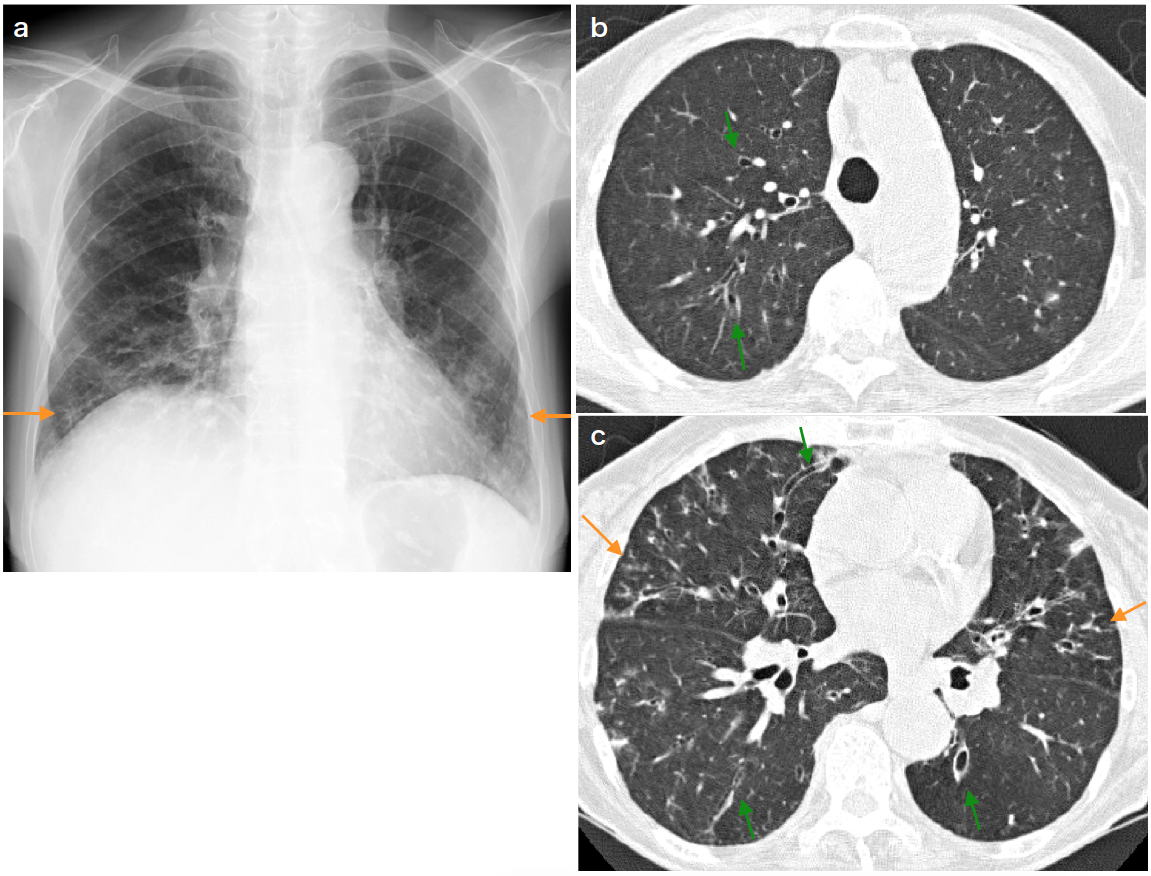
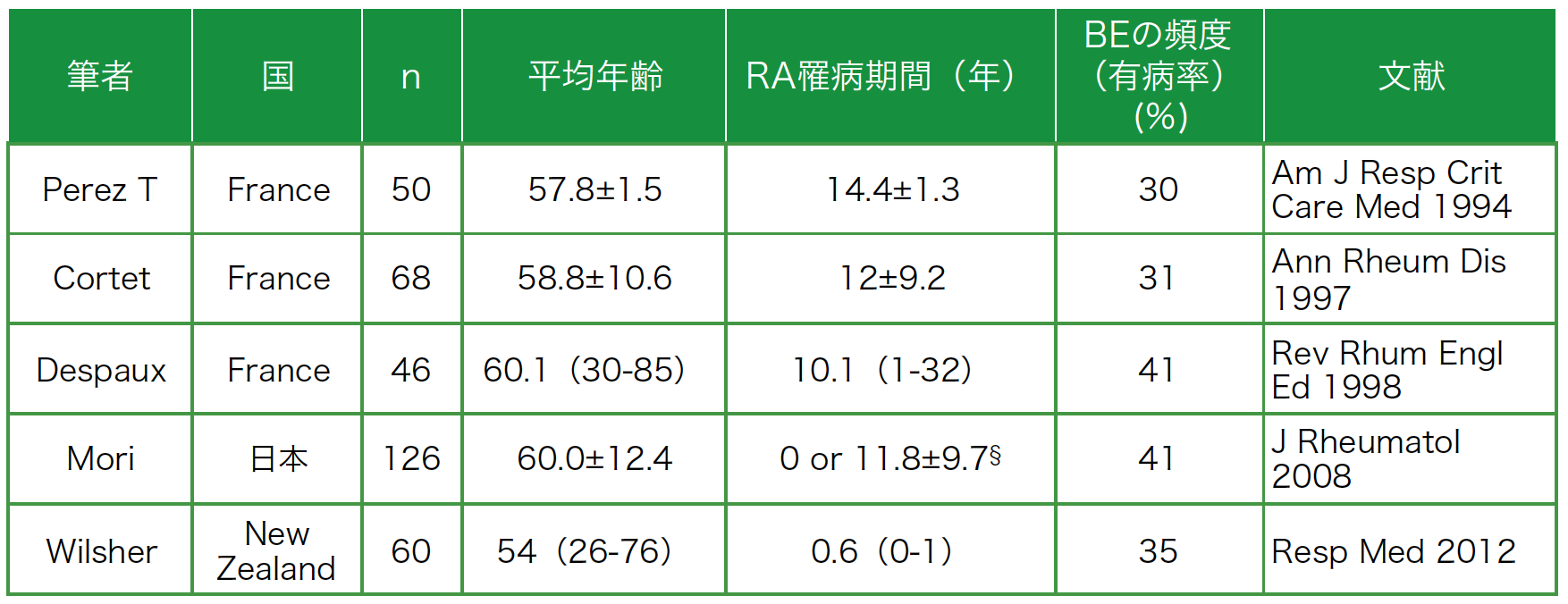
図1 びまん性BE:76歳,女性,RA
a.胸部単純写真:両側下肺野に索状影,粒状影が多発している(→)。
b,c.HRCT:全肺野に気管支拡張が認められる(→)。びまん性BEである。細気管支炎を示唆する分岐状影も多数認められる(→)。
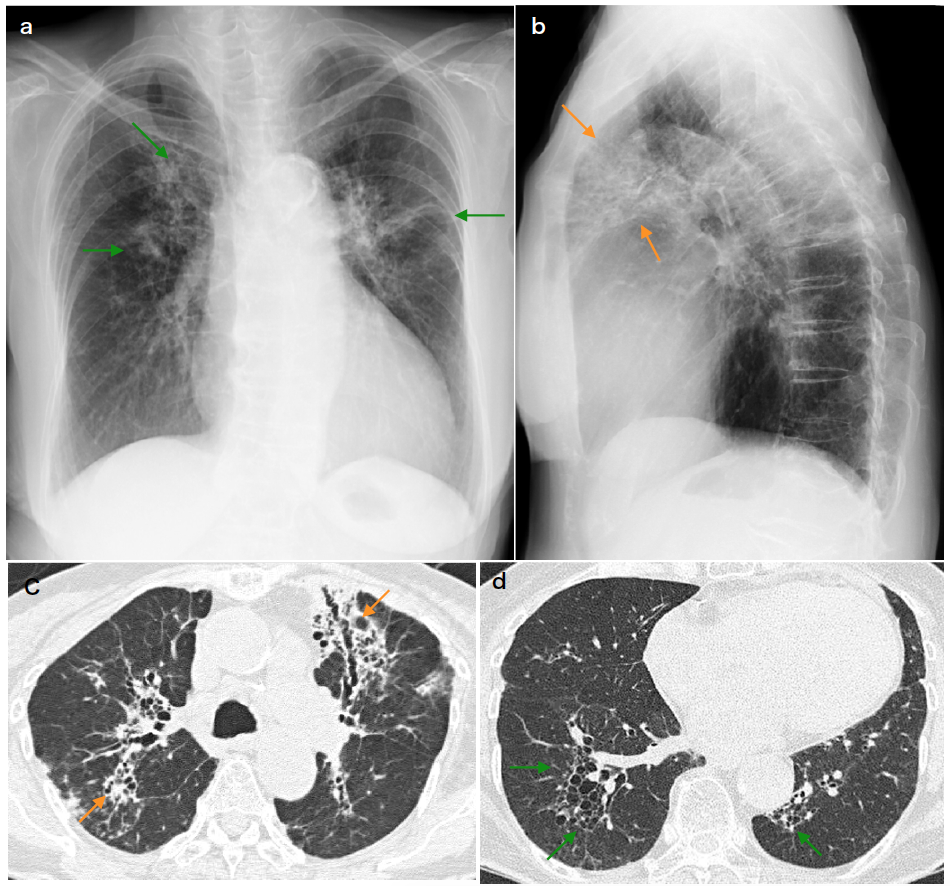
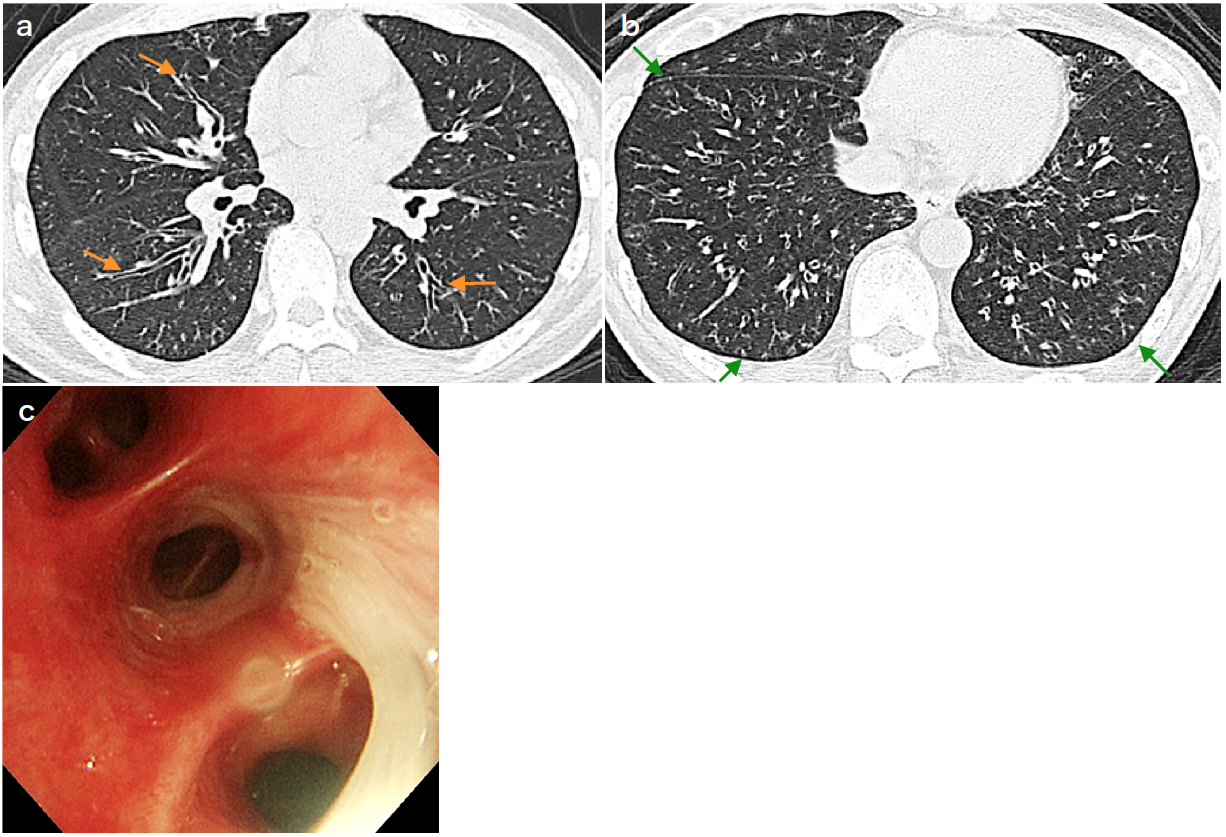
図2 著しい嚢胞形成を伴う気道病変:81歳,女性,RA
a,b.胸部単純写真(正,側):両側肺門から放射状に浸潤影が広がる(→)。側面で区域性分布が確認できる(→)。
c,d.主軸気管支の周囲の浸潤影中に透亮像が多発している(→)。一部では泡沫状にさえ見える(→)。全て拡張した気管支である。主軸枝からの分枝,反回枝も炎症性の拡張を起こしていると考えられる。
3.成り立ち
第1部で述べたように,一般にBEは,何らかの契機(多くは強い炎症)で気管支に脆弱部分が成立すると,そこに細菌の定着が起こり,それに対する過剰な免疫応答,炎症が持続し,気管支の構造改変が進行,さらに粘液の過剰分泌,クリアランス能の低下なども加わって細菌の定着が助長されそれが更に炎症を促進する,という悪性サイクルで説明される[4]。しかしRAのBE患者では小児期の重い肺炎のエピソードなどは通常確認されず,さしたる呼吸器症状もないまま,CTにて発見されたときには広範なBEの像を呈している。そもそもBEにみられる緑膿菌,インフルエンザ菌などは最近のマイクロバイオーム研究で健常人の下気道にも常在していることが明らかとなっており[5],なぜ一部の宿主,特にRAなどの宿主でこれに対する強い免疫応答が起こってしまうのかについては,特別な説明が必要である。RAの患者に絞って気道炎症を実証的に検討した研究は乏しいが,近年,RA,およびBEにおいて,それぞれIL-17系の亢進が報告されており,病態的に共通点がみられる[4]。また,最近のマイクロバイオーム研究の進歩の中で,BEにおいて下気道のマイクロバイオームの乱れが観察され,原因なのか結果なのかは未解決であるが,持続性炎症の成り立ちとの密接な関係が考察されている[6]。また腸管のマイクロバイオームの乱れ(dysbiosis)と気道の炎症との関連も議論されている。腸管のマイクロバイオームの乱れはまたRAの発症とも関連するとの報告も相次いでいる。これらを踏まえ,Boytonらは,RAなどの全身性炎症性疾患におけるBEの成り立ちには,何らかの遺伝的素因の関与も認めつつ,気道あるいは腸管のマイクロバイオームの乱れが宿主の免疫応答の大きな乱れを起こし(dysregulation),IL-17を介した好中球性の炎症が持続するとの可能性に言及している[4]。実証的な検討が待たれるところである。
一方,RAという疾患の発症にBEが関わる,すなわちRAの始原としてまずBE(を含む慢性下気道感染症)を場とした免疫応答があり,その結果として抗CCP抗体などの自己抗体の形成がみられ,これがRAの発症につながるとの説が欧米でにわかに台頭し,注目が集まっている[7]。非常に興味深い方向性で,今後の発展が期待される。私見では,RAに合併するBEの少なくとも一部はRA発症にはるかに先行しており(図3),病因論的に関わっている可能性はありうる。しかしそれはごく一部と考えている。
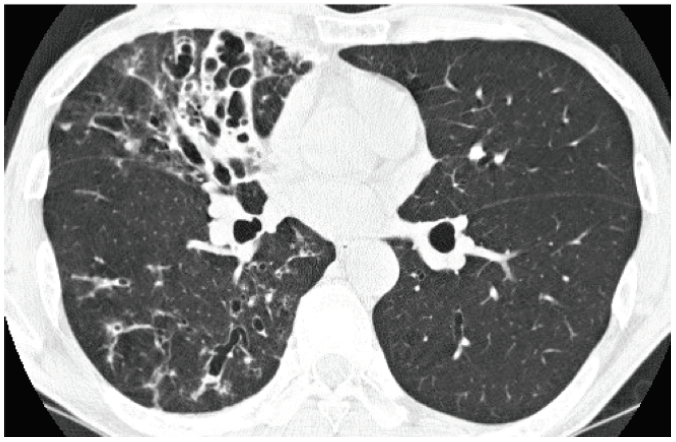
図3 気管支拡張症が先行:55歳,男性,RA
4カ月前にRAと診断された。以前から健診の度に胸部に異常影ありと言われている。小児期より風邪をこじらせやすかった。少なくとも10年以上前からBEがあったと推定される。先行する慢性下気道がRAの発生に関与した可能性を示唆する症例。
4.RA患者の生命予後におけるBEの意義
1)細菌感染症の母地となり,不良な予後をもたらす
細菌性肺炎を発症したRA患者の80%以上にCTにて気管支拡張症などの基礎病変が見られるとの報告がある(図4)[8]。RA患者は細菌性肺炎の罹患リスクが一般宿主の2倍とされるが[9],これはそのような事情が関わっているものと推察される。またBEを合併したRA患者の予後は極めて不良であり,死因は主に肺感染症とされる[10]。これらはやはり気道病変の存在と関連しており,RA患者の不良な予後の一部はこれで説明される。
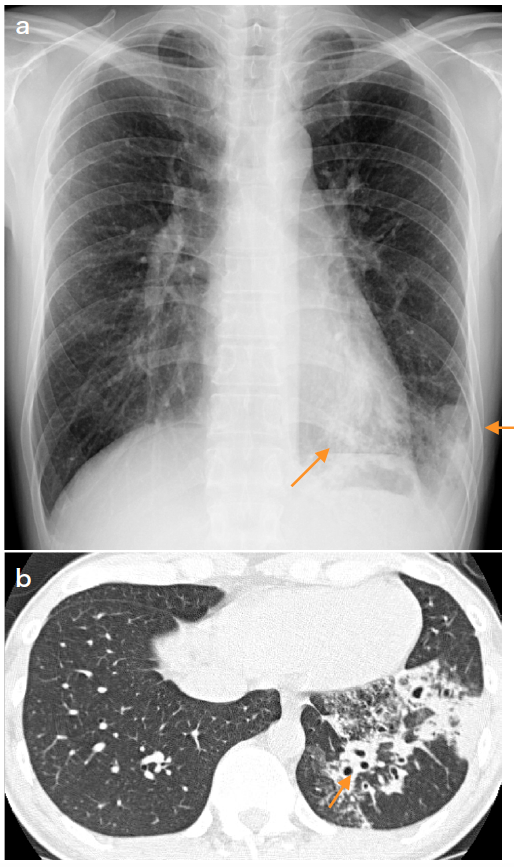
図4 RA患者に見られた左下葉の肺炎:42歳,男性
a.高熱,咳,痰など,典型的な肺炎の症状で受診した。左下肺野に斑状の浸潤影がみられる(→)。
b.HRCT:浸潤影の中に拡張した気管支がみられる。RA患者の細菌性肺炎では非常に高率にその基礎疾患として気管支拡張症がみられる。
2)非結核性抗酸菌症の母地となる
米国の大規模な疫学的研究でRA患者は一般人に比しNTM症の罹患リスクが2倍,そこに生物学的製剤が投与された場合10倍になるとされる[11]。わが国でも生物学的製剤投与下に異常に高い頻度でNTM症が発症し,問題となっている。これらの高い頻度は,RA患者における気道病変などの既存肺疾患がもたらしたものと推定される[12]。予後であるが,MAC症に限るとわが国では死亡例は報告されていない。しかし治療困難な病態であり,死亡は長期間経過後に生じるので,注意は必要である。なお,生物学的製剤投与下に発症したMAC症は適切に対応すれば治療は困難ではないとの報告がある[12]。
3)閉塞性肺障害を起こし不良な予後をもたらす
一般宿主のBEにおいても進行すると末梢気道の閉塞が進行し重大な問題となることは,第1部,第2部でも述べてきたが,RA患者においてこのパターンが特に強くみられることを初めて実証的に見出したのはNanniniらの研究である。信頼性に定評のあるRochester epidemiology projectの一つとして行われたpopulation basedかつ長期間の縦断的観察において,RA患者は一般人に比し,閉塞性肺疾患を生じやすいこと(ハザード比1.54),そしてひとたび発症した場合の死亡リスクは2倍である事が報告された[13]。
5.末梢性気管支拡張とRA関連の間質性肺炎(RA-ILD)(特にUIPパターン)
MTX,生物学的製剤などの新世代治療の導入により,RA患者の予後は改善しているが,これは主にこれら治療により関節外病変の減少がもたらしたものである。しかしRA-ILD(rheumatoid arthritis associated interstitial lung disease)は例外で,今なお増加傾向にあり,大きな問題となっている[14]。RA-ILDの中でUIPパターンを呈する例は予後不良であると言われてきたが,その理由は解明されておらず,そもそもRA-UIPの成立機序,過程についてもこれまでほとんど研究がなかった。われわれは肺炎を繰り返す中から気管支拡張症が新たに出現,その後も炎症のコントロールに難渋している内に胸膜に沿って蜂窩肺様構造を呈した1例を報告した[15]。病理学的解析によれば,胸膜直下に多数形成された蜂窩肺を思わせる構造は,炎症により末梢気道(細気管支)及びその周囲の肺胞構造が破壊され形成されており,炎症性の成り立ちである事が確認された。このような機序は多くのRA-ILD(UIPパターン)の症例でHRCTの連続画像の綿密な解析や病理学的検索で確認でき(図5),私見では,RA-UIPとされる症例の半数以上においてこのような炎症性の成り立ちが想定される(未発表データ)。
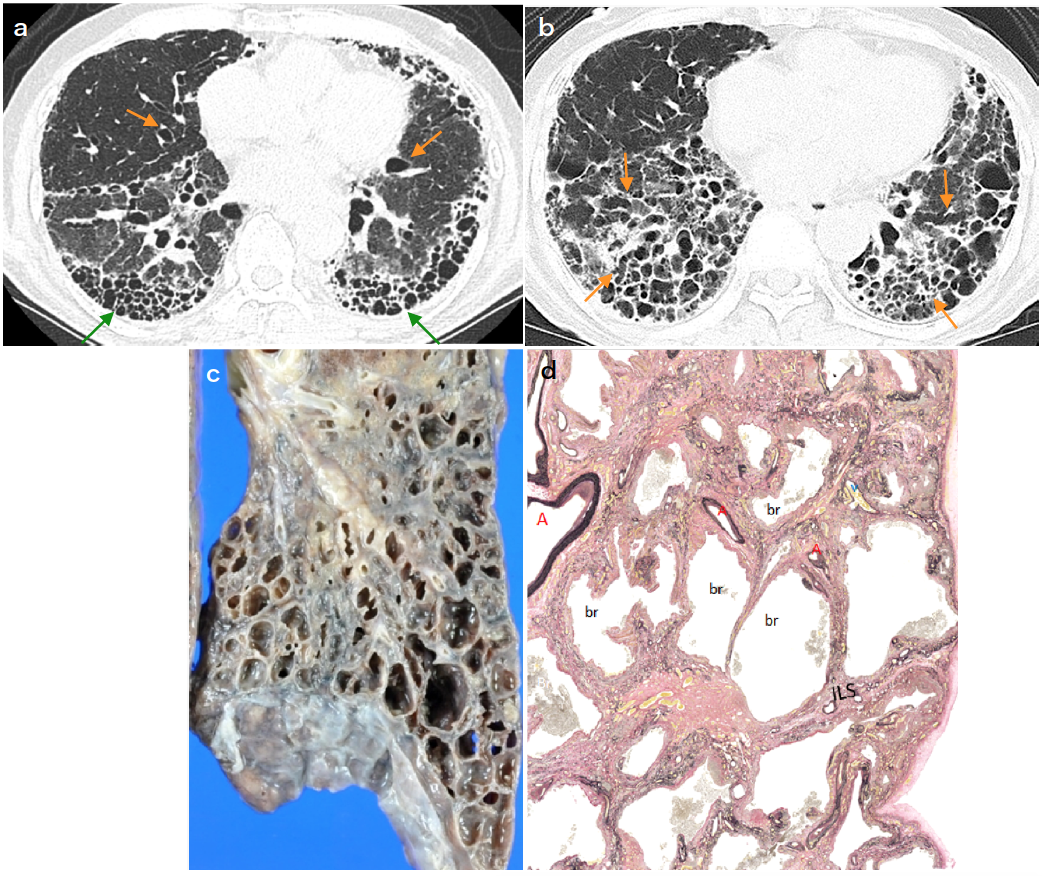
図5 一見蜂窩肺様の画像所見を呈したRA患者の肺病変:72歳,男性
a.HRCT:2年前RAを発症。主訴は咳,痰,労作時呼吸困難。両肺野の胸膜側に多数の嚢胞が密集,配列している(→)。現代のCT診断学ではUIPパターンのILDと判断される(実際10年前からIPFと診断されていた)。しかし中枢側の気管支も拡張している(→)。(国立国際医療研究センター呼吸器内科・泉信有先生ご提供)
b.5mm厚スライス:病変の空間性連続性は厚切りの方が判断しやすい。このスライスを中心とした連続画像の解析で,密集した嚢胞はその多くが拡張した気管支である事が読み取れる(→)。
c,d.剖検肺の病理所見:肺炎を繰り返し,3年の経過で肺炎と呼吸不全で死亡し,剖検が行われた。
c.マクロ病理像:下葉に多数の嚢胞が密集している。一見,IPFの蜂窩肺に似る。しかし胸膜面は平滑であることに注意。
d.弱拡病理所見:嚢胞は拡張した気管支,細気管支からなる。周囲肺と共に炎症性に破壊された結果であり,IPFの蜂窩肺とはまったく形成機序が異なる。
A:肺動脈,br:気管支,ILS:小葉間隔壁。 (×4,EVG)
(泉信有先生,武村民子先生ご提供)