【投稿/原著】進行性線維化を伴う間質性肺疾患におけるニンテダニブ投与量の違いによる安全性と有効性

丸山総一*1,*2,岡本 師*1,*3,柴田 翔*1,本多隆行*1,白井 剛*1,古澤春彦*1,立石知也*1,玉岡明洋*4,宮崎泰成*1
*1東京医科歯科大学呼吸器内科
*2練馬光が丘病院呼吸器内科(〒179-0072 東京都練馬区光が丘2-5-1)
*3東京医科歯科大学肺免疫治療学講座
*4虎の門病院呼吸器内科
Safety and effectiveness by different doses of nintedanib in progressive fibrosing interstitial lung diseases
Soichi Maruyama*1,*2, Tsukasa Okamoto*1,*3, Sho Shibata*1, Takayuki Honda*1, Tsuyoshi Shirai*1, Haruhiko Furusawa*1, Tomoya Tateishi*1, Meiyo Tamaoka*4, Yasunari Miyazaki*1
*1Department of Respiratory Medicine, Tokyo Medical and Dental University, Tokyo
*2Department of Respiratory Medicine, Nerima Hikarigaoka Hospital
*3Department of Pulmonary Immunotherapeutics, Tokyo Medical and Dental University
*4Department of Respiratory Medicine, Toranomon Hospital
Keywords:進行性線維化を伴う間質性肺疾患,間質性肺炎,ニンテダニブ/progressive fibrosing interstitial lung diseases,interstitial pneumonia,nintedanib
呼吸臨床 2023年7巻5号 論文No.e00169
Jpn Open J Respir Med 2023 Vol. 7 No. 4 Article No.e00169
DOI: 10.24557/kokyurinsho.7.e00169
受付日:2023年2月17日
掲載日:2023年4月14日
©️Soichi Maruyama, et al. 本論文はクリエイティブ・コモンズ・ライセンスに準拠し,CC-BY-SA(原作者のクレジット[氏名,作品タイトルなど]を表示し,改変した場合には元の作品と同じCCライセンス[このライセンス]で公開することを主な条件に,営利目的での二次利用も許可されるCCライセンス)のライセンシングとなります。詳しくはクリエイティブ・コモンズ・ジャパンのサイト(https://creativecommons.jp/)をご覧ください。
進行性線維化を伴う間質性肺疾患(PF-ILD)におけるニンテダニブ(NTB)200mg/日に関する報告は限られている。当院におけるPF-ILDにおいてNTBの維持量が200mg/日と300mg/日の2群に分けて後方視的検討を行った。副作用出現の割合,努力肺活量の年間減少率,急性増悪の累積発生率,3年生存率は2群間で有意差はなかった。本検討で安全性と有効性において2群で有意差がないことが示された。
ニンテダニブ(nintedanib:NTB)は特発性肺線維症(idiopathic pulmonary fibrosis:IPF)および進行性線維化を伴う間質性肺疾患(progressive fibrosing interstitial lung diseases:PF-ILD)に対し保険適用となっている抗線維化薬である。IPFにおける第3相試験(INPULSIS試験)およびPF-ILDにおける第3相試験(INBUILD試験)において,NTBは努力肺活量(forced vital capacity:FVC)の年間減少率を抑制することが示されている[1][2]。IPFでは,副作用のため治療を中断することが生存率の低下につながることも知られている[3]。したがって,NTBを長期間継続することが実際の診療の場においては重要である。
IPFに対するNTBの第2相試験(TOMORROW試験)において,NTB 300mg/日群ではFVC低下を抑制したものの,200mg/日群ではそれを示せなかった[4]。その後のINPULSIS試験およびINBUILD試験ではNTB200mg/日の投与設定はなくなっている。これらもあり,国内での承認用量は300mg/日で,副作用が生じた場合に一段階減量することになっている[5]。
日本人は欧米人に比して体格が小さいため,実臨床ではNTBを200mg/日より開始している症例も多く,その安全性と有効性について検討する必要がある。また,IPFにおけるNTB長期投与の安全性と有効性に関するリアルワールドのデータは複数散見されるが[3][6]〜[9],IPFを除くPF-ILDに関するエビデンスは乏しい。本研究ではIPFを除くPF-ILDにおいてNTB 200mg/日とNTB 300mg/日の2群間で安全性と有効性を検証した。
2015年10月から2021年4月の間に東京医科歯科大学病院呼吸器内科を受診し,IPF以外のILDと診断された患者のうち,PF-ILDの基準を満たし,NTBで加療された患者を抽出した。PF-ILDの基準はINBUILD試験と同様,胸部high-resolution computed tomography(HRCT)での線維化の広がりが肺全野の10%以上で確認され,かつ担当医により適切と考えられた疾患管理を行ったにもかかわらず,NTB導入前の24カ月以内に①%FVCの10%以上の減少(相対変化量)がみられる,②%FVCの5%以上,10%未満の減少(相対変化量)がみられ,かつ呼吸器症状の悪化がある,③%FVCの5%以上,10%未満の減少(相対変化量)がみられ,かつ胸部HRCT上での線維化変化の増加がみられる,④呼吸器症状の悪化および胸部HRCT上での線維化変化の増加がみられる,のいずれかを満たす患者を対象とした[2]。NTBの投与量に基づき200mg/日と300mg/日の2群で比較した。NTBを300mg/日から導入したが,副作用の観点から主治医の判断で6カ月以内に200mg/日に減量した場合,減量日を服薬開始日として200mg/日群に分類した。上記2群間における患者背景・副作用・治療効果を比較した。肝機能障害は,ASTまたはALTが基準値上限の3倍以上の上昇と定義した。また,副作用によるNTBの中止については担当主治医の判断に委ねられた。
統計に関して,2群間における患者背景の差異についてはMann-Whitney U検定,投与開始6,12,24カ月後におけるFVCのベースラインからの変化量はANOVA検定を用いた。間質性肺炎急性増悪は,感染症,心不全,またはその他の特定可能な原因が除外され,症状を伴う肺機能および酸素化状態の急速な悪化と定義した[10]。急性増悪の累積発生率の比較はGray検定を用いた。死亡はすべて競合リスクとみなした。急性増悪のリスク因子の解析は,Fine-Grayの比例ハザード回帰分析を用いた。生存率はKaplan-Meier曲線で描出し,差はLogrank検定を⽤いた。カプランマイヤー曲線は,NTB開始時を起点とし,通院中断・転院した段階で打ち切り,死亡した場合をイベント発生と規定してグラフを作成した。生存率の予後因子の解析は,Cox比例ハザード回帰分析を用いた。p値が0.05以下であれば統計学的に有意差があると判定した。統計の解析ソフトとして,EZR Version 1.54(自治医科大学附属さいたま医療センター,埼玉県,日本)を使用した[11]。
1.患者背景
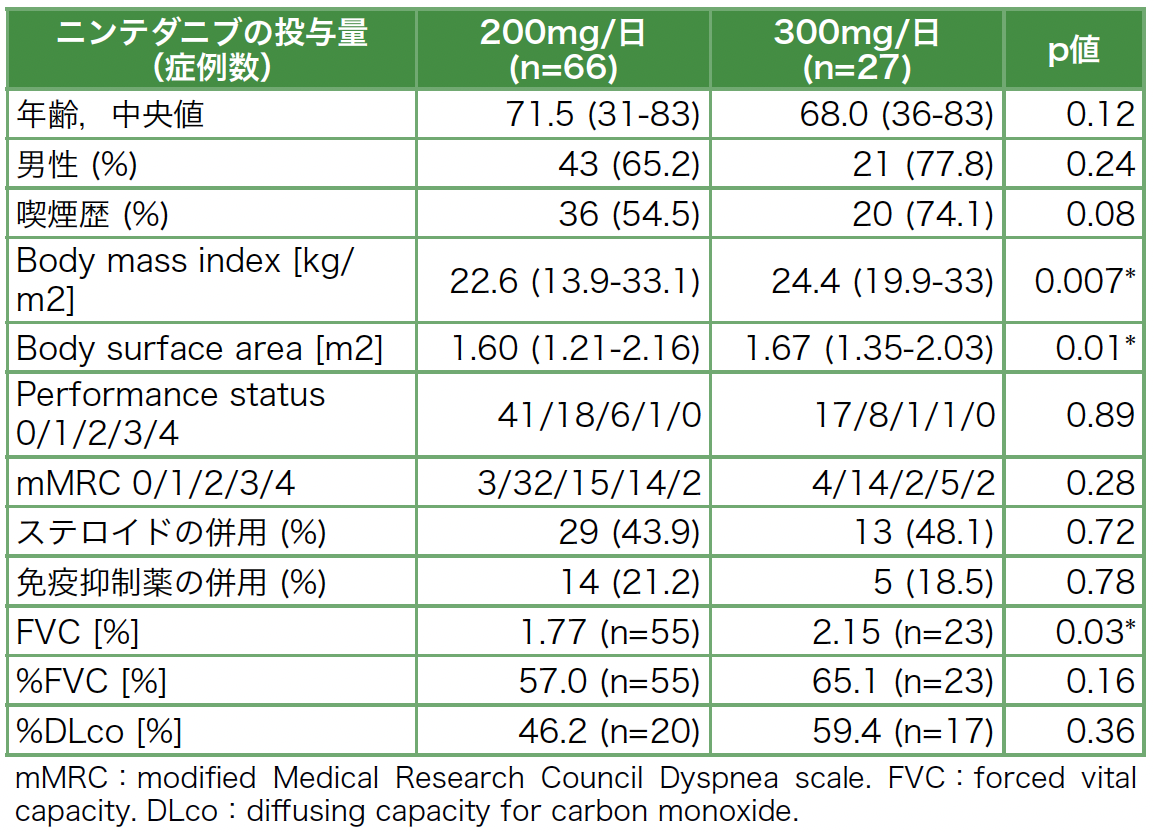
初回投与時の患者背景を表1に示す。NTB 200mg/日群は66例(うち18例(27.3%)は300mg/日からの一段階減量例),300mg/日群は27例であった。Body Mass Index(BMI),Body Surface Area(BSA,De Bois式による)はNTB 300mg/日群の方が200mg/日群に比べて有意に高かった。すなわち,体格が小さい症例にNTB 200mg/日が投与される傾向があった。また,FVCもNTB 300mg/日群の方が有意に高かった。
表1 患者背景
投与時の間質性肺炎の分類,および割合を図1に示す。NTB 200mg/日群では,non-IPF IIPs(idiopathic interstitial pneumonias)は32例(48%),線維性過敏性肺炎(fibrotic hypersensitivity pneumonitis:fHP)は16例(24%),膠原病関連間質性肺炎(collagen vascular disease-associated interstitial lung diseases:CVD-ILD)は11例(17%),iPPFE(idiopathic pleuroparenchymal fibroelastosis)は7例(11%)であった。初回投与量が300mg/日群では,non-IPF IIPsは16例(59%),HPは8例(30%),CVD-ILDは2例(7%),iPPFEは1例(4%)であった。
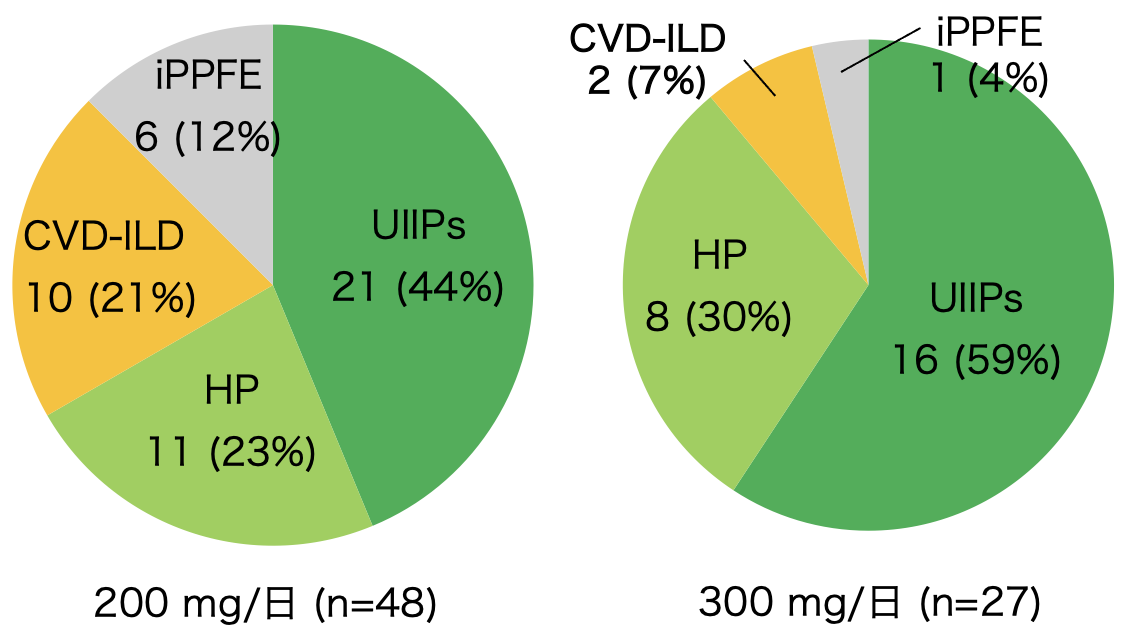
図1 間質性肺炎の分類,および割合
UIIPs:分類不能型特発性間質性肺炎(unclassifiable idiopathic interstitial pneumonias), HP: 過敏性肺炎(hypersensitivity pneumonitis), CVD-ILD: 膠原病関連間質性肺炎(collagen vascular disease-associated interstitial lung diseases), iPPFE: idiopathic pleuroparenchymal fibroelastosis.
2.副作用
NTB導入後の経過を図2に示す。NTB 200mg/日群66人のうち16人(24.2%)は副作用のためNTBを中止した。なお,200mg/日群で投与中止となった16人はすべて当初から200mg/日投与例であった。NTB 300mg/日群では,27人のうち8人(16.7%)がNTBを中止した。NTB 200mg/日群のうち再増量した症例はなかった。中止した症例の割合は,200mg/日群と300mg/日群との間で有意差はなかった(p=0.60)。
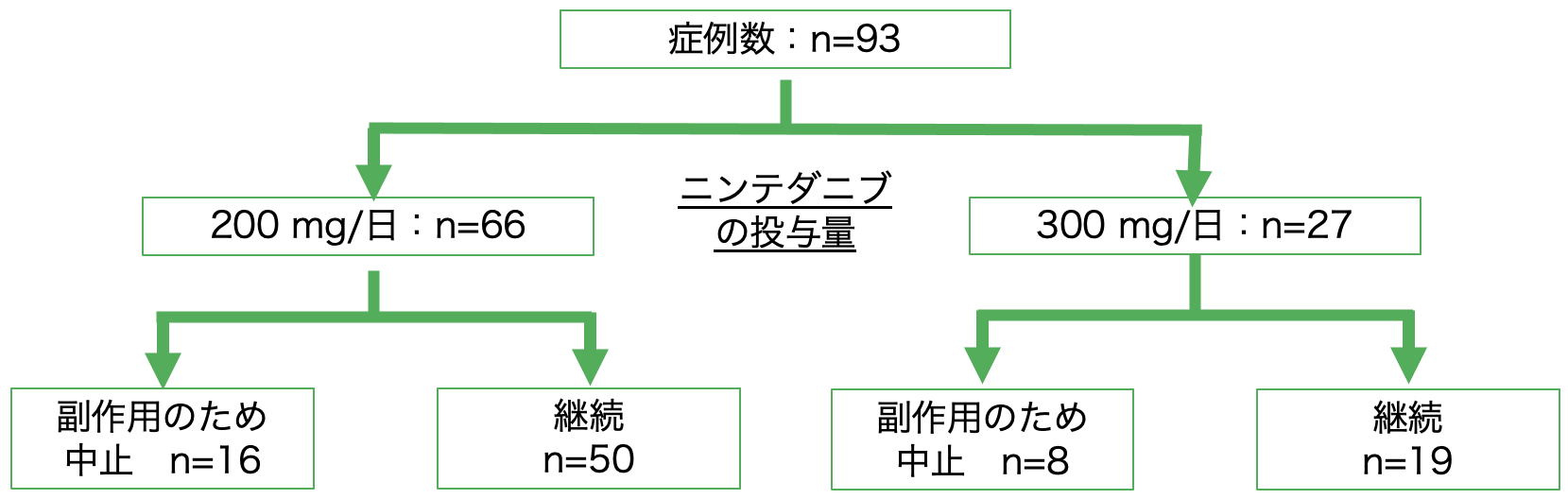
図2 フローチャート
一段階減量:300→200mg/日に減量した症例。
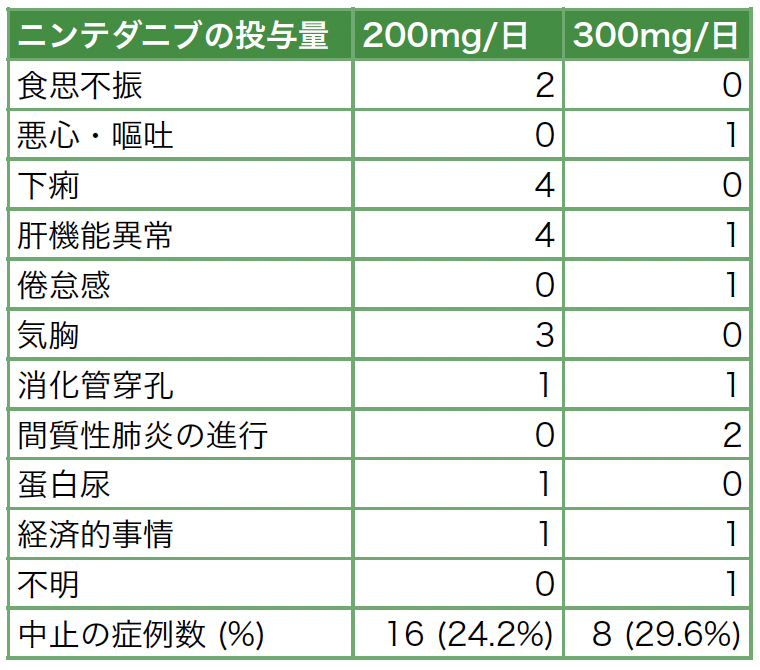
NTB開始後に中止の原因となった副作用について表2に示す。NTB 200mg/日群では,食思不振2例,下痢4例,肝機能障害4例,気胸3例,消化管穿孔1例,尿蛋白陽性1例,経済的事情1例であった。一方で,300mg/日群では,悪心・嘔吐1例,肝機能異常1例,倦怠感1例,消化管穿孔1例,間質性肺炎の進行2例,経済的事情1例であった。
表2 ニンテダニブの投与中止に至った副作用
NTB 200mg/日群において,服薬期間の中央値は319日(最小値〜最大値:24〜1641日),観察期間の中央値は426日(24〜1641日)であった。一方,NTB 300mg/日群においては,服薬期間の中央値は211日(7〜1857日),観察期間の中央値は760日(7〜1857日)であった。
NTBを中止した症例における,中止に至るまでの服薬期間の中央値は,200mg/日群で227日(範囲:24〜674日),300mg/日群で97日(28〜168日)であった。
3.治療効果
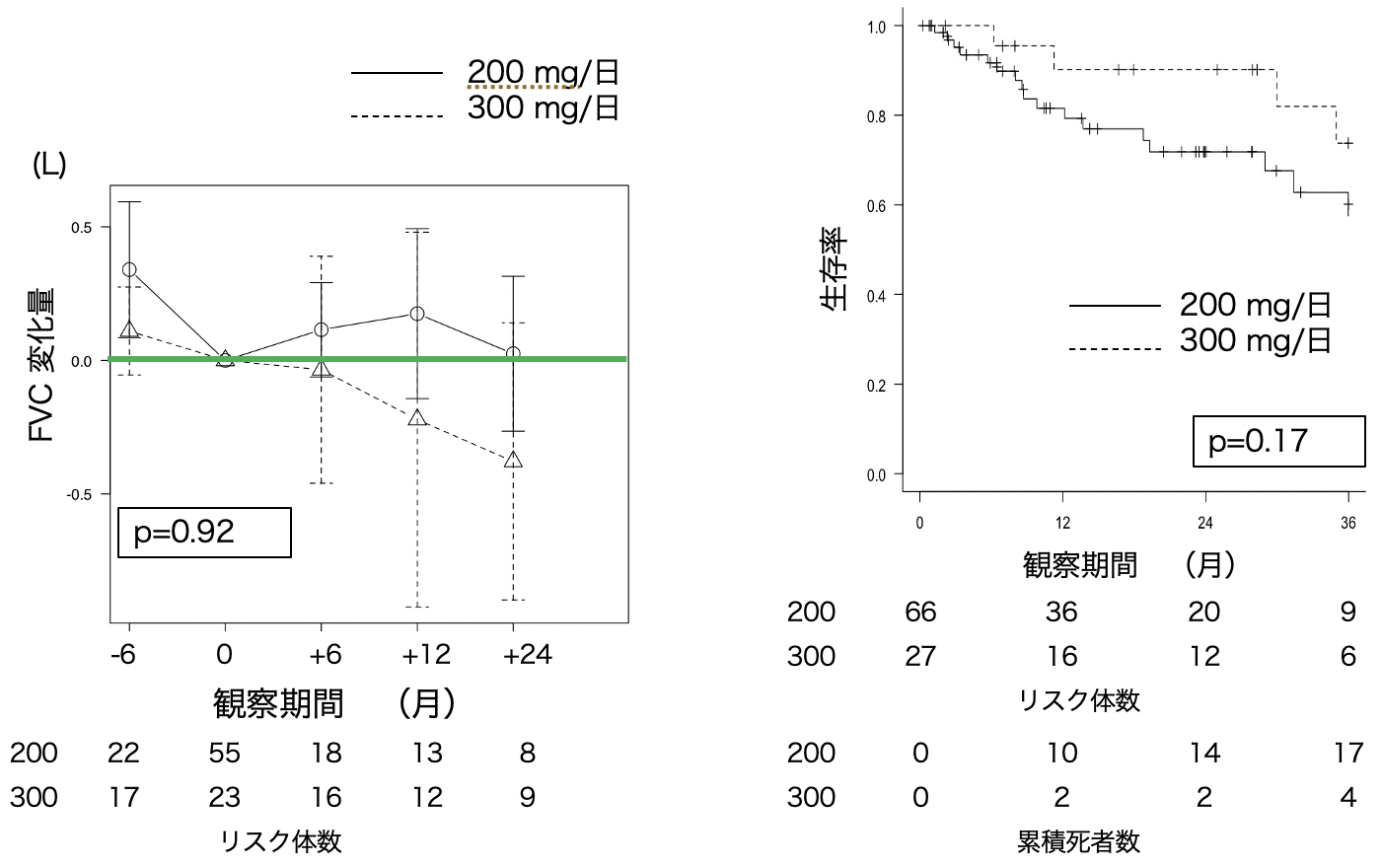
NTBの投与開始6カ月前,投与開始時、投与開始6カ月後、1年後,2年後のFVCに関するデータを図3aに示す。2群間でFVC減少量に有意差はなかった(p=0.92)。
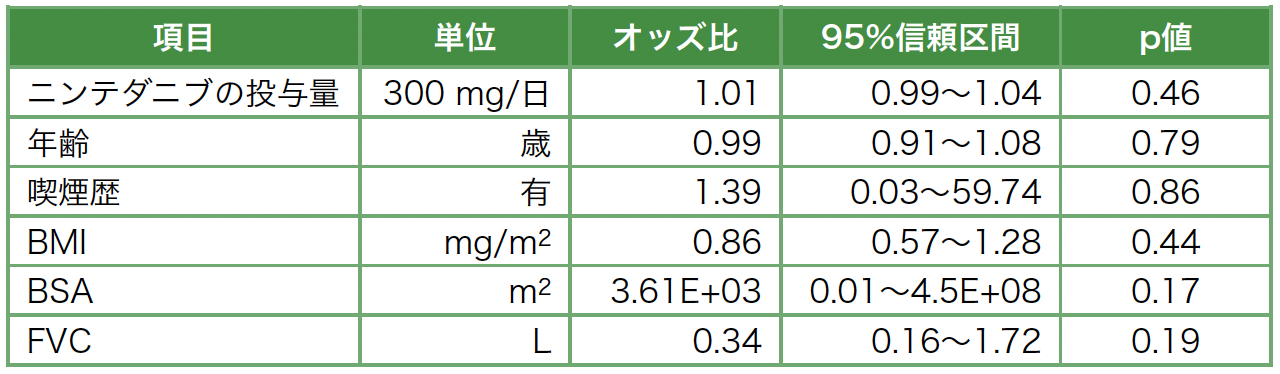
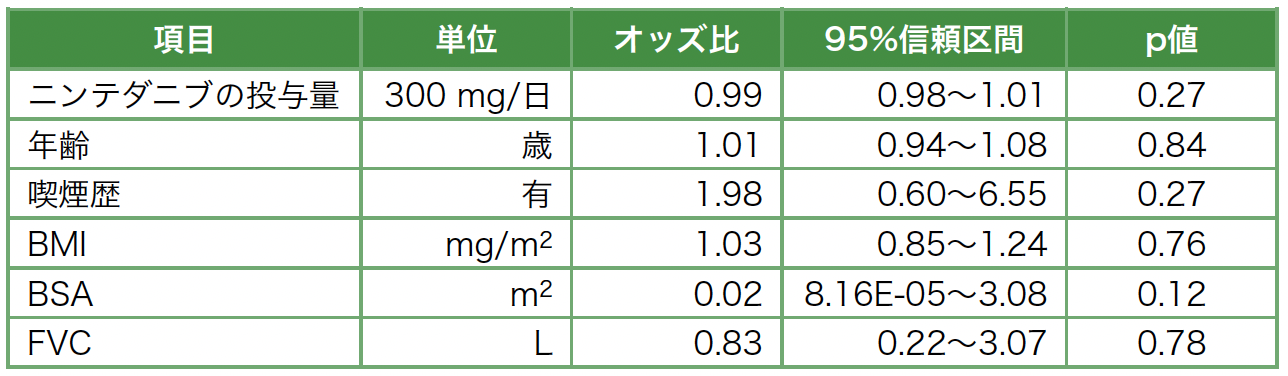
NTB投与後の生存率に関するKaplan-Meier曲線を図3bに示す。Logrank検定では,p値は0.17であり,2群間に有意差はなかった。Cox比例ハザード回帰分析の結果を表3に示す。単変量解析の段階で生存率に影響を与えた因子はなかった。
図3 ニンテダニブの有効性
a. FVC減少量のグラフ,b. 生存曲線,c. 生存曲線
ニンテダニブ200mg/日の群はBMI(カットオフ値は24)により2群に分けた。
表3 Cox比例ハザード回帰分析,単変量解析(リスク因子:死亡)
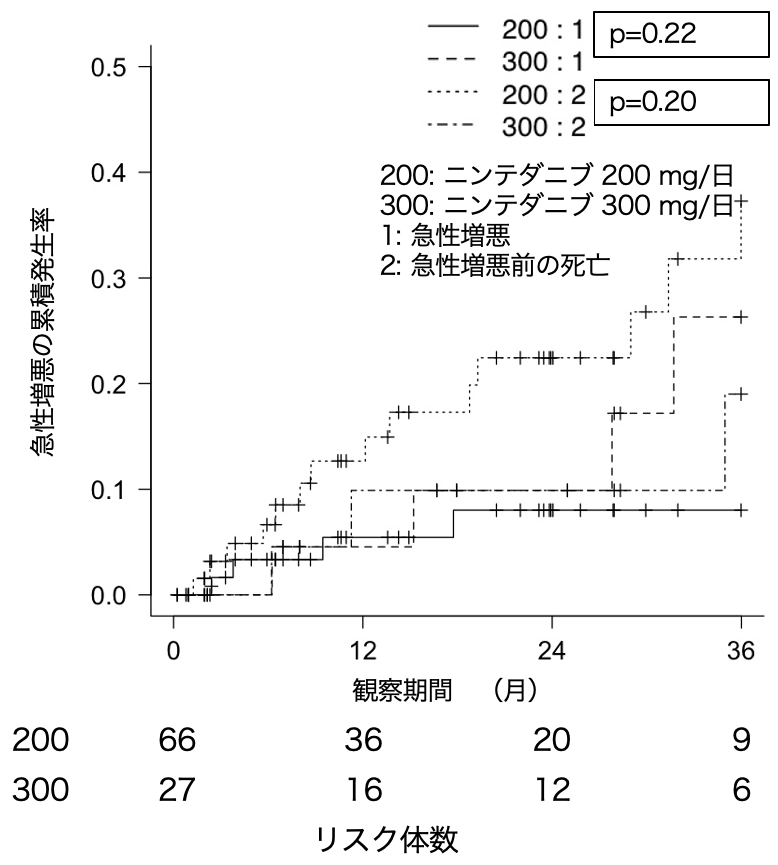
競合リスク(死亡)を加味した間質性肺炎急性増悪の累積蓄積率を図4に示す。急性増悪の累積蓄積率の差についてGray検定を行ったが,2群間で有意差はなかった(p=0.23)。競合リスクの累積蓄積率の差についても2群間で有意差はなかった(p=0.20)。Fine-Grayの比例ハザード回帰分析の結果を表4に示す。単変量解析の段階で急性増悪に影響を与えた因子はなかった。
図4 急性増悪の累積発生率
表4 Fine-Grayの比例ハザード回帰分析,単変量解析(リスク因子:急性増悪)
NTBは血小板由来増殖因子受容体(PDGFR)・線維芽細胞増殖因子受容体(FGFR)および血管内皮増殖因子受容体(VEGFR)受容体を標的とするチロシンキナーゼ阻害薬である[12]。INPULSIS試験では,IPF患者においてNTB投与群はプラセボ群と比較しFVCの年間減少量を有意に抑制することが示され(FVC年間減少量:NTB群 −113.6mL,プラセボ群-223.5 mL)[1],NTBは2015年より本邦で保険適用となっている。また,INBUILD試験では,PF-ILD患者においてもIPFと同様にFVCの年間減少量を有意に抑制することが示されている(FVC年間減少量:NTB群 −80.8mL,プラセボ群 −187.8mL)[2]。
本研究では,NTB 300mg/日群のうち16.7%がNTBを中止した。INPULSIS試験,INBUILD試験ではNTBの投与量は300mg/日であるが,各々19.3%,24.1%が中止に至っている[1][2]。また,Antoniouらの後方視的研究によれば,224人のIPF患者に対しNTB 300mg/日を投与したところ,13.1%が内服を中止している。本研究のNTB 300mg/日群では,これらのデータと比較すると中止の頻度が同等であった[13]。一方で,NTB 200mg/日群は24.2%が中止に至った。IPF患者142例を対象とした単施設での後方視的研究では,投与量200mg/日の症例が中止に至った症例数は,24例のうち4例(16.7%)だったと報告している[14]。本研究ではNTB 200mg/日群における中止の割合が高い結果となった。これは,NTB 200mg/日が投与された症例の体格が小さく,主治医判定で忍容性が低いことが予想されたためとも思われた。しかし,体格が小さいにもかかわらず,中止の割合はNTB 300mg/日と有意差がなく,忍容性は同等であった。
副作用に関し,本研究ではNTB 300mg/日群の方が200mg/日群に比べ肝機能障害の発生頻度が高かった。過去には300mg/日で投与された日本人のIPF患者のうち34.4%で肝機能障害が発生し,BMI,BSAが低値であることが肝機能異常のリスクとなることが報告されている[15]。Performance statusの低下も副作用の発現に関与することが知られている[3]。薬物動態(pharmacokinetics)の研究によれば,年齢,体重,喫煙,アジア系人種がNTBの血中濃度-時間曲線下面積(area under the blood concentration-time curve:AUC)に影響を与えることが示されている[16]。NTBの投与量においてはこれらの指標を考慮し,副作用が出現しないか注意する必要がある。また,NTB 200mg/日群で気胸の発生頻度が多かったが,治療開始時点で進行した間質性肺炎の症例が多かった影響が考えられた。
FVCの変化量,急性増悪の合併,生存率に関し,2群間で有意差を認めなかった。PF-ILD症例を前向きに検討した試験では,3年生存率は83%であった[17]。本症例では,NTBの維持量200mg/日群の3年生存率が57.5%と既知の報告より悪い理由としては,高齢な患者が多いこと,治療開始前のFVCの低い患者が多いことが原因と考えられた。
INPULSIS試験・INBUILD試験では,患者の大半が欧米人であり,NTBの初回投与量が300mg/日と設定されている。日本人は欧米人に比べ体格が小さい傾向があり,実臨床では初回より200mg/日の投与量で開始することがある。本研究では,NTB 200mg/日群は300mg/日群に比べ体格の小さい患者が多かったものの,忍容性は300mg/日群と同等であった。副作用などの理由でNTB 300mg/日を継続できない場合,200mg/日と一段階減量した上でNTBを維持することは許容されるかもしれない。
本研究のlimitationとしては以下の点をあげる。まず,NTB 200mg/日群と300mg/日群とで患者背景が大きく異なり,選択バイアスの強い集団を解析した。次に,呼吸機能検査に欠損値を認め,全症例でFVC減少量の経過を追うことができなかった。また,症例数が少なく,200mg/日,300mg/日の2群間で有意差が出にくい可能性も考えられる。本研究は単施設後方視的研究であり,今後は多施設でのランダム化比較試験や前方視的研究が望まれる。
NTBの投与量の違いによる忍容性と安全性の違いについて検証した。本研究からは,副作用等の問題からNTBを300mg/日で継続できなかったとしても,忍容性・安全性・有効性の観点では200mg/日で継続することは一つの選択肢になる可能性が示唆された。さらなる研究,データの蓄積が求められる。
本論文の要旨は第62回日本呼吸器学会学術講演会(2022年4月,国立京都国際会館)において発表した。
利益相反:なし。
Background: Studies of nintedanib (NTB) 200 mg/day in progressive fibrosing interstitial lung diseases are limited.
Methods: We performed a retrospective study to compare efficacy and tolerability of NTB for two groups of patients with NTB at maintenance doses of 200 mg/day and 300 mg/day.
Results: There were no significant differences in the discontinuation rate, annual decrease in effort lung capacity, the cumulative incidence of acute exacerbations, or survival between the two patients.
Conclusion: The safety and efficacy of NTB 200 mg/day were not different from those of 300 mg/day, and future studies are warranted.
- Richeldi L, et al. Efficacy and Safety of Nintedanib in Idiopathic Pulmonary Fibrosis. N Engl J Med. 2014; 370: 2071-82. doi: 10.1056/NEJMoa1402584.
- Flaherty KR, et al. Nintedanib in Progressive Fibrosing Interstitial Lung Diseases. N Engl J Med. 2019; 381: 1718-27. doi: 10.1056/NEJMoa1908681.
- Kato M, et al. Clinical significance of continuable treatment with nintedanib over 12 months for idiopathic pulmonary fibrosis in a real-world setting. Drug Des Devel Ther. 2021; 15: 223-30.doi: 10.2147/DDDT.S284819.
- Richeldi L, et al. Efficacy of a tyrosine kinase inhibitor in idiopathic pulmonary fibrosis. N Engl J Med. 2011; 365: 1079-87. doi: 10.1056/NEJMoa1103690.
- 医薬品医療機器総機構.オフェブに関する資料. https://www.info.pmda.go.jp/go/pack/3999039M1022_1_11/ (accessed: March 20, 2022).
- Pereira CAC, et al. Safety and tolerability of nintedanib in patients with idiopathic pulmonary fibrosis in Brazil. J Bras Pneumol. 2019; 45: e20180414.
- Brunnemer E, et al. Real-world experience with nintedanib in patients with idiopathic pulmonary fibrosis. Respiration. 2018; 95: 301-9.
- Tzouvelekis A, et al. Safety and efficacy of nintedanib in idiopathic pulmonary fibrosis: A real-life observational study in Greece. Pulm Pharmacol Ther. 2018; 49: 61-6.
- Fournier D, et al. Real-world safety profiles of pirfenidone and nintedanib in idiopathic pulmonary fibrosis patients. Pulm Pharmacol Ther. 2022; 76: 102149.
- Collard HR, et al. Acute exacerbation of idiopathic pulmonary fibrosis. An international working group report. Am J Respir Crit Care Med. 2016; 194: 265–75. doi: 10.1164/rccm.201604-0801CI.
- Kanda Y, et al. Investigation of the freely available easy-to-use software‘EZR' for medical statistics. Bone Marrow Transplant. 2013; 48: 452-8. doi: 10.1038/bmt.2012.244.
- European Medicines Agency. Ofev: EPAR-Product Information. 2019. http://www.ema.europa.eu/documents/product-information/ofev-epar-product-information_en.pdf (accessed: June 11, 2022).
- Antoniou K, et al. Efficacy and safety of nintedanib in a Greek multicentre idiopathic pulmonary fibrosis registry: a retrospective, observational, cohort study. ERJ Open Res. 2020; 6: 00172-2019. doi: 10.1183/23120541.00172-2019.
- Ikeda S, et al. Low starting-dosage of nintedanib for the reduction of early termination. Respir Investig 2019; 57: 282-5.
- Ikeda S, et al. Hepatotoxicity of nintedanib in patients with idiopathic pulmonary fibrosis: A single-center experience. Respir Investig. 2017; 55: 51-4. doi: 10.1038/s41598-017-11321-x.
- Wind S, et al. Clinical pharmacokinetics and pharmacodynamics of nintedanib. Clin Pharmacokinet. 2019; 58: 1131-47. doi: 10.1007/s40262-019-00766-0.
- Nasser M, et al. Progressive fibrosing interstitial lung disease: a clinical cohort (the PROGRESS study). Eur Respir J. 2021; 57: 2002718. doi: 10.1183/13993003.02718-2020.