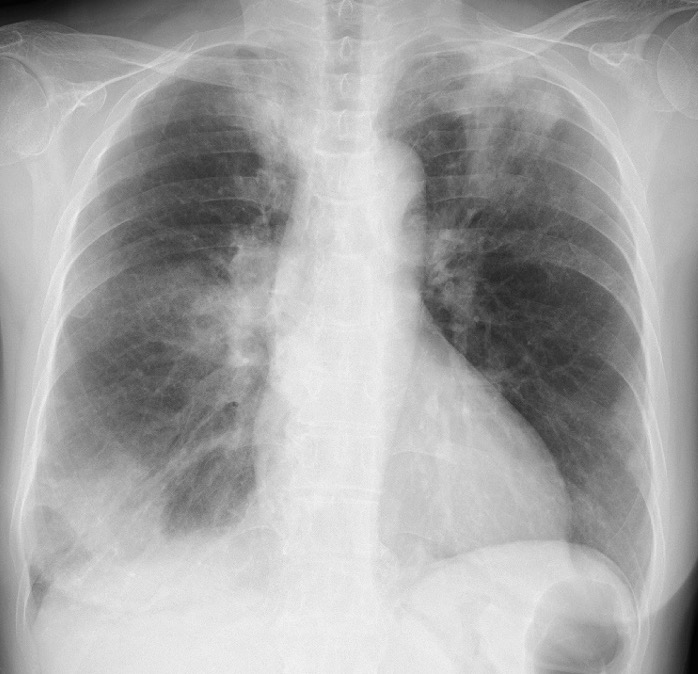
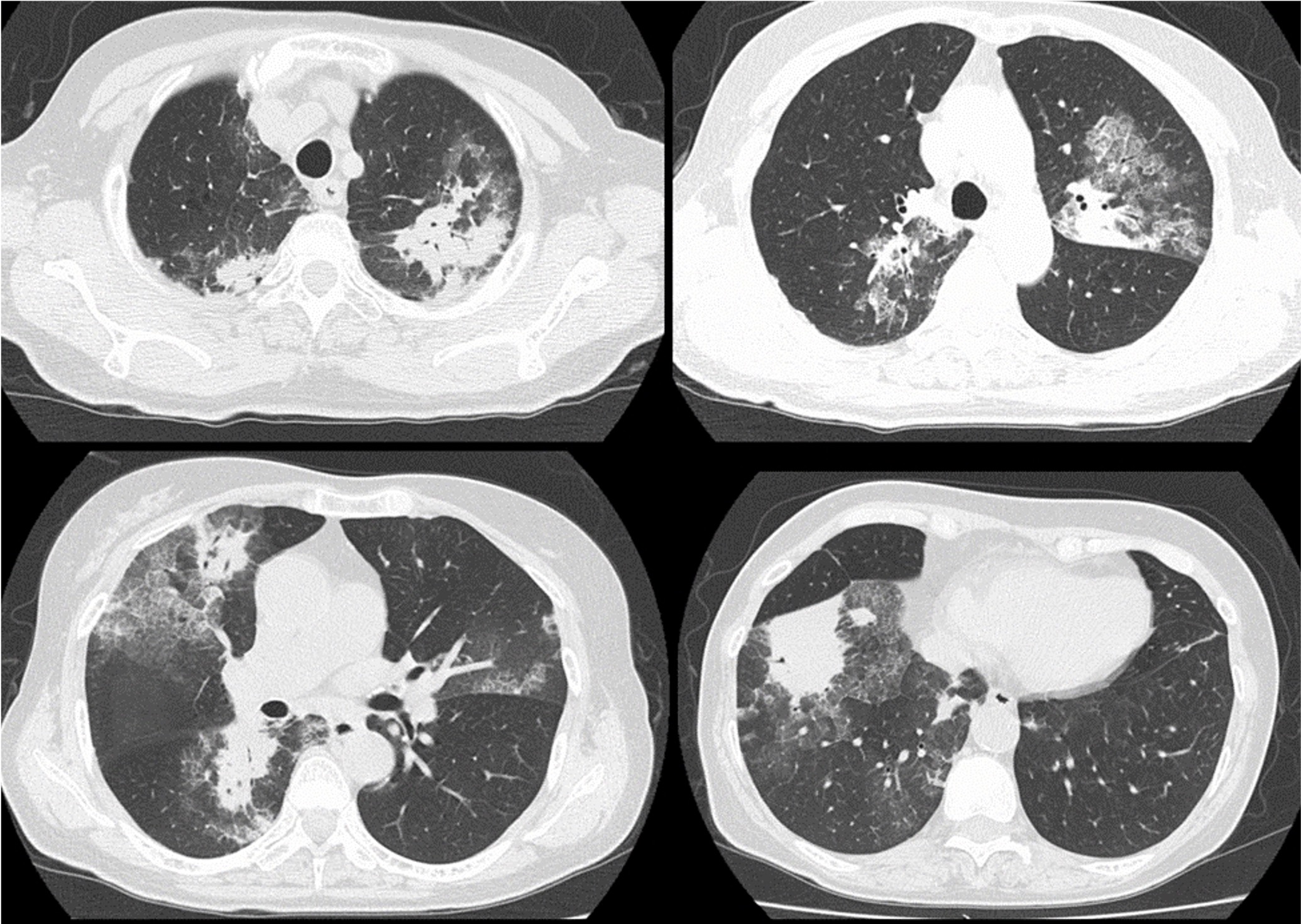
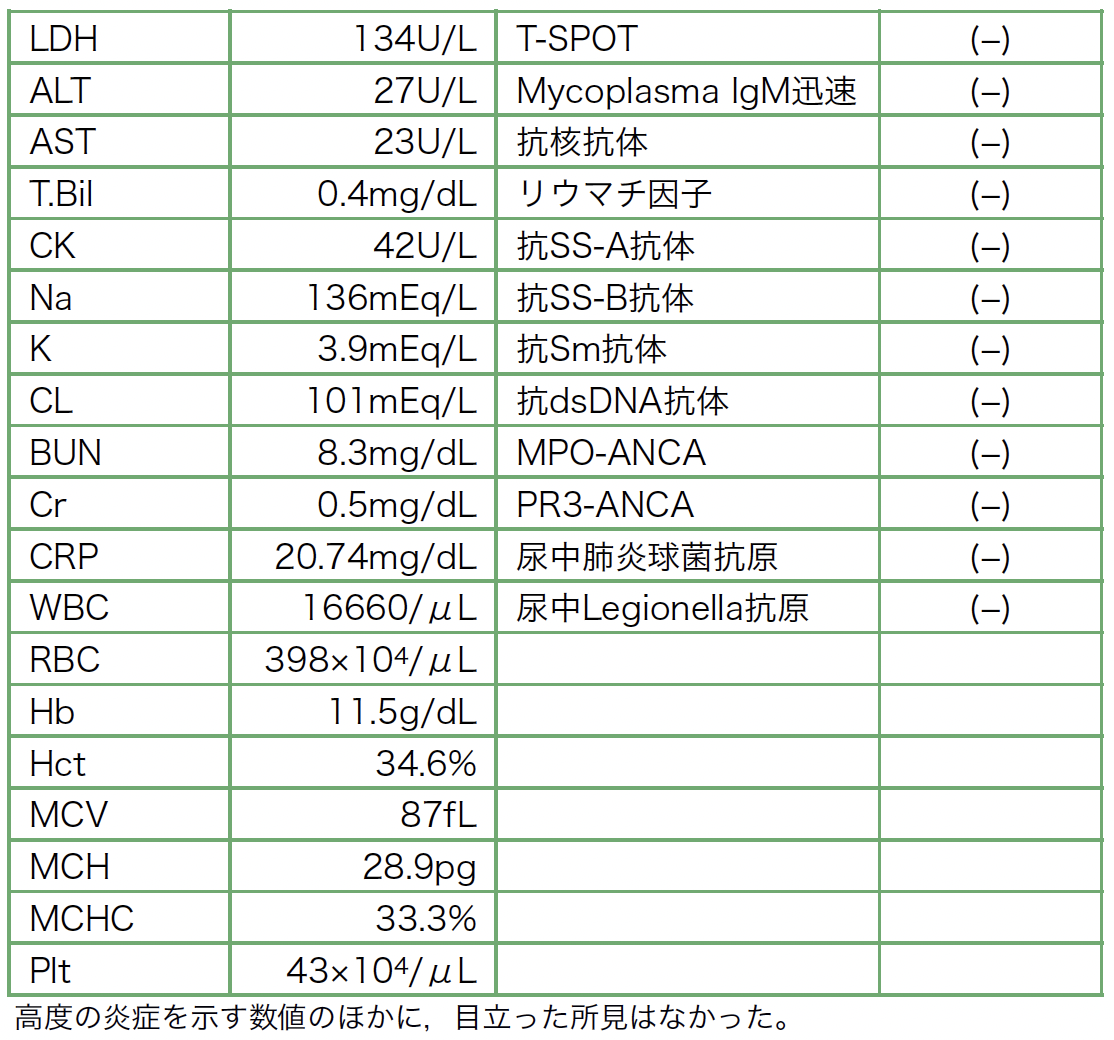
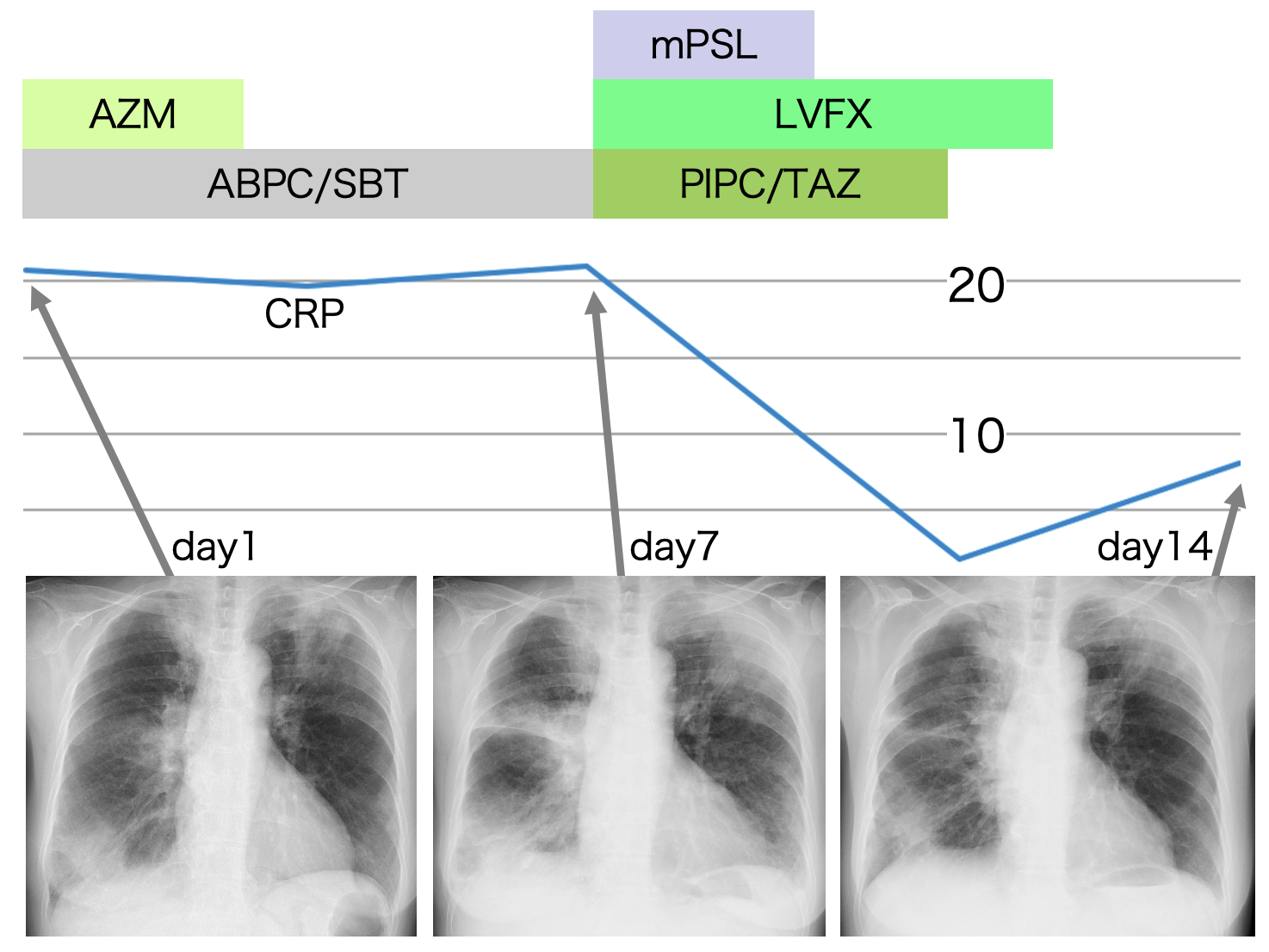
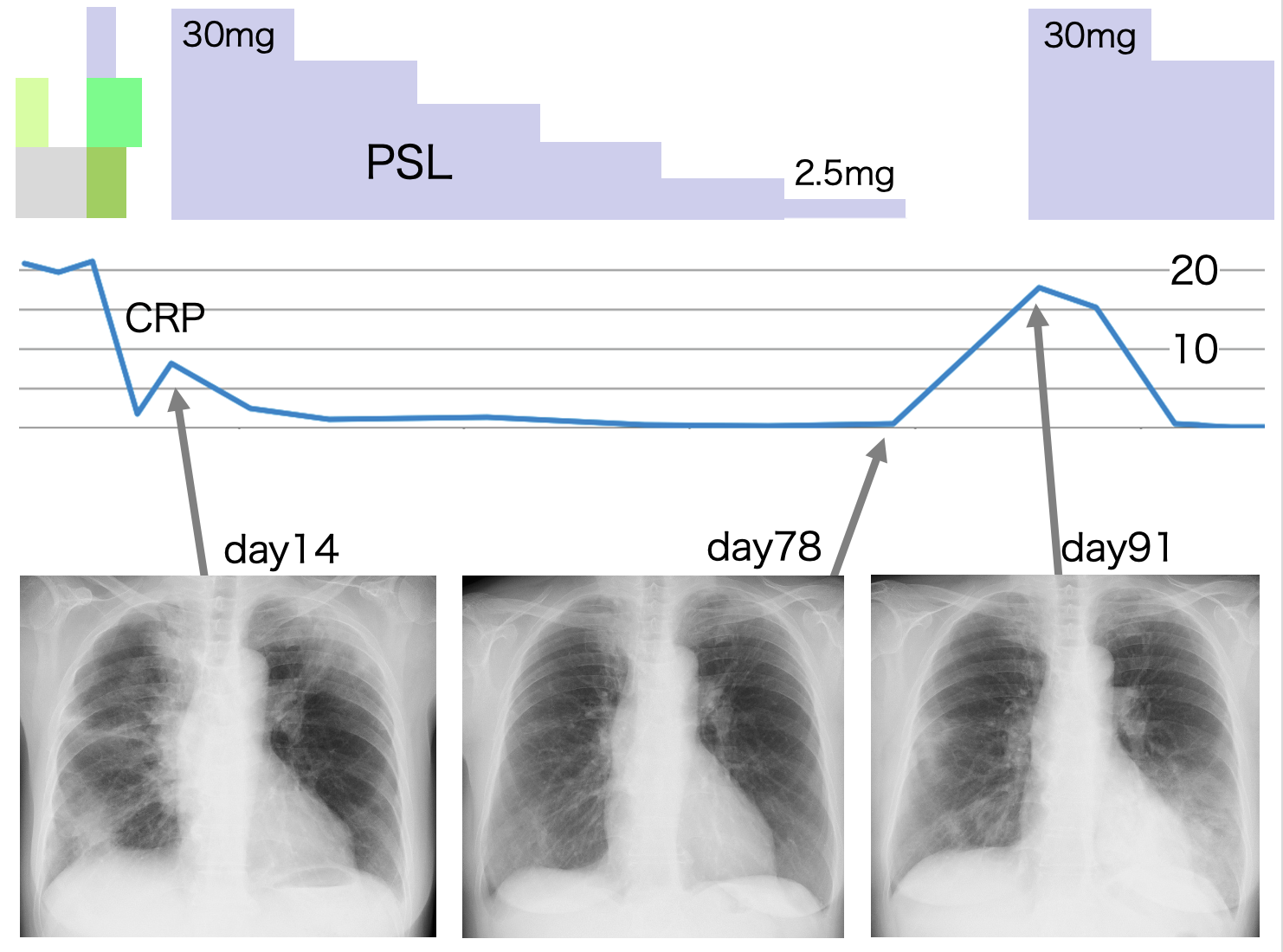
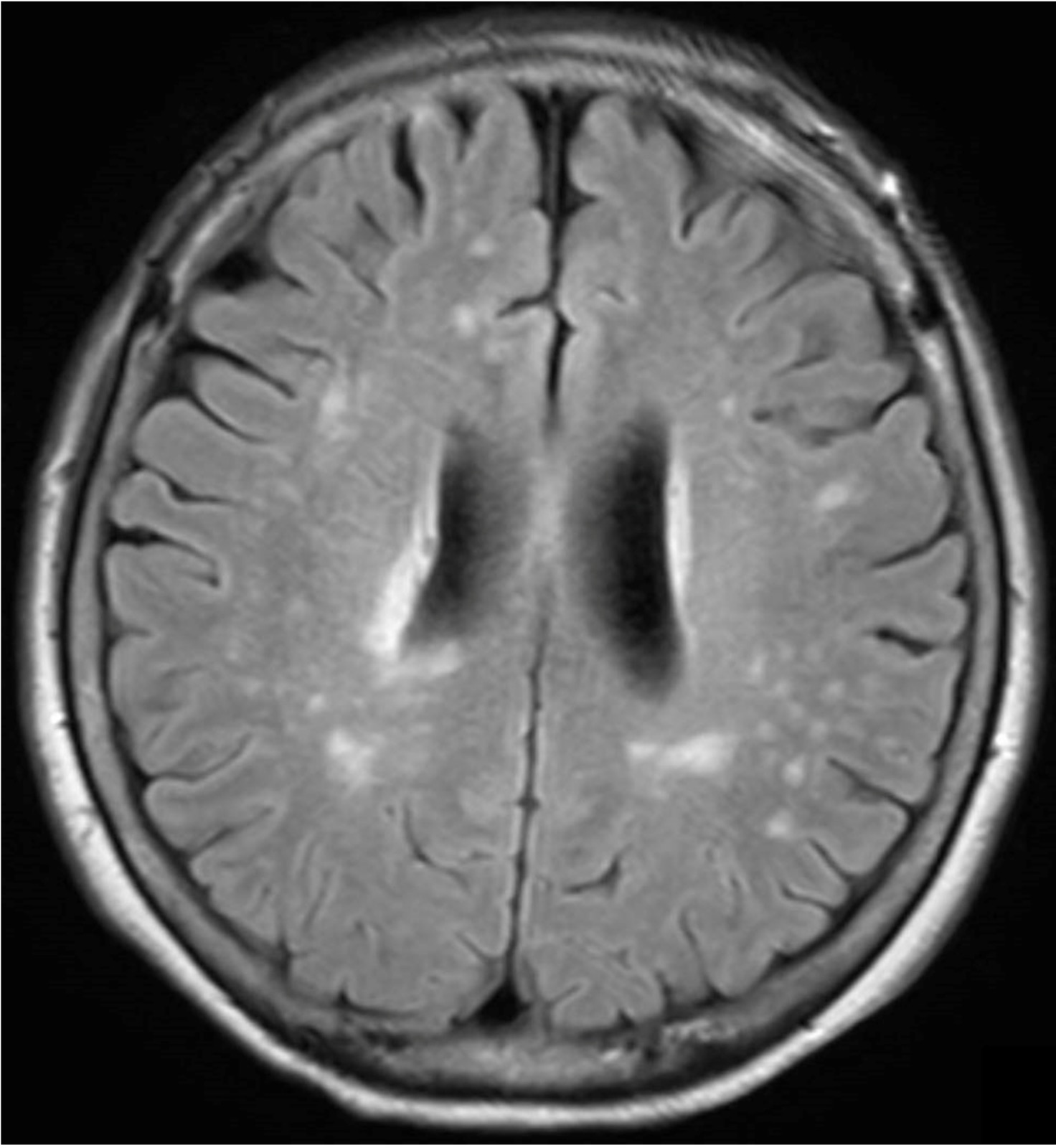
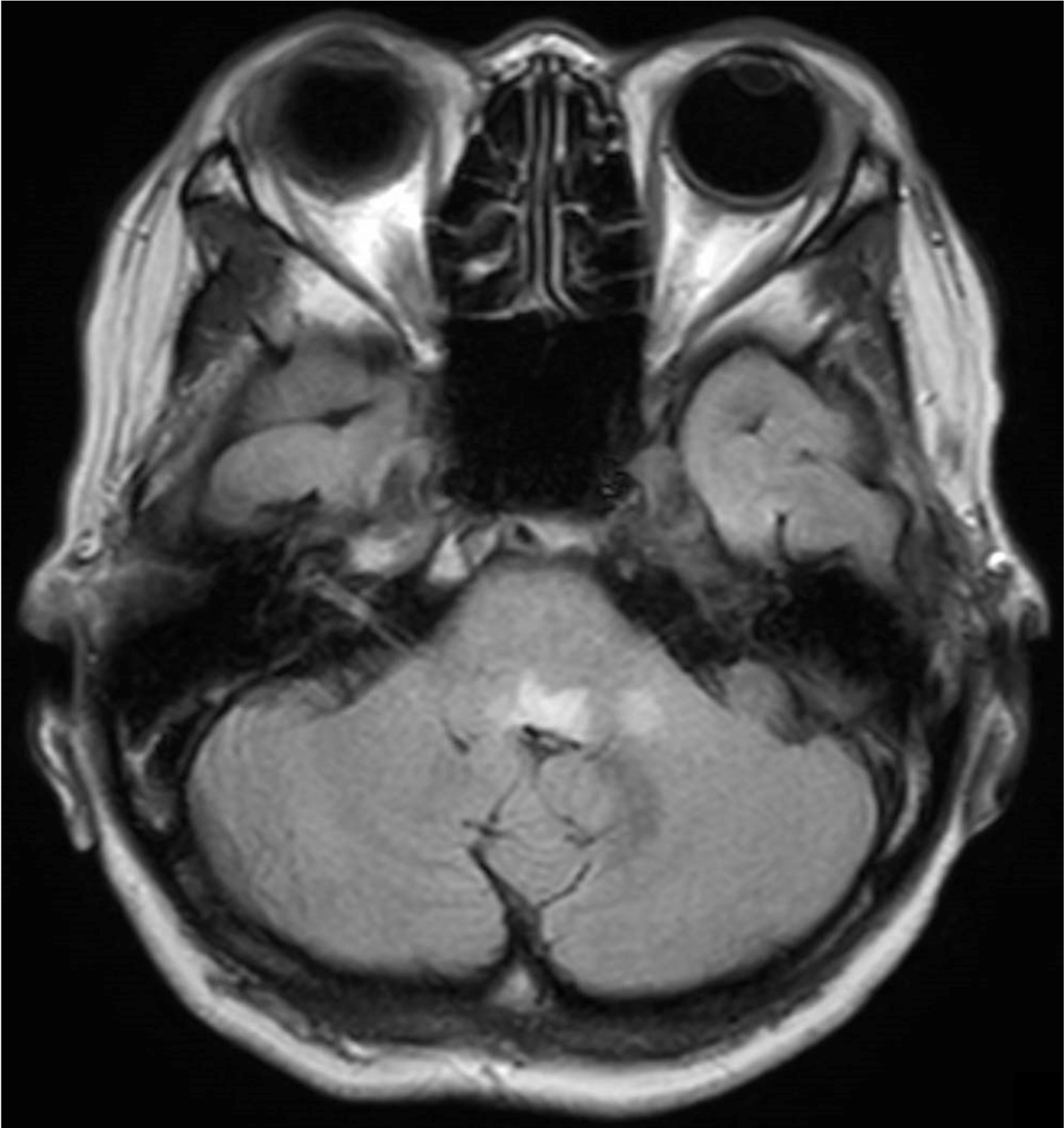
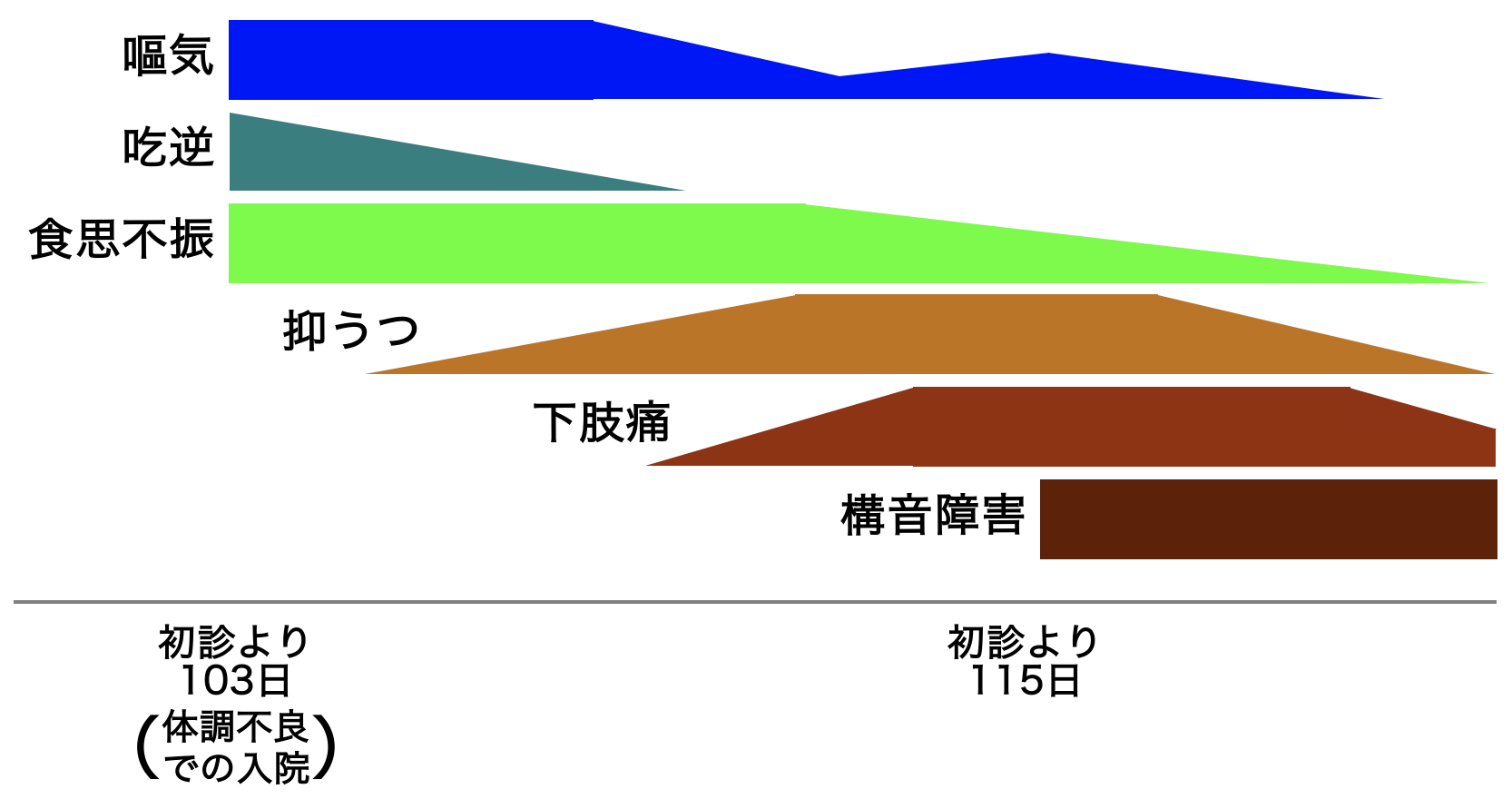
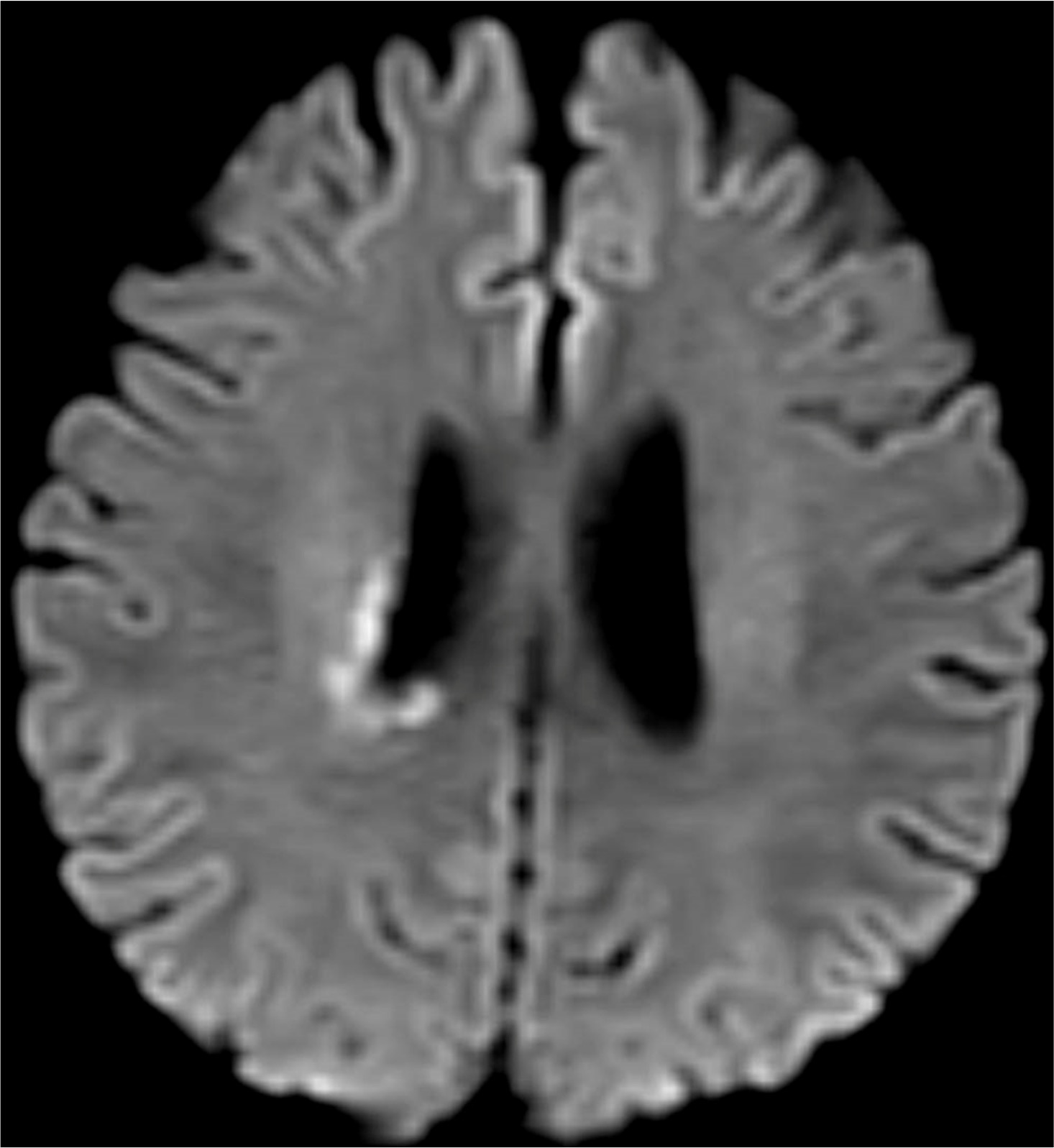
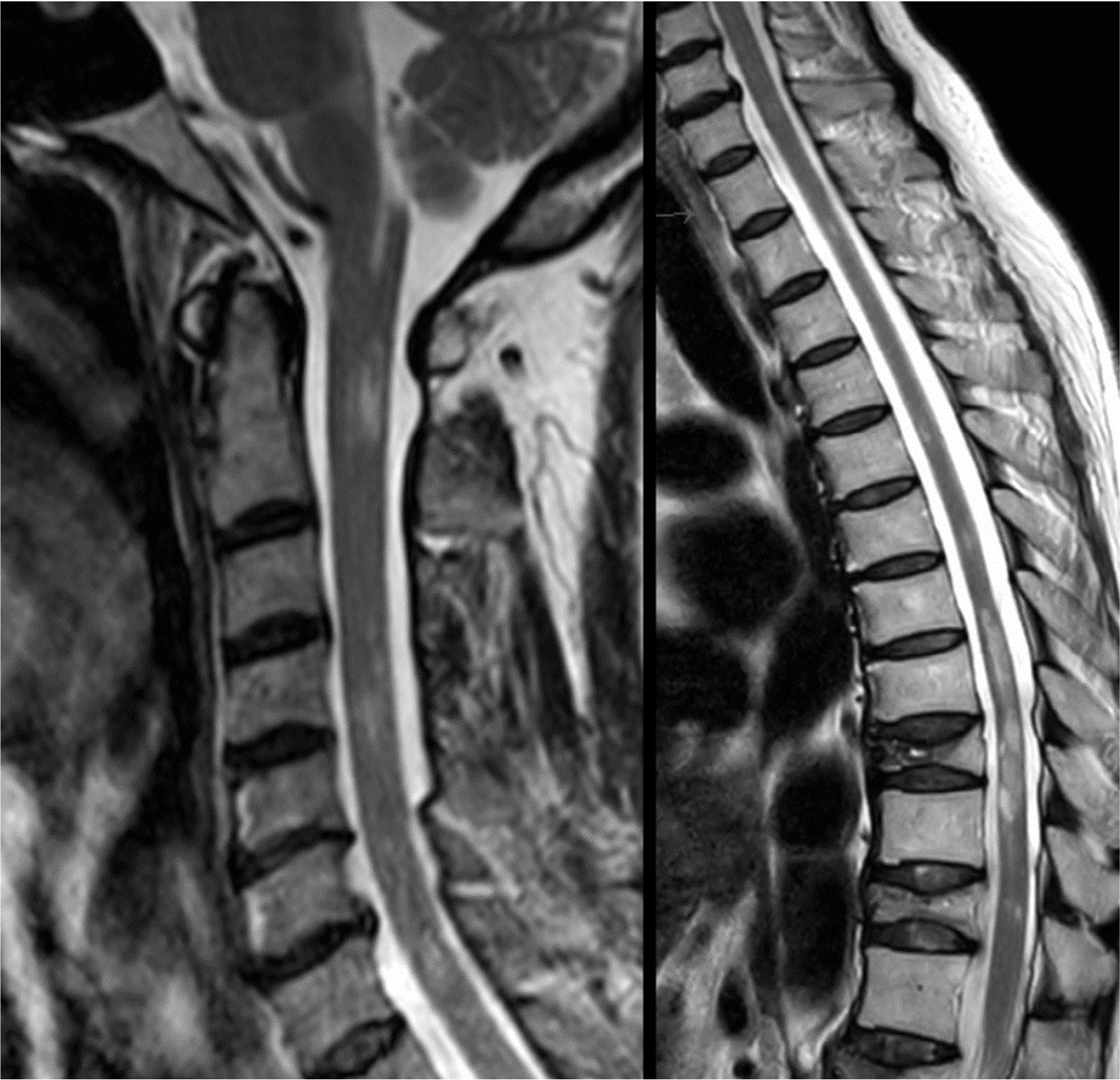
A case of neuromyelitis optica diagnosed during treatment of organizing pneumonia
Eisaku Kamakura*1, Tatsuya Ito*2, Kenjirou Sato*2, Katsuaki Yazawa*3, Kozo Suhara*4, Hiroshi Takasaki*5 , Takehiko Oba*2, Susumu Isogai*6, Osamu Tao*7
*1Department of General Medicine, Niigata University School of Medicine, Niigata
*2Department of Respiratory Medicine, Ome Municipal General Hospital, Tokyo
*3Department of Respiratory Medicine, Ageo Central General Hospital, Saitama
*4Department of Respiratory Medicine, NHO Disaster Medical Center, Tokyo
*5Department of Respiratory Medicine, Nitobe Memorial Nakano General Hospital, Tokyo
*6Department of Respiratory Medicine, Omesannkei Hospital, Tokyo
*7Department of Neurology, Ome Municipal General Hospital, Tokyo
Keywords:器質化肺炎,視神経脊髄炎,不定愁訴/organizing pneumonia, neuromyelitis optica, unidentified complaints