渡邉祥平,武田直也,鳥居 敦,内田岬希,横山昌己,森 拓也,山田悠貴,堀 和美,松井 彰,吉田憲生
刈谷豊田総合病院呼吸器内科(〒448-8505 愛知県刈谷市住吉町5-15)
A case of pulmonary lymphangioleiomyo-matosis presenting with multiple small nodules predominantly in the right lung
Shohei Watanabe, Naoya Takeda, Atsushi Torii, Misaki Uchida, Masaki Yokoyama, Takuya Mori, Yuki Yamada, Kazumi Hori, Akira Matsui, Norio Yoshida
Department of Respiratory Medicine, Kariya Toyota General Hospital, Aichi
Keywords:肺リンパ脈管筋腫症,多発小結節/lymphangioleiomyomatosis,multiple small nodules
呼吸臨床 2024年8巻7号 論文No.e00193
Jpn Open J Respir Med 2024 Vol. 8 No.7 Article No.e00193
DOI: 10.24557/kokyurinsho.8.e00193
受付日:2024年4月17日
掲載日:2024年7月9日
©️Shohei Watanabe, et al. 本論文はクリエイティブ・コモンズ・ライセンスに準拠し,CC-BY-SA(原作者のクレジット[氏名,作品タイトルなど]を表示し,改変した場合には元の作品と同じCCライセンス[このライセンス]で公開することを主な条件に,営利目的での二次利用も許可されるCCライセンス)のライセンシングとなります。詳しくはクリエイティブ・コモンズ・ジャパンのサイト(https://creativecommons.jp/)をご覧ください。
肺リンパ脈管筋腫症(lymphangioleio-myomatosis:LAM)は主に女性に発症する非常に稀な疾患である。孤発性リンパ脈管筋腫症(sporadic LAM)と結節性硬化症合併のリンパ脈管筋腫症(TSC-LAM)に分類され,2003~2005年に行われたLAMに関する疫学調査では173例の臨床情報が集積され,145例(83.8%)がsporadic LAM,28例(16.2%)がTSC-LAMであり,日本での有病率は1.2~2.3人/100万人と推定されている[1]。
LAMにおける胸部CT所見は,両側全肺野に比較的均等に認められる境界明瞭な薄壁を有する囊胞であるが[2],今回我々は右肺片側の多発小結節を契機にLAMの診断に至った症例を経験したので報告する。
患者:61歳,女性。
主訴:胸部健診X線検査異常。
既往歴:鬱病。
喫煙歴:なし。
内服歴:スルピリド,エピナスチン,トリアゾラム。
現病歴:健診胸部X線検査で異常を指摘され,当院を紹介受診した。胸部単純CT検査では右肺中下葉に多発小結節を認めた。肺癌を疑い気管支鏡下肺生検を施行するも診断に至らず,胸腔鏡下右肺部分切除術を施行した。
入院時現症:身長153cm,体重42kg。意識清明,体温36.3℃,血圧136/82mmHg,脈拍63/分,呼吸回数12回/分,経皮的動脈血酸素飽和度98%(室内気)。心雑音なし,呼吸音異常なし,腹部に圧痛なし,表在リンパ節触知せず,明らかな皮膚所見は認めず。
入院時検査所見:血液検査上特記事項を認めなかった。
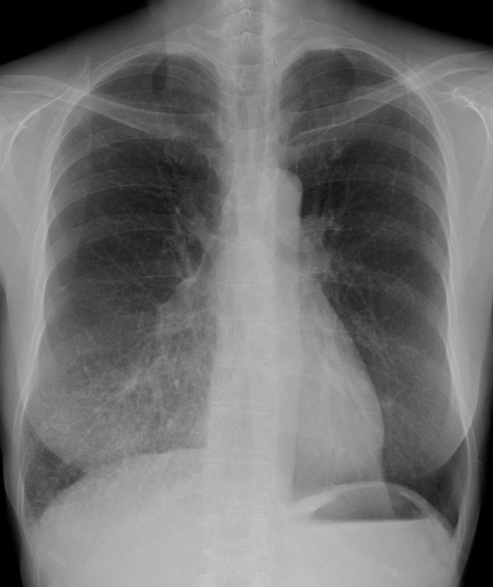
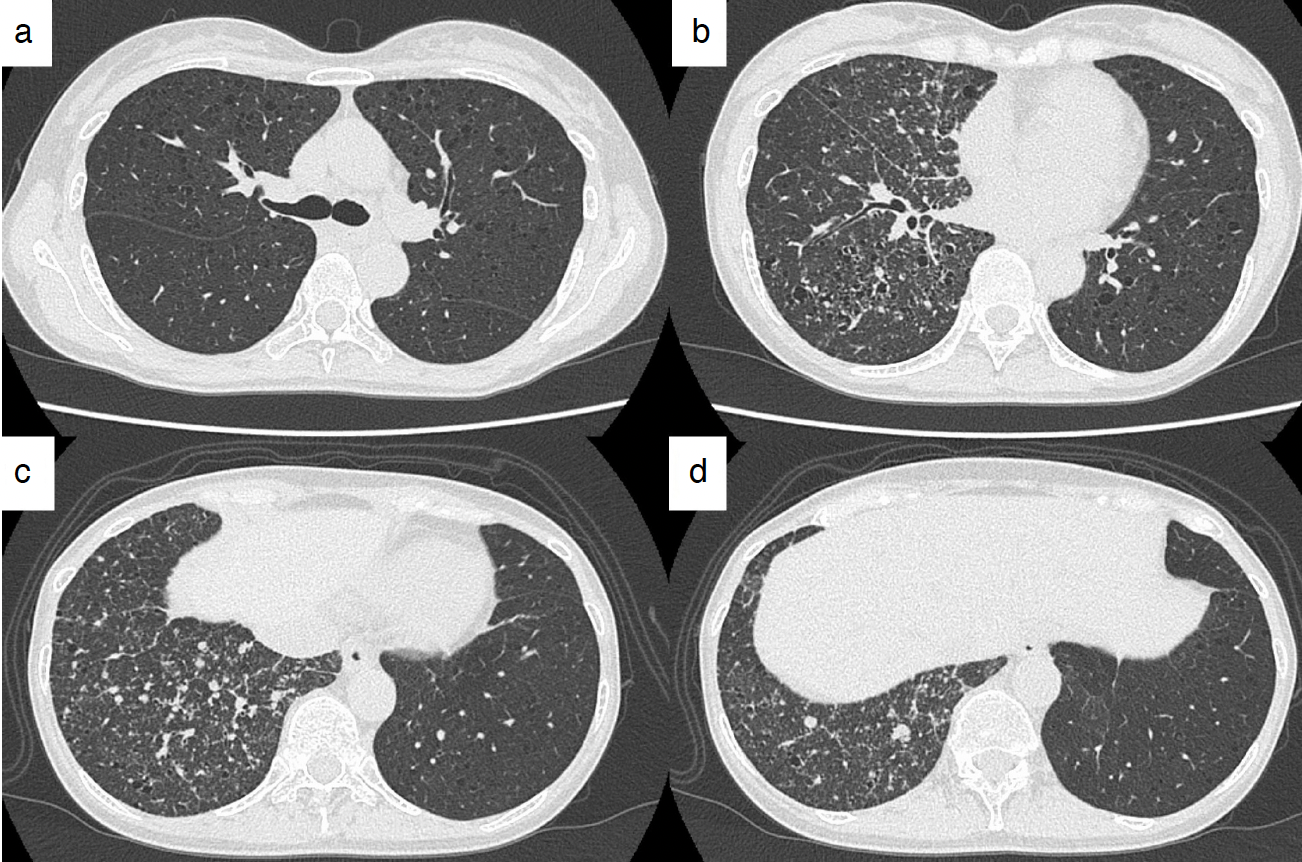
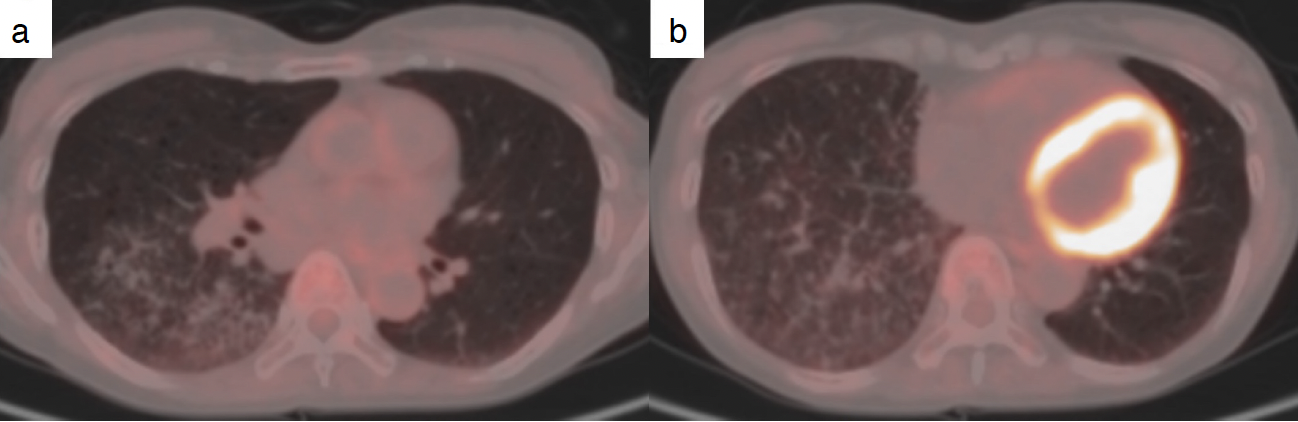
入院時画像所見:胸部X線にて右中下肺野に多発の小結節影を認めた(図1)。胸部単純CT検査にて右肺中下葉に多発小結節を認めた。両肺に多発囊胞を認め,一部の囊胞内にも軟部吸収値を認めた(図2)。PET-CT検査では右中下葉の小結節には集積亢進を認めなかった(図3)。
図1 初診時の胸部X線写真
右中下肺野に多発する小結節を認める。
図2 初診時の胸部CT
両肺に壁の薄い囊胞性病変が複数みられる(a〜d)。多発する小結節病変が右中下葉にみられる(b〜d)。
図3 PET-CT
多発小結節に18F-fluorodeoxyglucose(FDG)集積は認められなかった。
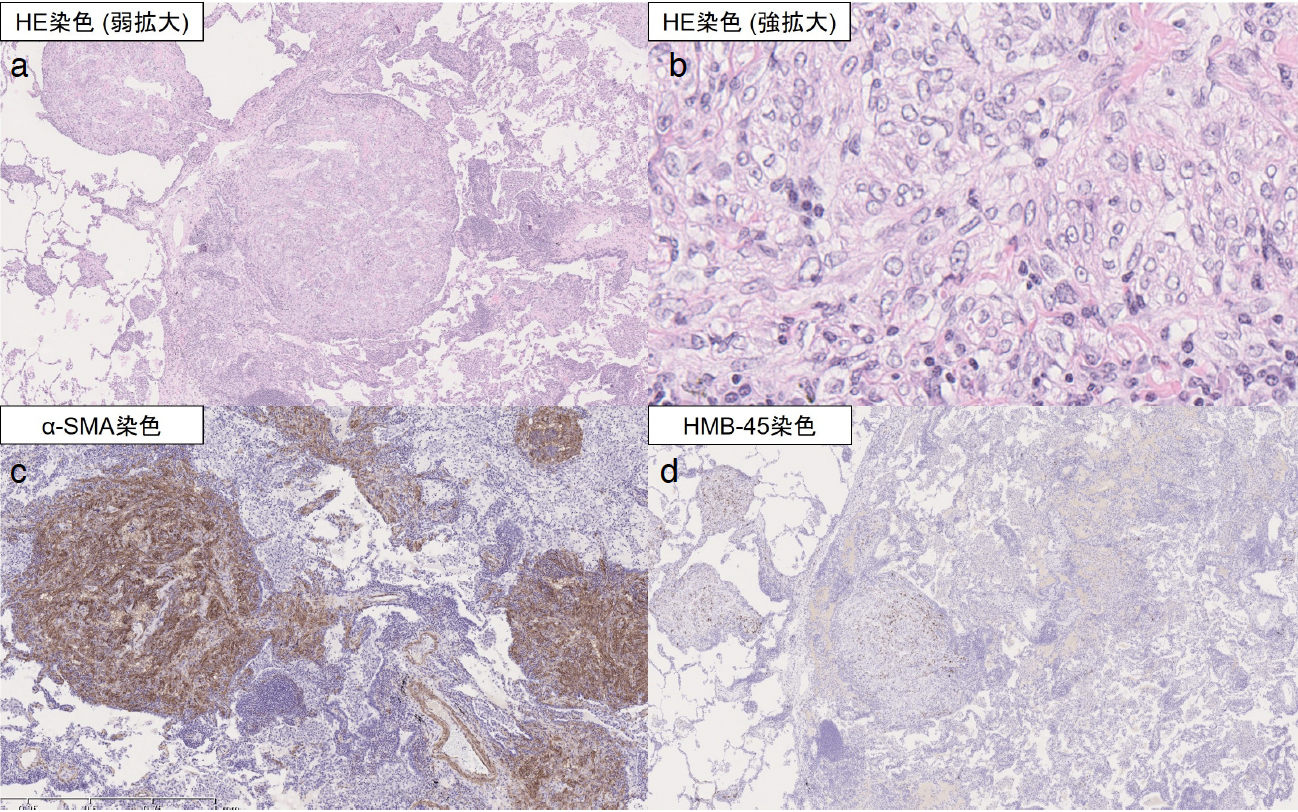
臨床経過:鑑別として2つの画像的特徴から検討した。まず肺の多発小結節を認めたため,肺癌および多発肺転移,粟粒結核を考えた。次に両側びまん性の多発性肺囊胞を認めたため,肺リンパ脈管筋腫症,濾胞性細気管支炎,リンパ球性間質性肺炎,Birt–Hogg–Dubé 症候群,肺ランゲルハンス細胞組織球症,アミロイドーシス等を検討した[3]。気管支鏡下肺生検を施行したが診断に至らなかったため,呼吸器外科に依頼して胸腔鏡下右肺部分切除術を施行した。病理学的所見では細気管支の周辺に平滑筋様細胞の結節性集簇を認め,免疫組織化学染色でα-SMAとHMB-45が陽性であり(図4),肺リンパ脈管筋腫症と診断した。estrogen receptorは陽性,progesterone receptorは陰性であった。手術から2週間後の胸部X線検査で右片側性胸水貯留を認めた。白色混濁の滲出性胸水でTG 2,559mg/dLと高値のため,乳び胸と診断した。胸水中にLAM細胞クラスターは認めなかった。術後合併症も検討し呼吸器外科に相談したが,肺結節を切除した部位を考えると可能性は低いとの判断であった。外来で内科的治療を行っていたが改善得られず,胸腔ドレナージを施行してピシバニール®で胸膜癒着術を行った。皮膚,網膜,神経系を含め明らかに結節性硬化症を疑う所見を認めなかったため,sporadic LAMと診断した[4]。厚生労働省指定難病のLAMの重症度分類でⅢ期と判断し[5],胸水コントロール目的にシロリムス1mg/日を開始した。明らかな副作用は認めず,治療開始半年後に施行した胸部CT検査では乳び胸水のコントロールは良好であり,右肺の多発小結節の消退傾向を認めた(図5)。
図4 肺生検での病理組織像
細気管支の周辺に平滑筋様細胞の結節性集簇を認め(a. HE染色,×40,b. HE染色,×400),免疫組織化学染色でα-SMA(c)とHMB-45(d)が陽性であった。
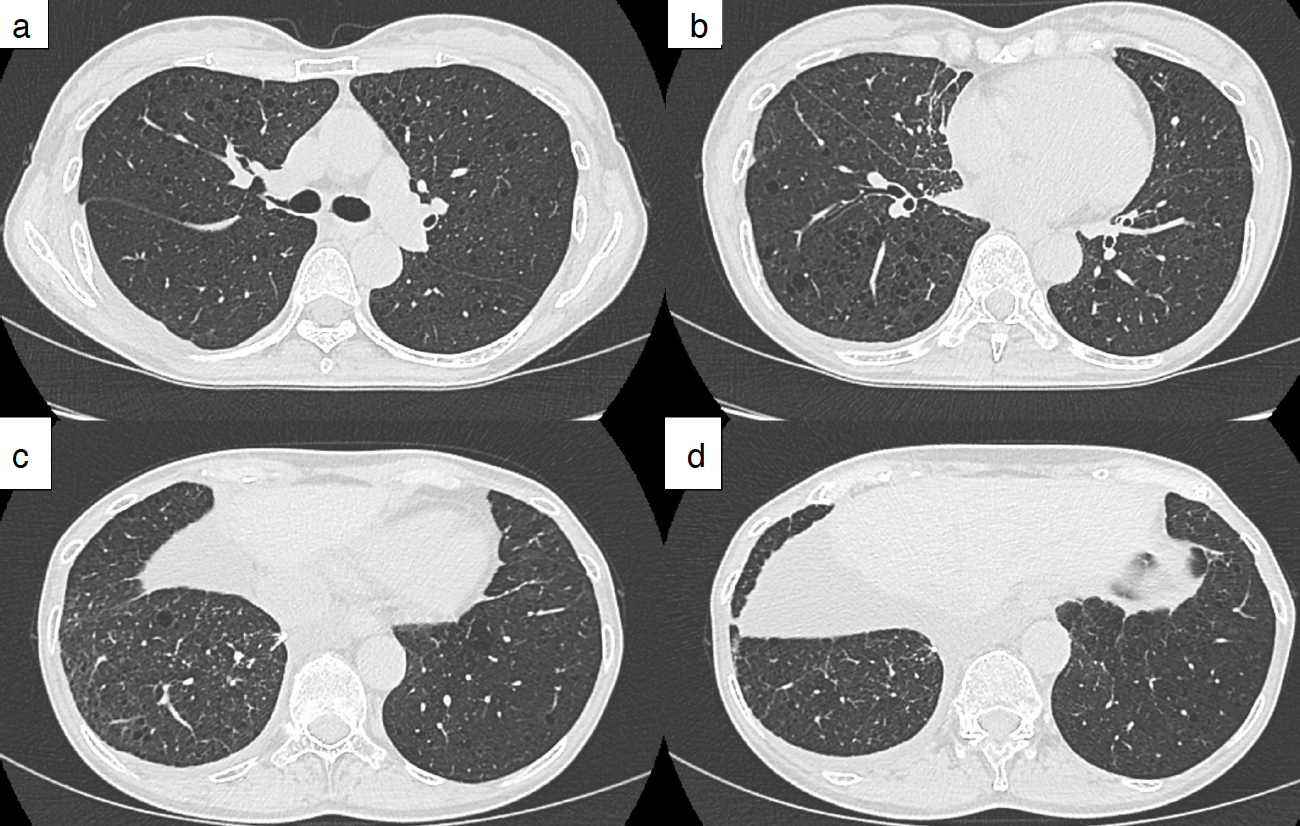
図5 治療開始から6カ月後の胸部CT
両肺の多発囊胞は著変なく残存している(a〜d)が,右中下葉の多発小結節は消退している(b〜d)。
本症例は右肺に多発した小結節を生検して肺リンパ脈管筋腫症と診断した1例である。肺リンパ脈管筋腫症の典型的な画像所見は境界明瞭な薄壁を有する囊胞(数mm~1cm大が多い)が両側性,上~下肺野にびまん性あるいは散在性に,比較的均等に,正常肺野内に認められる[2]。縦隔や後腹膜~骨盤腔のリンパ節腫大を認めることもある[2]。これらは肺外LAMの病変と考えられ,好発部位はリンパ管の解剖学的分布に関連している[6]。肺リンパ脈管筋腫症における肺の多発小結節は非典型的ではあるが,Sekimotoらにより孤発性のリンパ脈管筋腫症の272人のうちの6人(2.2%)に非石灰化の肺多発結節を認めたと報告されている[7]。この論文で提示された代表症例における結節は,大きさがいずれも1.5mm程度の小結節であった[7]。これらはすべて生検されてLAM細胞で構成されていたことが示されており本症例と合致するが,本症例では大きさが様々であり,壁に結節を伴う囊胞が複数認められている点がこれまでの論文で示されたLAMに合併した小結節と異なっており非常に特徴的と考えた。そのためリンパ脈管筋腫症の病変として報告されている肺の多発結節としても特徴が合致せず,リンパ脈管筋腫症も鑑別の1つに挙げながら肺生検を行った。生検した結節の免疫染色でα-SMA陽性の平滑筋様細胞を認めたことや,シロリムスでの治療半年後の胸部CT検査で多発小結節の消退傾向を認めたことから,自験例の多発肺小結節は肺リンパ脈管筋腫症の病変である可能性が推察された。
肺リンパ脈管筋腫症と関連のある多発肺結節に関しては,血管筋脂肪腫(angiomyolipoma:AML)と多巣性微小結節性2型肺細胞過形成(multifocal micronodular pneumocyte hyperplasia:MMPH)の2つが挙げられる。AMLは血管,平滑筋,脂肪組織から構成される非上皮性の良性腫瘍であり,腎発生が多く,肺での発生は稀とされている[8]。AMLとLAMの合併例は多く,リンパ脈管筋腫症では47~60%に合併するとの報告がある[9]。肺AMLは多発結節影を呈することがあり,造影CTで境界明瞭に造影され,造影形式としては内部均一なものもあれば不均一なものもあり様々なパターンを示すとされている[10]。また 肺AML は血管,平滑筋,脂肪組織の3つの成分から構成されており,脂肪成分の割合により違いはあると考えられるが,過去の肺AMLの報告の約半数で脂肪濃度を有する病変を認めるとされる[11]。画像検査のみでAMLを診断することは困難であり[10],免疫組織学染色ではα-SMA,HMB-45,Melan-Aが陽性となることが多いとされる[8][12]。MMPHは1991年にPopperらによって提唱された結節性硬化症に合併する肺病変で[13],病理学的特徴はⅡ型肺胞上皮の過誤腫性増殖で前癌性病変の性格はないとされ[14],組織学的特徴は境界明瞭で線維性に肥厚した肺胞壁に異形性の乏しいⅡ型肺胞上皮様細胞が増殖しているものである[15][16]。1998年にMuirらが14例をまとめた際にはmicronodular pneumocyte hyperplasia(MNPH)と名付けられた[17]。現在多発病変はMMPHと呼ばれることが多い[19]。MMPHの発生頻度は結節性硬化症に合併するLAMの頻度(0.1〜1%)よりも低いとされている[14]。画像所見上は胸部X線でびまん性の小粒状・網状影を呈し,胸部CTでは石灰化を伴わない小粒状影が全肺野にびまん性にみられ,上葉・肺野末梢に多い傾向にあるとされる[18]〜[21]。MMPHはリンパ脈管筋腫症と共に結節性硬化症に併発するとされているが,LAMとMMPHが併発する症例や孤発性のLAMに併発する症例も報告されている[17]。そのため本症例でも鑑別に該当するが,MMPHは一般的に免疫染色においてサイトケラチン,epithelial membrane antigen(EMA),サーファクタントに陽性でCEA,αSMA,HMB-45などでは陰性とされており[17][22],本症例では免疫染色でα-SMA・HMB-45共に陽性であり,MMPHとは異なると考える。両者ともLAMとの合併を認める疾患であり,LAM患者の診療にあたり肺多発結節を認めた場合に鑑別として考慮する必要があると考える。
今回我々は右肺片側の多発小結節を契機にLAMの診断に至った症例を経験した。孤発性のリンパ脈管筋腫症で肺多発小結節を来し外科的肺生検で診断された症例の報告もあるが,これまでに報告された症例と比較して本症例では画像所見が非常に特徴的であると考えた。また治療経過中に乳び胸を来した後に薬物治療で消退傾向を示した点についての報告例はなく,リンパ脈管筋腫症における一連の病態である可能性も考えられた。
利益相反:本症例報告に関して申告する利益相反はない。
The patient in this case was a 61-year-old female who presented with abnormal findings on a routine chest X-ray examination. A subsequent chest CT scan revealed multiple small nodules in the right middle and lower lobes of the lung. Despite undergoing bronchoscopy, a definitive diagnosis could not be established. Consequently, the patient underwent thoracoscopic-assisted partial resection of the right lung, leading to a diagnosis of pulmonary lymphangioleiomyomatosis. Postoperatively, the patient developed chylothorax on the right side, which necessitated pleurodesis with Picibanil® and the initiation of oral sirolimus therapy. On the follow-up chest CT scan performed six months after treatment, the multiple small nodules were found to have regressed, suggesting that these nodules were consistent with lesions of pulmonary lymphangio-leiomyomatosis. We report a case of pulmonary lymphangioleiomyomatosis presenting with multiple small nodules predominantly in the right lung.