•Nature
1)免疫学:Article
糖尿病におけるウイルス易感染性の要因となる肺樹状細胞代謝(Lung dendritic-cell metabolism underlies susceptibility to viral infection in diabetes) |
COVID-19流行当初から糖尿病は重症化リスク因子の1つとして挙げられている。また研修医のころから重症呼吸器感染症管理の際には血糖コントロールの重要性を教えられてきた。そのコンセプトのもとに臨床試験も行われ
TJH253で紹介のNEJMでも取り上げられている。臨床的にもその理由としては微小血管障害の影響や好中球機能などの自然免疫系の障害が原因として説明されてきたが,今回イスラエルのグループからは樹状細胞の高血糖による細胞内代謝の変化が獲得免疫系に影響することによりウイルス感染症の重症化に寄与するであろう結果が報告されている。本報告は
西川先生のAASJでも取り上げられている。本編だけでなく多くの重要な結果が補足情報で示されており,大変多くの実験で確認されたことがわかる。
複数の糖尿病(DM)モデルマウスを用いているが,主な検討では遺伝的DMモデルである秋田マウス,ストレプトゾトシンによる薬剤誘発モデルマウスの2種を用いている。高血糖が呼吸器ウイルス感染症〔マウスインフルエンザウイルス(IAV)とマウス肺炎ウイルス(PVM)〕の重症化を来すことを各モデルマウスで確認した後に,肺内へのCD8,CD4リンパ球浸潤の減少とウイルス特異的抗体価の低下が生じていることを示し,それらがインスリンによる高血糖是正で回復することを確認した(
Fig.1)。これらのデータからは高血糖によるウイルス感染症の重症化には獲得免疫系の抑制が寄与し治療可能であることが示唆される。
次に定常状態と高血糖状態における呼吸器ウイルス感染時の肺細胞プロファイルを比較するためにscRNA解析が行われている。重要な知見として高血糖マウスにおいてウイルス感染時には標準型Ⅰ型樹状細胞(cDC1)の数が有意に減少していた(
Fig.2b)ばかりでなく,定常状態においても肺DCサブセット数が減少していることが見出された。さらに,インスリンで高血糖を是正するとその数的異常が改善することも示されている(
Fig.2c)。
続いて,DCの機能解析である。抗原の取り込み,所属リンパ節への移動,抗原提示能,リンパ球増殖能などを解析しているが,用いたモデルは卵白アルブミン抗原特異的TCRを発現するOT1,OT2マウス,蛍光抗原付きOVA,ダニ抗原(HDM)気道アレルギー性炎症モデルである(
Fig.3,
ExFig.9)。結果は高血糖状態においてDCの抗原取り込み能は低下なく,所属リンパ節への移動数が減少すること。供刺激分子であるCD40, CD80, CD86などの発現が低下すること,HDM喘息モデルでは惹起される好酸球性炎症が抑制されることが示された。リンパ球増殖能を確認するin vitroの実験として,肺DCを定常もしくは高グルコース状態で培養したのちのCD4,CD8T細胞の増殖誘導能をみているが,ともに低下することを見出している。さらにはDC枯渇モデルを用いて呼吸器ウイルス感染の影響をみたところ,高血糖の影響が解除されることも示している。以上より,高血糖は肺DCの機能的欠損を引き起こし,結果として感染性,非感染性にかかわらず炎症環境における獲得免疫活性に大きな影響を及ぼすことが明らかとなった。
次に,マクロファージやT細胞の免疫細胞ではすでにグルコース代謝と免疫機能の間に関連があることが報告されていることから,このDC機能異常の要因として細胞内糖代謝に注目をして解析を進めている。細胞内糖代謝(
解答系とクエン酸回路)を思い浮かべながら読んでほしいが,高血糖マウスの肺DCでは基質が沢山あるにもかかわらず解答系産物である乳酸産生量は増えず,クエン酸回路の入り口であるアセチルCoAが蓄積していることが明らかとなった(
Fig.4a,b)。アセチルCoA生成を抑制する処理を行うと,高血糖時にみられたDCの機能異常によるT細胞の増殖能やIFNγ産生能は回復すること(
Fig.4d,e)が確認されている。
アセチルCoAの増加はヒストンのアセチル化を促進する可能性があることからepigeneticな遺伝子発現調節に影響を及ぼすことが考えられる。実際に解析を行うと,高血糖マウスのDCにおけるヒストン修飾解析ではアセチル化を促進する方向に偏っていること(
Fig.4f, g, Ext Fig.12l,m)が見出された。さらに,アセチル化阻害薬を用いた場合にはin vitroでのCD8T細胞刺激作用の回復,in vivo における呼吸器感染ウイルス時のウイルス排出の改善と,獲得免疫能の回復が確認された(
Fig.4i, j)。
今回の報告は,高血糖によるDCの代謝リプログラミングが,獲得免疫系に大きな影響を与えることで呼吸器ウイルス感染症の重症化を引き起こすことと,その治療介入の可能性を示した。特異的にヒストンアセチル化をコントロールできるような薬剤があれば良いのだろうが,それを待ちながら,ベッドサイドでは重症コロナ症例での血糖コントロールの重要性を口酸っぱく伝えていこうと思う。
•Sci Adv
1)免疫学:Research Article
JAK3阻害薬が多能性ILC2を抑制してステロイド抵抗性喘息を改善する(JAK3 inhibitor suppresses multipotent ILC2s and attenuates steroid-resistant asthma) |
高用量吸入ステロイドでもコントロールの得られない喘息が10%弱存在し重症喘息と言われてきた。全身性ステロイドを使用することにより改善する例もあるが,ご存知のように有害事象は看過できない。そこでバイオ製剤の開発が進んで現在に至るというのが喘息診療の進歩である。そもそも気道のⅡ型炎症が喘息の主たる病態であり単純に考えた場合にはステロイドは効くはずなのだが,抵抗する例では何が起こっているのかのメカニズムは完全には解明されていない。このⅡ型炎症には獲得免疫系であるTH2と自然免疫系であるⅡ型自然リンパ球(ILC2)が関わることが明らかになっており,10年ほど前にILC2の発見者である現大阪大学の茂呂先生,現慶応大学呼吸器内科の加畑先生らが上皮サイトカイン(IL33とTSLP)の存在下ではILC2はステロイドによる細胞死に抵抗性を来すことを報告していた。今回韓国のグループからそのILC2がステロイド抵抗性を獲得する際に重要な分子経路としてJAK3の関与を同定し報告している。
喘息モデルとしてはオーソドックスなOVAモデルを用いて研究が始められている。単純なOVAモデルでは気道過敏性(AHR),気道好酸球浸潤を生じ喘息を発症するが,デキサメサゾン(DEX)投与によりそれらがリバースされること,またTh2,ILC2ともにDEXにより数の減少とⅡ型サイトカイン産生能が抑制されることを確認している。その上でOVAに加え,IL33を気道内投与するモデルでは,DEXによるリバース効果が消失すること,TH2は抑制されるもののILC2はDEX抵抗性となることを示した(
Fig.1)。次に
Fig. 2では感作無しで複数のアラーミン(IL33とTSLP)を気道内投与することにより好酸球性気道炎症を伴う気道過敏性を発症すること,それはDEXによってリバースされないこと,Th2ではなくILC2が濃厚に関わっていることを示している。併せて,以前の報告同様にin vitroにおいて,IL33単独の刺激ではICL2にステロイド抵抗性を誘導することはできず,IL2/IL7で同時に刺激することによりステロイド抵抗性を獲得することをマウス,ヒト検体(
Fig.3)で確認している。
ここまでは今までもある程度知られていた事実であるが,ここからはILC2の治療抵抗性獲得を説明するメカニズムの解析が行われている。まずはIL33/2/7で誘導されるILC2の特徴として,IL5/13といったⅡ型サイトカインだけでなくⅢ型サイトカインと呼ばれるIL17Aの産生能を持つことが明らかになり,これは多能性ILC2と考えられた(
Fig.5)。また,このILC2の特徴的なシグナル経路を同定するためにパブリックデータベースからILC2のRNAseqデータを抽出・検討したところ,IL-33下流のシグナル経路ではなく,JAK/STAT経路の遺伝子発現が亢進していることが明らかとなった(
Fig.4a)。さらに,JAK3の選択的阻害薬を用いたところ,ILC2の増殖抑制,Ⅱ型サイトカイン産生抑制が確認されたばかりか,細胞死が誘導されることが確認された(
Fig.4)。以上の結果から,上皮サイトカインに加え複数のサイトカイン刺激があること(IL33/2/7)によりILC2はステロイド抵抗性を獲得した多能性ILC2となること,その機能維持にはJAK3の関与するシグナル伝達が関与することが明らかになった,
JAK3阻害薬による治療の可能性を探るために2つのマウス喘息モデルで検討を行っている。1つ目はRag欠損マウスによるアルテリナリア誘発喘息モデルであり,これはT細胞の影響を排除し純粋にILC2への効果を確認するための実験である。結果はJAK3阻害薬の胃内投与により,多能性ILC2は抑制されAHR,好酸球性気道炎症も抑えられることが示された(
Fig.6)。2つ目はOVA/IL33モデルである。こちらでは好酸球性気道炎症としてTH2,ILC2両者が関わる。ここにJAK3阻害薬のみではTH2が抑制できなかったが,DEXと併せて投与することにより多能性ILC2の抑制と同時に喘息表現型の改善が得られることが示され(
Fig.7),当初の問題であったステロイド抵抗性喘息の改善が達成される可能性が示唆されたことになる。
JAK3阻害薬は他疾患では臨床応用が行われているものもあり,現在のバイオ製剤と異なり経口投与も可能であることから重症喘息治療においても期待できるのかもしれないと感じた。
•Lancet
1)気候変動
ランセット・カウントダウン2023(The 2023 report of the Lancet Countdown on health and climate change: the imperative for a health-centred response in a world facing irreversible harms)
|
温室効果ガスによる地球温暖化が世界的な興味を集めていることは皆さんご承知のことと思う。医師としては職業的に無関係の分野かと思われるかもしれないが,欧州では温暖化に対する警鐘をならすオピニオンリーダーの中には私たちの同業者が含まれていることはご存知だろうか。NEJM誌と並ぶ臨床系医学雑誌の最高峰であるランセット誌は2015年から人類社会による気候変動によるグローバルヘルス(世界の人々の健康)への影響を分野を超えた国際的な協力(
ランセット・カウントダウンという取り組み)を通じて独自に評価,その結果をとして毎年レポートしている。
2023年のレポートは本編が40ページからなる。冒頭にExecutive summaryとして以下の項目が解説されている。
- 気候変動による健康被害の増加
- 継続的な不作為による人的コスト
- 誤った方向で加速する世界
- すべてのヒトに健康な未来をもたらす機会
- 人間を中心におく変革:健康を気候変動対策の中心に据える
気候変動(温暖化)の影響として理解しやすいものとしては,気温の上昇に関連する死亡者数は1990年から2000年と比較すると85%増加しており,気候変動がなかった場合に予測される38%の増加を大幅に上回っている。異常気象による食料不安からの栄養失調の影響は途上国では大きな問題であること。また,通常は見られない熱帯地域の節足動物媒介感染症が温帯地域でも見られるようになっていること,実際に2015年に代々木公園を中心としてデング熱が日本でも複数発生したのは記憶に新しい。
呼吸器関連疾患では,2020年には化石燃料由来の大気汚染により1800万人が死亡している。途上国では家庭内での燃料をバイオマス(動植物由来の資源)に頼るところが96%に達し,分析が行われた国では,一般家庭における空気中の微小粒子状物質がWHOの安全基準の30倍であった。さらにその影響で住民10万人あたり140人が死亡していると見込まれている。
また,医療とは直接的には関係のないことかもしれないが,世界での取り組みは停滞していることが紹介されている。世界的な化石燃料の高騰により,石油・ガス会社は4兆ドルもの利益を手にしたが,再生可能エネルギーへの転換のための資本投資としては約4%のみしか当てていない。金融面から産業を支える民間銀行のうち55%が化石燃料関連に融資を増やし,各国政府は保険関連予算と比較しても相当な補助金を関連予算として計上していることが報告されている。
ランセット・カウントダウンではこういった,5つの主な領域(気候変動による影響・曝露・脆弱性,健康への適応・計画・柔軟性,気候に対する緩和行動と健康上の共通するベネフィット,経済と金融,パブリックエンゲージメントと政治的関与)における43の指標を追跡したデータが例年紹介されている。一貫したテーマとしては気候変動が健康に及ぼす影響の不均衡さへの警鐘である。
グローバルヘルスへのリスクとして気候変動を認識することは,空調の効いた院内で仕事を進めることが通常である私達にも必要であり,自分事として考えていくことがこれからの医療者としての求められる視点であることを教えられる。年末に世界の一般教養として紹介をしてみた。
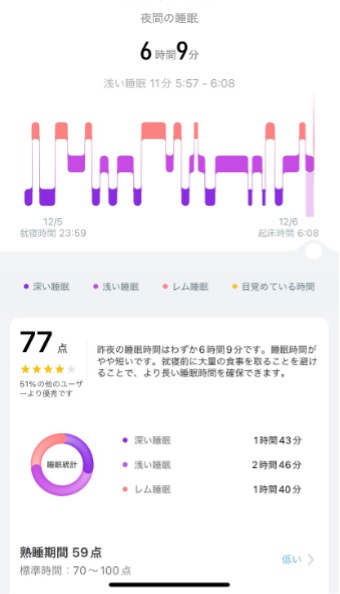
今週の写真:私の睡眠モニタリング
とある日の睡眠状況です。最近スマートバンドなるものを購入してみました。どうやってモニタリングをしているのかはわかりませんが,睡眠の質判断をしてもらえます。 ちなみにSpO2の低下はなく息は止まっていなそうです。 私はよく休めてますでしょうか? 詳しい方からの見解をお待ちします。 |
(坂上拓郎)