•Nature
1)免疫学
ILC2由来のLIF(白血病阻止因子)が局所免疫から全身性免疫への進展を司っている(LC2-derived LIF licences progress from tissue to systemic immunity) |
アレルゲンやウイルス曝露後の肺組織局在性の免疫応答から全身性免疫応答への進展には,免疫細胞のhomingやtraffickingなどの移行が大きく関与している。肺内においてCCL21ケモカイン-CCR7ケモカイン受容体経路が破壊されると,樹状細胞(DC)や抗原特異的T細胞やB細胞は二次リンパ器官(所属リンパ節)に移動して増殖してから炎症組織に戻るのではなく,肺内にとどまって誘導性気管支傍リンパ装置(iBALT)として三次リンパ組織(TLS)を形成することは以前から報告されてきた。本研究は英国ケンブリッジ大学からの報告で,これらのhomingやtraffickingにILC2が関わり,特に白血病阻止因子LIF(
Wiki)の存在が大きいことを報告している。
まず,IL-33刺激下でもILC2欠損マウスではpDC(plasmacytoid DC)を誘導せず,pDC制御にILC2が重要であることを示している(
Fig. 1)。そのpDCとILC2との関係性において,ILC2が発現するLIFの存在に着目している。ILC2由来のLIFの役割を調べるために,リンパ球中のLIFを欠損させるために,
IL7rCreLifflox/ flox(LIF-cKO)マウスを作製している。そのLIF欠損マウスにIL-33を経鼻投与しても,BALF中のLIF濃度は低下し,縦隔LN中のpDCも減少したが,肺内でのpDCは減少しなかった。それはILC2由来のLIFが,IL-33に応答して産生され,肺組織と縦隔LNのDC割合を制御していたためであった。ILC2由来のLIFがリンパ管内皮細胞を刺激してCCL21を産生させ,CCR7
+免疫細胞(pDCを含む)のLNへの移行を制御させている機序のようだ。
興味深いのは,ウイルス感染に対するLIF欠損マウスでみられる一次免疫反応の欠陥が,30日後の再度の二次感染によって免疫応答が成立するかを調べている(
Fig. 5)。ILC2欠損およびLIF欠損マウスにマウス肺炎ウイルスを再感染させるが,縦隔LNでのDCやB細胞を含むCD45
+免疫細胞数は減少,かつB細胞欠乏により循環血清中IgEは減少している。つまり,ILC2由来のLIFが欠損していると,獲得免疫は生成できないことを示している。さらに,LIF欠損マウスに,アルテルナリア(喘息やアレルギー性鼻炎などの原因になる真菌:2型炎症アレルギーモデルでも抗原としてよく使用される)の経鼻投与を繰り返しても2型炎症でみられる肺内の好酸球,好中球,肺胞マクロファージおよび単球には変化がなく,縦隔LN内でも免疫細胞は少ない。しかし,肺内でのiBALTの形成はみられていて,これは慢性2型炎症でもみられる組織局所性の不適切な免疫応答を示している。そしてIgEが減少しているような全身性の免疫反応は障害されているような状況である。
ILC2由来のLIFは,免疫細胞の肺からの移行を制御して,組織局所性免疫か全身性免疫か,肺におけるアレルゲン応答性とウイルス応答性のバランスを調節している役割を担っていたのである。
*ILC2に関しては,大阪大学免疫学フロンティア研究センターの
サイトを紹介したい。
•Sci Transl Med
1)アレルギー学
ストレスによる好酸球活性化は肺切除後の罹患率と死亡率に関与する(Stress-induced eosinophil activation contributes to postoperative morbidity and mortality after lung resection) |
肺切除後の急性肺障害の病態を解析した,臨床的に非常に興味深い研究で,米国メリーランド大学からの報告である。肺葉切除など胸部手術後に合併症として生じてしまう呼吸不全,明らかな感染症でもなく原因不明の症例も経験するであろう。片肺切除のマウスモデルと,肺および腹部臓器の切除後の患者末梢血を用いて,その病態を分析している。その病態にはリンパ球ストレス監視機構とも呼ばれるγδT細胞(
リンク,
Wiki)が関与しているというのが注目すべき結果ではないだろうか。マウスの片肺切除を切除すると,γδT細胞によるIL-7の産生が増加し,ILC2が局所的にも全身性にも活性化されていた。その過程で肺に常在する好酸球が活性化され,GM-CSF(顆粒球マクロファージコロニー刺激因子)依存的に骨髄でのストレス誘発性好酸球成熟が促進され,マウスでもヒトでも全身性の好酸球増多が生じてた。肺常在好酸球における誘導性一酸化窒素合成酵素のアップレギュレーションは,組織のニトロシル化,肺水腫,低酸素症を引き起こし,致死性の状況にもなる。しかし,この活性化カスケードをどの段階でも阻害することで,マウスモデルにおける肺切除後の生存率は改善傾向を示していた(
Fig)。
術後の呼吸不全は,腹部手術より胸部手術後に多い。その原因不明な急性肺障害に対してILC2を介した好酸球浸潤が病態に大きく関わっているのであれば,術前および周術期の好酸球を標的とした治療的介入を検討する臨床的意義が生まれる。今後,臨床試験が行われる可能性が高く,それにとって重要な情報になる結果ではないだろうか。
*IL-7と,IL-7産生型のγδT細胞について,京都大学ウイルス再生医科学研究所の
説明がわかりやすい。
•NEJM
1)腫瘍学
切除不能 III 期 EGFR 変異陽性 NSCLC に対する化学放射線治療後のオシメルチニブの有効性(Osimertinib after chemoradiotherapy in stage III EGFR-mutated NSCLC) |
切除不能III期EGFR変異陽性NSCLCに対する化学放射線治療とオシメルチニブ(EGFRチロシンキナーゼ阻害薬)併用の有効性を検証した第3相二重盲検プラセボ対照の国際共同試験である。主要評価項目は無増悪生存期間としている。2018~2022年までの期間に登録された216例を対象に,オシメルチニブ群(143例)とプラセボ群(73例)に無作為に割り付けられた。
無増悪生存期間の中央値はオシメルチニブ群39.1カ月に対して,プラセボ群5.6カ月であり,病勢進行または死亡のハザード比は0.16(95%信頼区間 [CI] 0.10~0.24,p<0.001)と,オシメルチニブ群で有意に延長していた(
Fig. 1)。そして,12カ月無増悪生存率はオシメルチニブ群74%(95%CI 65~80)に対して,プラセボ群22%(95%CI 13~32)であった。また全生存の中間データ(成熟度20%)は,36カ月全生存率はオシメルチニブ群84%(95%CI 75~89),プラセボ群74%(95%CI 57~85)で,死亡のハザード比は0.81(95%CI 0.42~1.56,p=0.53)である。グレード3以上の有害事象の発現率は,オシメルチニブ群35%,プラセボ群12%であり,放射線肺臓炎(大部分がグレード1または2)は,それぞれ48%と38%であった。新たな安全性の懸念は認められていない。
本臨床試験では,アジア人が80%を占め,Exon 19 deletionが5割強,L858R mutationが4割強を占めていた。ハザード比に関連するサブ解析(
Fig. 2)において,最もリスク比が低かったのはExon 19 deletion(+)でHR 0.17,それに比してL858R mutation(+)はHR 0.32であった。また65歳未満でHRは低い傾向であった。
オシメルチニブは,切除されたEGFR変異陽性NSCLCの術後補助療法としても推奨されているが,Ⅲ期での化学放射線治療との併用においても臨床的な有効性が明らかにされている。
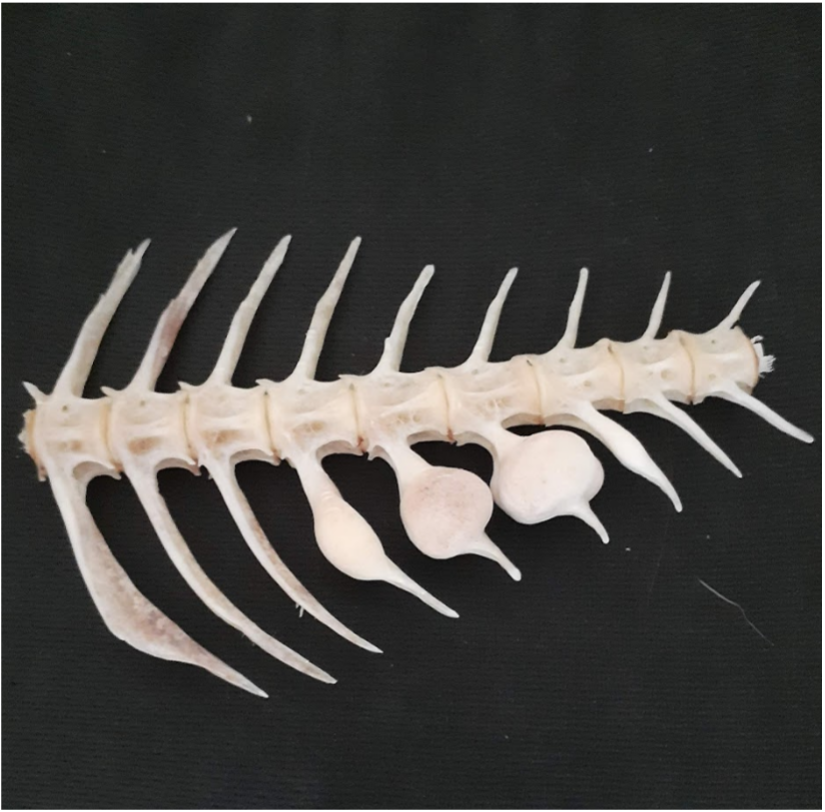
今週の写真: 「鳴門骨」と呼ばれている真鯛の珍しい変形骨,珍しいので縁起物とされています。 鳴門の荒波での骨折跡と言われていますが,実は骨腫(良性腫瘍)のようです。 捌いた刺身は美味しくいただきました。 |