佐々木寿*,宮田 純*,西村匡司*,槇 陽平*,田上陽一*,濱川侑介*,君塚善文*,林 伸好*,藤倉雄二*,川名明彦*
*防衛医科大学校内科学講座(感染症・呼吸器)(〒359-8513 埼玉県所沢市並木3-2)
Isolated adrenocorticotropic hormone deficiency due to pembrolizumab in a case of lung squamous cell carcinoma
Hisashi Sasaki*, Jun Miyata*, Masashi Nishimura*, Yohei Maki*, Yoichi Tagami*, Yusuke Hamakawa*, Yoshifumi Kimizuka*, Nobuyoshi Hayashi*, Yuji Fujikura*, Akihiko Kawana*
*Division of Infectious Diseases and Respiratory Medicine, Department of Internal Medicine, National Defense Medical College, Saitama
Keywords:免疫チェックポイント阻害薬,抗PD-1抗体,ペムブロリズマブ,免疫関連有害事象,ACTH単独欠損症/immune checkpoint inhibitor, anti-PD-1 antibody, pembrolizumab, immuno-related Adverse Event, isolated adrenocorticotropic hormone deficiency
呼吸臨床 2019年3巻12号 論文No.e00093
Jpn Open J Respir Med 2019 Vol. 3 No. 12 Article No.e00093
DOI: 10.24557/kokyurinsho.3.e00093
受付日:2019年9月2日
掲載日:2019年12月3日
©️Hisashi Sasaki, et al. 本論文はクリエイティブ・コモンズ・ライセンスに準拠し,CC-BY-SA(原作者のクレジット[氏名,作品タイトルなど]を表示し,改変した場合には元の作品と同じCCライセンス[このライセンス]で公開することを主な条件に,営利目的での二次利用も許可されるCCライセンス)のライセンシングとなります。詳しくはクリエイティブ・コモンズ・ジャパンのサイト(https://creativecommons.jp/)をご覧ください。
患者:60歳,男性
主訴:全身倦怠感
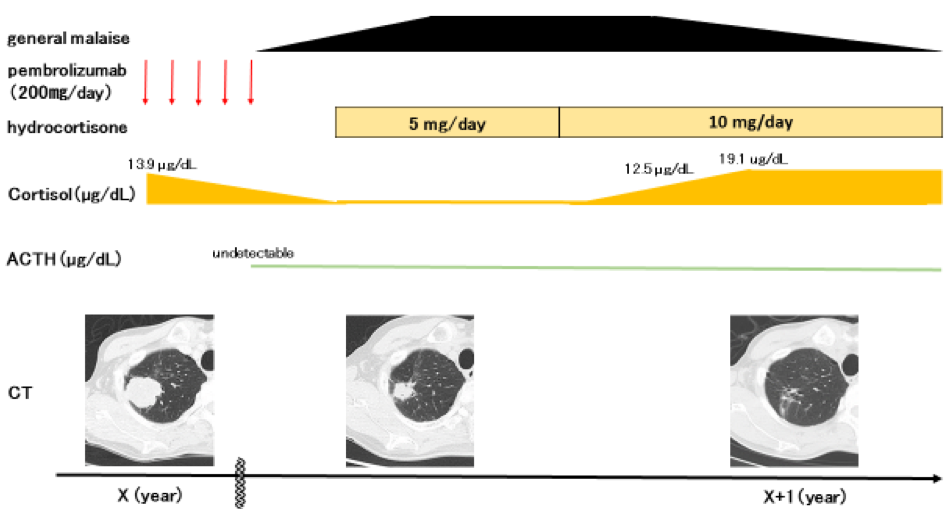
現病歴:X−1年に右頸部リンパ節腫脹を認めた。同部位よりリンパ節生検を施行し,扁平上皮癌と診断した。PET-CT,頭部MRIによる全身検索の結果,右上葉S1原発の肺扁平上皮癌〔cT2aN3M1c stage IVB(LYM,OSS)〕と診断した。腫瘍細胞のPD-L1発現率が50%以上であったため,X年3月より1次化学療法としてペムブロリズマブ(200 mg/day)の投与を開始した。2コース目投与時点で,胸部CTにて,原発巣の縮小を認め,RECIST上PRであった。5コース目投与後に全身倦怠感を認めたため,当科外来に受診した。
既往歴:60歳時,外傷性くも膜下出血(保存的に加療された。リハビリにて,ADLが自立するまで回復した)
喫煙歴:前喫煙者,1日20本×30年(10年前から禁煙)。
飲酒歴:機会飲酒
入院時現症:体温 36.8℃,血圧 113/48 mmHg,脈拍 105/分・整,呼吸数 18/分,SpO2 98%(室内気)。右頸部リンパ節の腫脹を認める。呼吸音左右差なく,ラ音を聴取しない。神経学的所見に異常を認めない。その他,四肢・体幹に色素沈着等の異常所見を認めない。
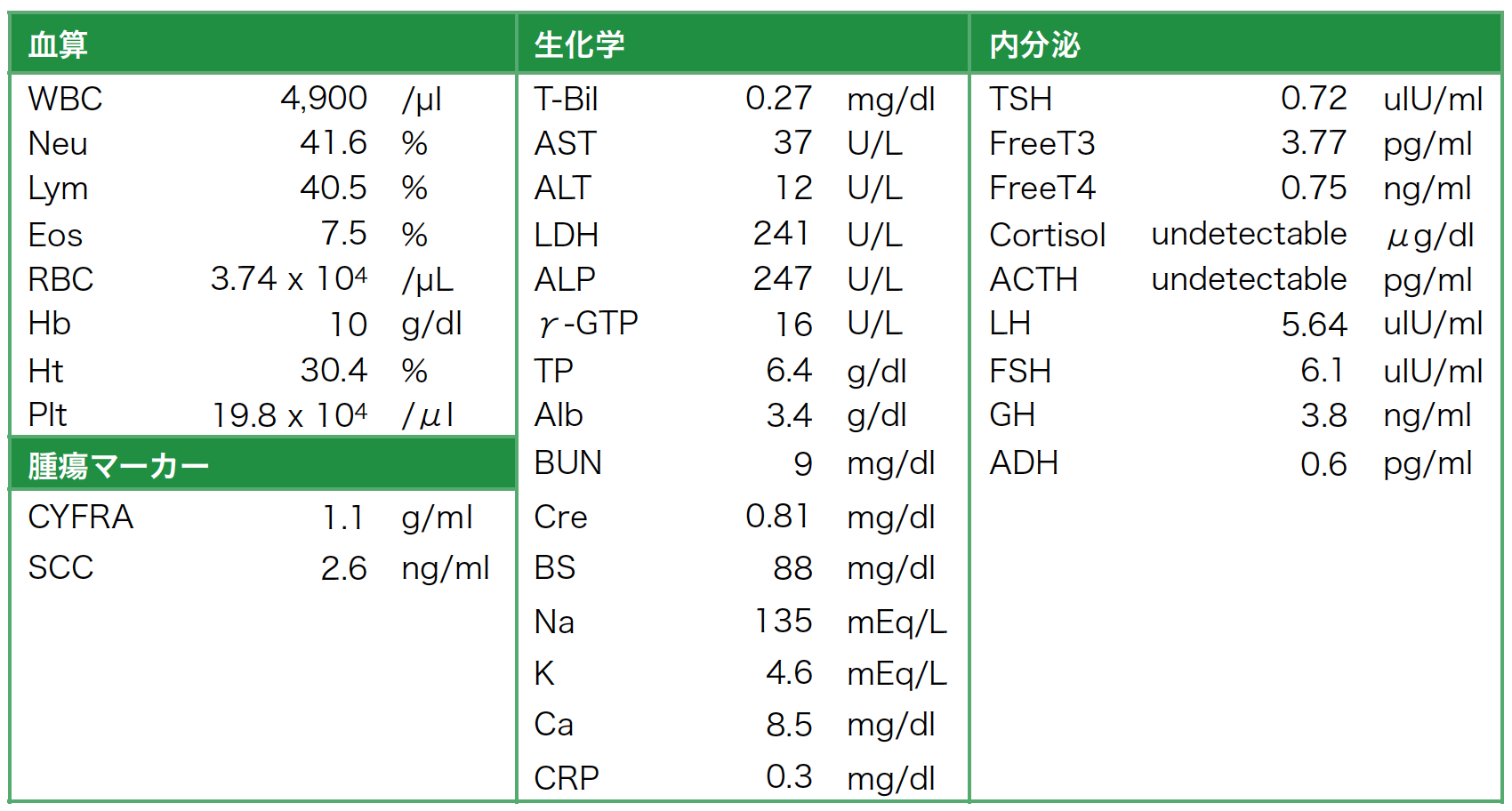
血液学的検査所見(表1):腫瘍マーカー(SCC)の高値を認める。血算では好酸球増多と貧血を認める。電解質異常と低血糖は認められない。内分泌学的検索において,血清コルチゾール値,血清ACTH値は検出感度以下であった。GH値は軽度高値であったが,その他の下垂体ホルモンの値は正常範囲内であった。なお,ペムブロリズマブ導入時は,血清コルチゾール値は13.9 µg/dlと正常値であった。
表1 外来受診時血液検査所見
腫瘍マーカー(SCC)の高値を認める。血算では好酸球増多と貧血を認める。電解質異常と低血糖は認められない。内分泌学的検索において,血清コルチゾール値,血清ACTH値は検出感度以下であった。その他,GH値は軽度高値であったが,その他の下垂体ホルモンの値は正常範囲内であった。
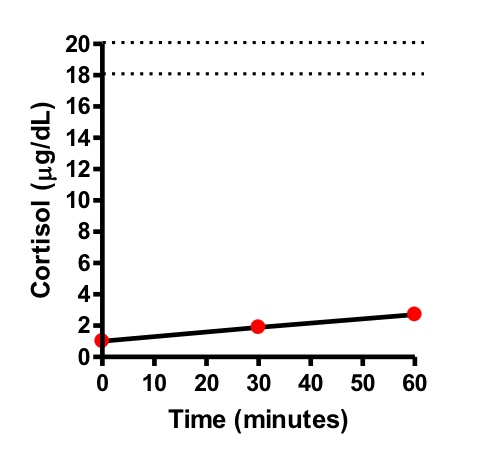
ACTH迅速負荷試験(図1):30分,60分で血清コルチゾール値は増加せず(18〜20 µg/dl),反応性の低下を認めた。
図1 ACTH迅速負荷試験
ACTH(合成ACTH製剤 250 µg)を静注後,30分後と60分後に血清コルチゾール値を測定した。正常の副腎皮質機能であれば,負荷後に血清コルチゾール値は18~20 µg/dlに増加するが,本症例の場合は増加が認められず,低反応であると判断して続発性副腎皮質機能低下症と診断した。
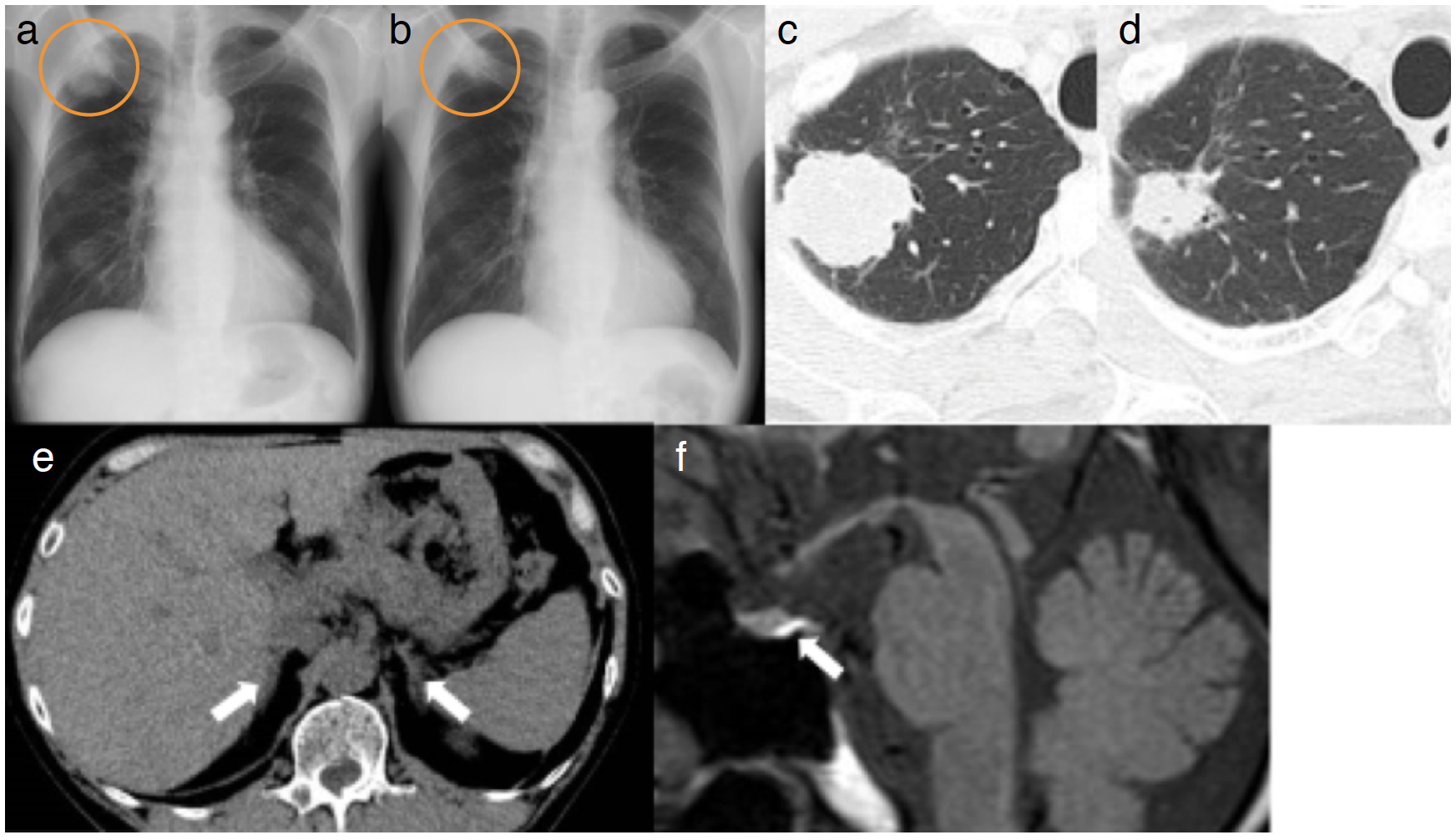
胸部X線:診断時,右上肺野に36mm大の腫瘤影を認める(図2a)。治療導入2カ月後,右上肺野の腫瘤影は縮小している(図2b)。
胸部CT:診断時,右上葉S1に辺縁不整,境界比較的明瞭な36mm大の腫瘤影を認める(図2c)。治療導入2カ月後;継時的に原発巣の縮小を認める(図2d)。
腹部CT:両側副腎の腫大を認めない(図2e)。
頭部MRI:下垂体,下垂体柄の腫大を認めない。下垂体後葉はT1強調で高信号であり,正常所見である(図2f)。その他,脳実質内に局所病変を認めない。
図2 画像所見
a, b. 胸部X線:経時的に右肺上葉S1の腫瘤影の縮小を認める。
c, d. 胸部CT:経時的に右肺上葉S1の腫瘤影の縮小を認める。
e. 腹部CT:両側副腎の明らかな腫大を認めない。
f. 頭部MRI(T1強調画像):下垂体,下垂体柄の腫大を認めず,下垂体後葉は高信号であり,正常所見である。その他脳実質内に局所病変を認めない。
近年多くの癌治療において免疫チェックポイント阻害薬の使用が普及しており,免疫関連有害事象に関する報告も増加傾向である。免疫関連有害事象として,倦怠感・掻痒症・下痢・貧血・甲状腺機能障害・間質性肺炎の頻度が多い[6]。下垂体機能障害はまれな有害事象であり,代表的な臨床試験の報告では,その頻度は0.6%(154例のペムブロリズマブ投与例において1例)と報告されている[1]。免疫チェックポイント阻害薬の中では,抗CTLA-4抗体であるイピリムマブによるIAD[7][8],抗PD-1抗体であるニボルマブによるIAD[9][10][11]がそれぞれ報告されている。頻度としては,イピリムマブに比べ,ニボルマブの報告例が多いが,ペムブロリズマブによるIADの報告例はない。本症例に関しては,薬剤性以外の原因は否定的であり,ペムブロリズマブの自己免疫性機序によるIADと診断した。
過去の文献では,非小細胞肺癌の治療として免疫チェックポイント阻害薬の投与後に何らかの免疫関連有害事象を発症した群の方が,発症しなかった群と比較して,生存率が有意に優れていたとの報告もある[12]。この事実は,免疫関連有害事象の発症自体が抗腫瘍効果を予測する指標となりうる可能性を示唆している。実際に免疫関連有害事象を認めた本症例においても,ペムブロリズマブ投与により良好な抗腫瘍効果が得られている。しかしながら,本症例に認めたIADは免疫チェックポイント阻害薬の使用例における報告が非常に少ないため,この有害事象に特異的な抗腫瘍効果との関連性は現時点では不明であり,今後も症例の蓄積が望まれる。
ペムブロリズマブ投与中に全身倦怠感等の非特異的な症状や検査所見として末梢血好酸球増多・低血糖・電解質異常を認めた場合には,IADを積極的に疑い,下垂体ホルモンの測定や負荷試験を含めた内分泌学的検索を迅速に施行することが重要である。
利益相反:本論文について申告する利益相反はない。
本論文の要旨は第650回内科学会関東地方会で発表した。