竹中英昭*,飯塚正徳*,茨木敬博*,綿部裕馬*,乾 佑輔*,古山達大*,上田将秀*,美藤文貴*, 岡田あすか*,長 澄人*
*大阪府済生会吹田病院呼吸器内科(〒564-0013 大阪府吹田市川園町1-2)
A case of synchronous double-lung cancers diagnosed by bronchoscopy
Hideaki Takenaka*, Masanori Iizuka*, Takahiro Ibaraki*, Yuma Watabe*, Yusuke Inui*, Tatsuhiro Furuyama*, Masahide Ueda*, Fumitaka Mito*, Asuka Okada*, Sumito Choh*
*Department of Respiratory Medicine, Saiseikai Suita Hospital, Osaka
Keywords:同時性多発肺癌,小細胞癌,扁平上皮癌,気管支鏡/synchronous double lung cancers, small cell carcinoma, squamous cell carcinoma, bronchoscopy
呼吸臨床 2021年5巻7号 論文No.e00132
Jpn Open J Respir Med 2021 Vol. 5 No. 7 Article No.e00132
DOI: 10.24557/kokyurinsho.5.e00132
受付日:2021年5月21日
掲載日:2021年7月19日
©️Hideaki Takenaka, et al. 本論文はクリエイティブ・コモンズ・ライセンスに準拠し,CC-BY-SA(原作者のクレジット[氏名,作品タイトルなど]を表示し,改変した場合には元の作品と同じCCライセンス[このライセンス]で公開することを主な条件に,営利目的での二次利用も許可されるCCライセンス)のライセンシングとなります。詳しくはクリエイティブ・コモンズ・ジャパンのサイト(https://creativecommons.jp/)をご覧ください。
症例:79歳男性。
主訴:胸部異常陰影。
既往歴:心筋梗塞,高血圧,高尿酸血症,甲状腺機能亢進症,胃潰瘍。
喫煙歴:既喫煙者,75 pack-years,70歳で禁煙。
粉塵吸入歴:なし。
現病歴:高血圧,高尿酸血症,甲状腺機能亢進症,胃潰瘍などで近医通院中。定期検査の胸部X線写真で異常を指摘され,2019年12月に同院呼吸器内科を受診した。左上葉の結節に対して気管支鏡検査を行い扁平上皮癌(squamous cell carcinoma:Sq)と診断された(図4a,b)。対側肺にも異常陰影を認め,精査加療目的に2020年1月中旬に当院紹介受診となった。
初診時身体所見:身長163cm,体重63.6kg。血圧143/77mmHg,脈拍56回/min・整,体温36.0℃,経皮的動脈血酸素飽和度96%(室内気)。表在リンパ節腫大なし,心雑音なし,呼吸音清,呼吸複雑音なし。皮疹や関節症状・浮腫を認めず。
血液検査所見(表1):CEA,CYFRAは正常,ProGRPの軽度高値を認めた。その他明らかな異常所見は見られなかった。
表1 血液検査所見
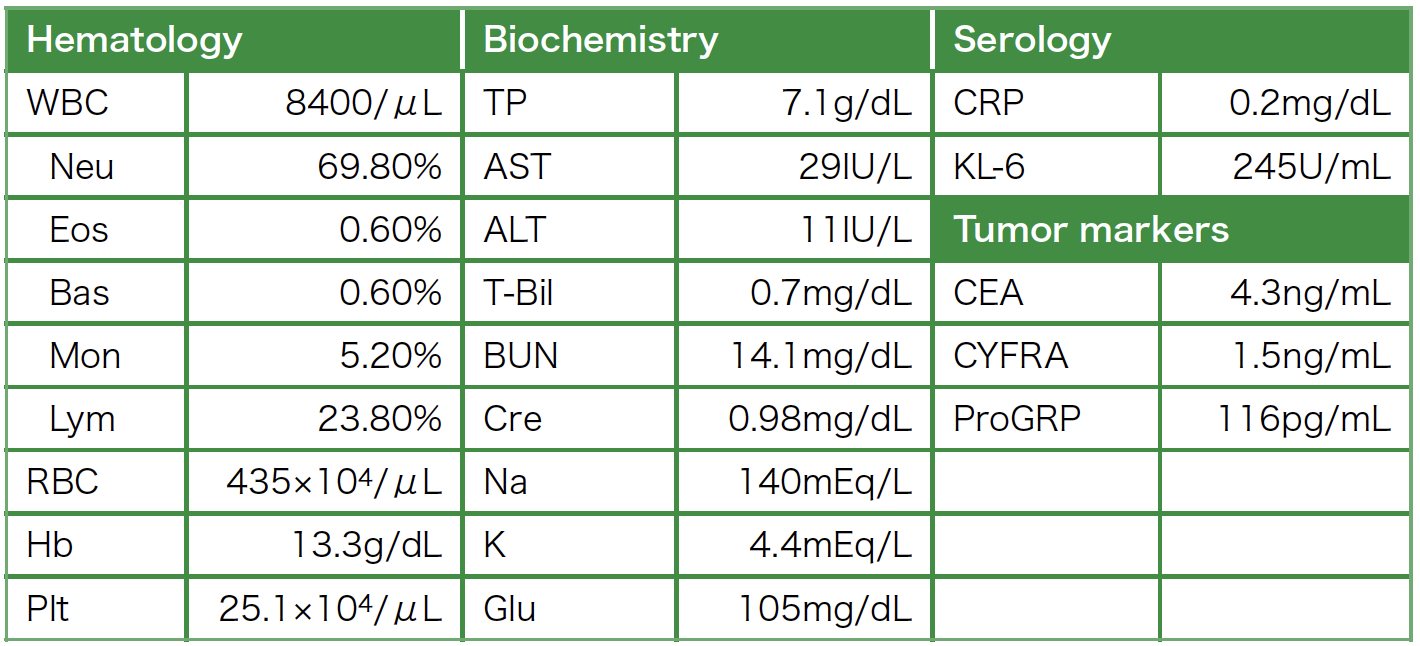
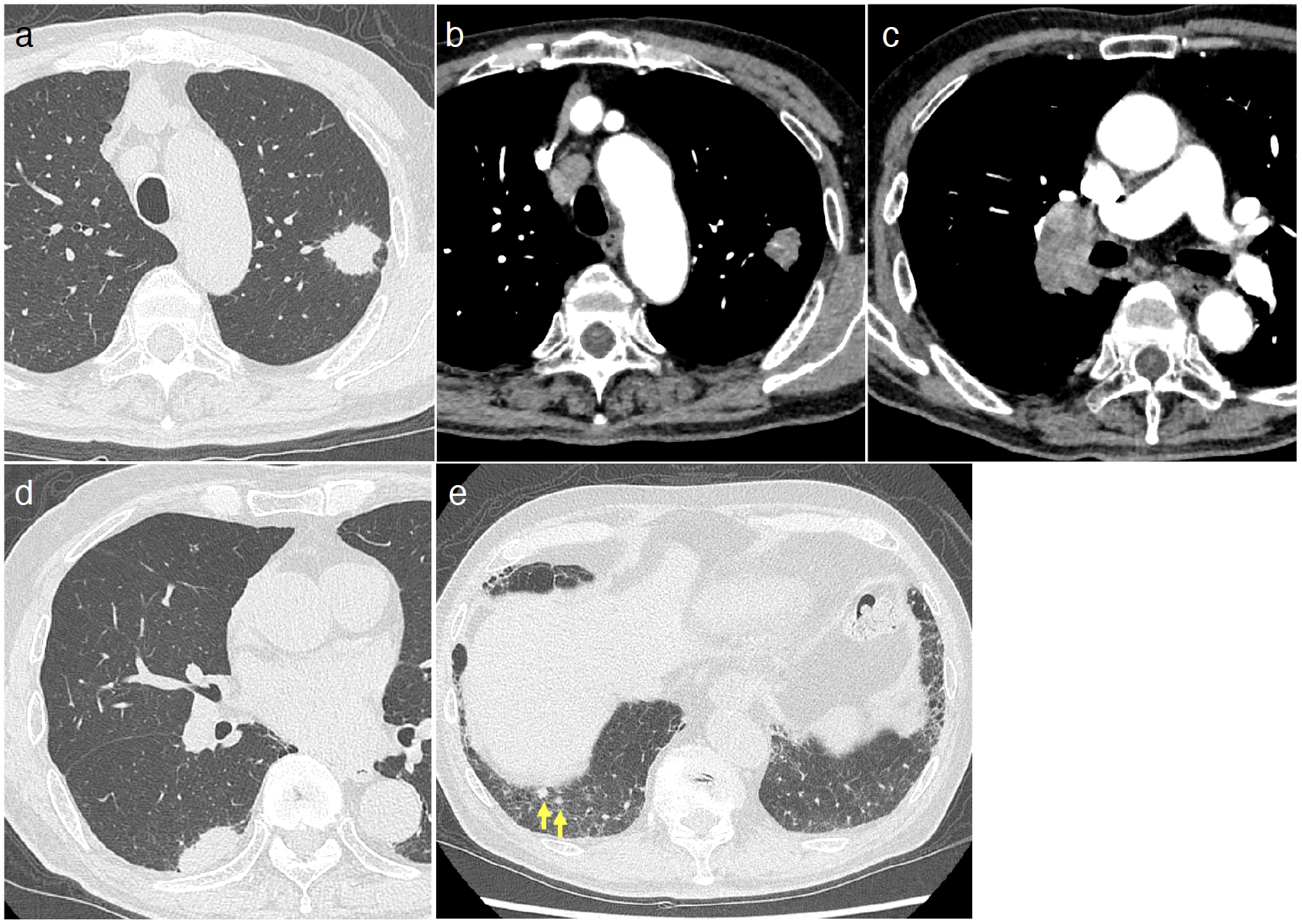
各種画像所見:胸部X線写真で左上肺野腫瘤影と右肺門腫大を認めた(図1)。胸部CTで左S1+2に25mmのspiculaを伴う結節影を認め(図2a),#4R,右肺門のリンパ節腫大を認めた(図2b,c)。また右S6の胸膜直下にも扁平な結節影を認めた(図2d)。右肺底部に転移を疑わせる小結節影も複数見られ,肺底部胸膜直下に軽度の間質性変化を認めた(図2e)。前医のFDG-PET/CTではCTで見られた腫瘤影,リンパ節にFDGの集積を認めたが,遠隔臓器への転移は見られなかった(図3)。頭部MRIで転移を認めなかった。
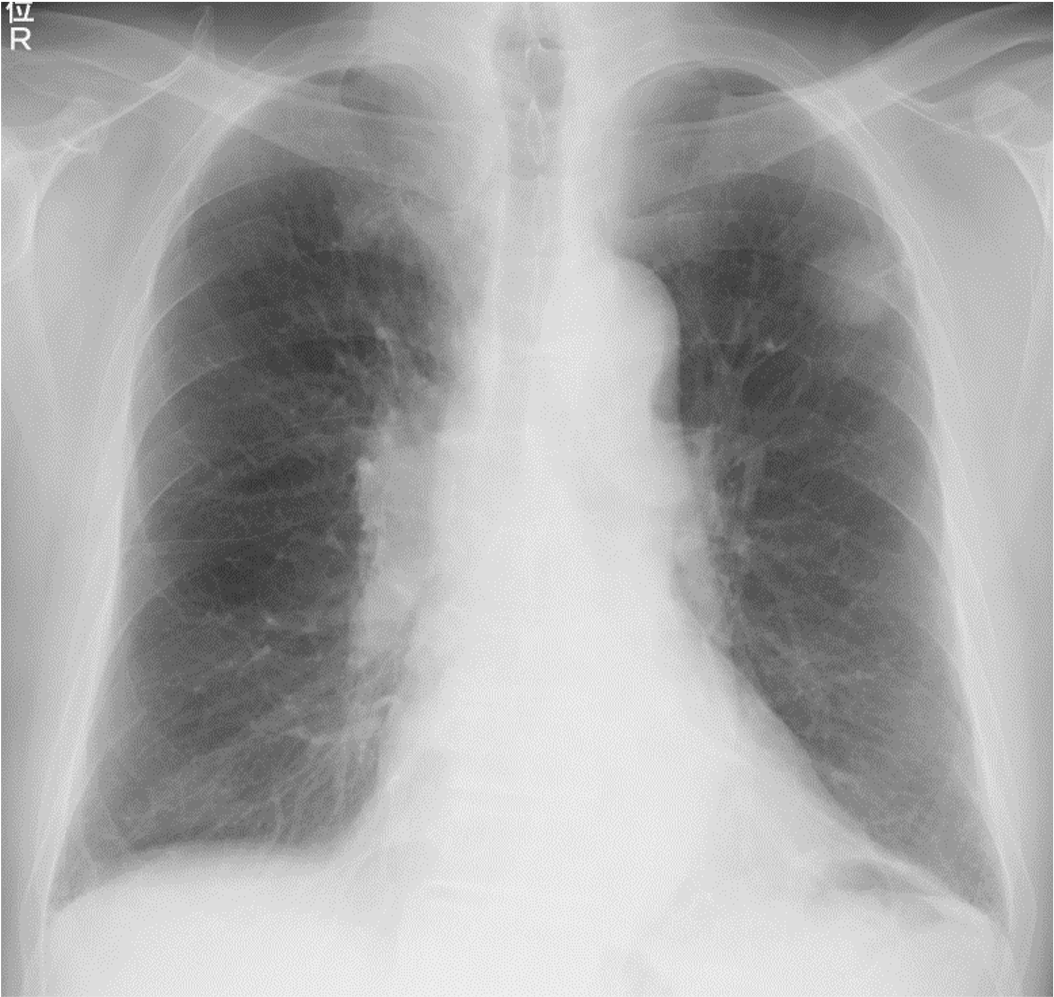
図1 胸部X線所見
左上肺野腫瘤影と右肺門腫大を認めた。
図2 胸部CT所見
左S1+2に25mmのspiculaを伴う結節影を認め(a),#4R,右肺門のリンパ節腫大を認めた(b,c)。また右S6の胸膜直下にも扁平な結節影を認めた(d)。右肺底部に転移を疑う小結節を複数認め(矢印),胸膜直下に軽度の間質性変化がみられた(e)。
図3 FDG-PET/CT所見
左上葉および右S6の腫瘤,右縦郭,肺門リンパ節に集積を認めた。
臨床経過:気管支鏡検査では可視範囲気道粘膜に異常を認めなかった。#4Rリンパ節のEBUS-TBNAでN/C比の高い,小型濃染核をもつ細胞集塊を認め(図4c),免疫染色の結果(図4d)小細胞肺癌(small cell lung cancer:SCLC)と診断した。
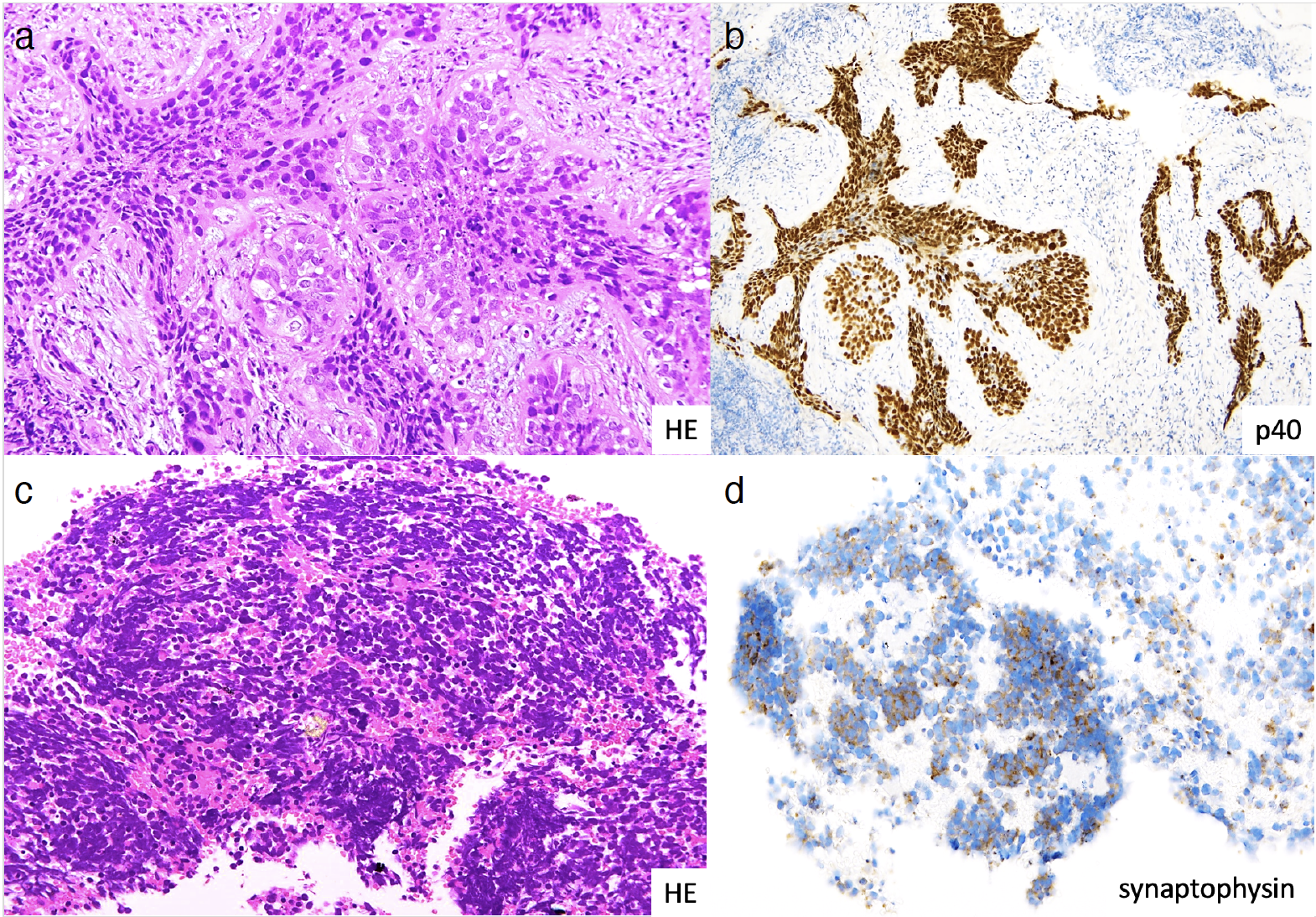
図4 病理組織所見
左上葉肺腫瘤の生検組織で敷石状に増殖する腫瘍細胞を認め(a),腫瘍細胞は免疫染色でp40陽性を呈し(b)扁平上皮癌と診断された。#4Rの超音波気管支鏡下経気管支針生検組織で小型濃染核をもつ腫瘍細胞の集塊を認め(c),腫瘍細胞は免疫染色でsynaptophysin(d)陽性を呈し小細胞癌と診断した。
以上よりSq(cT1cN0M0)とSCLC(cT3N2M0)の同時性多発肺癌と診断した。SCLCが限局型であればSCLCに関しては放射線化学療法,Sqに対しては手術がそれぞれ治療適応と考えたが,右肺底部に小結節を認めSCLCの肺内転移が疑われること,また肺底部に間質性変化も見られることから放射線化学療法は困難と判断し,予後規定因子と考えられるSCLCに対する薬物療法の方針とした。2020年2月よりカルボプラチン(carboplatin:CBDCA),エトポシド(etoposide:VP-16),アテゾリズマブ(atezolizumab:Atezo)による治療を開始,4コース後のCTで右S6の結節(SCLC),左上葉の結節(Sq)共に縮小を認めPRと判断した。右肺底部の小結節も治療により縮小がみられ,肺転移であったと考えた。肺内同年6月よりAtezoの維持療法を開始したが,4コース後のCTでいずれの陰影も増大し,PDと判断した。二次治療としてCBDCA+ナブパクリタキセル(nab-paclitaxel:nabPTX)による治療を開始し,現在SDを維持している。
同時性多発肺癌の診断はMartiniらの定義[5]が広く用いられており,①各腫瘍はそれぞれ独立して存在すること,②組織型が異なる,もしくは同一であっても組織分化度や細胞亜型,脈管浸潤の有無などにより肺内転移が否定できること,③他臓器からの転移を否定できること,とされている。本症例に関しては上記の①,②を満たし,全身検索でも胸部以外に病変を認めず,同時性多発肺癌と診断した。 多発肺癌の誘因としては重喫煙者に多い傾向が言われており[6],本患者も75 pack-yearsの重喫煙者であった。
Fergusonらによると同時性多発肺癌の頻度は約0.5%と報告されており[1],切除例においては約2%,また剖検例においては1.6%などの報告が見られるが,気管支鏡検査によって同時性多発肺癌と診断された報告は少ない。また,同一の組織型を呈することが多いとされ[1],Sq同士の報告が一番多いが,次にSqとSCLCが続くと報告されている[7][8]。
気管支鏡のデバイスの進歩により,以前に比べるとEBUS-TBNAや末梢病変に対するガイドシース併用気管支腔内超音波断層法(EBUS with a guide sheath:EBUS-GS)などさまざまなアプローチが可能となっている。特にEBUS-TBNA登場以降は,縦隔鏡などに比べて低侵襲に検査を行えるため,末梢病変へのアプローチが困難な症例や縦隔・肺門リンパ節腫大のみの症例に関しても,気管支鏡検査での診断機会が増えてきている。本邦におけるEBUS-TBNAによるリンパ節転移診断の検討では,感度94.6%,特異度100%[9]と報告されており,またEBUS-GSを用いた肺生検において,エコー所見がwithin,adjacent toの場合の診断率はそれぞれ83%,61%[10]と報告されている。
本患者は左上葉肺癌として紹介されたが,左の縦隔や肺門リンパ節腫大を認めないにもかかわらず対側リンパ節腫大を認め,対側肺に結節もあったことより,同時性多発肺癌を疑い気管支鏡検査で診断に至った。本患者では残念ながら根治治療へ結びつけることはできなかったが,一元的な腫瘍か同時性多発肺癌かによって根治治療の可能性が異なるなど,治療方針が大きく変わる場合もあり治療前に同時性多発肺癌かどうかを診断することは重要である。転移形式が非典型的と考えられる場合にはEBUS-TBNAなどを活用して積極的に検査を行ことが重要と考える。
なお,本患者の二次治療に関しては,SCLCに対するアムルビシンやイリノテカンは間質性変化のため使用困難と判断し,Sqの適応がありいくつかの第Ⅱ相試験でSCLCに対して奏効が報告されている,nabPTXを選択した[11][12]。
利益相反:本論文に関連する開示すべき利益相反関係にある企業等はない。