平位佳歩*1,青原大介*2,大島友里*1,櫻井祐輔*1,谷恵利子*1,吉本直樹*1,西田 達*3,永田憲司*4,若狭研一*5,平島智徳*6,南 謙一*1
*1石切生喜病院呼吸器センター呼吸器内科(〒579-8026 大阪府東大阪市弥生町18-28)
*2大阪市立大学大学院医学研究科呼吸器内科学
*3石切生喜病院呼吸器センター呼吸器外科,*4同放射線治療科,*5同病理診断科,*6同呼吸器腫瘍内科
A case of lung adenocarcinomas with multiple ground glass nodules treated up to fourth cancer
Kaho Hirai*1, Daisuke Aohara*2, Yuri Oshima*1, Yusuke Sakurai*1, Eriko Tani*1, Naoki Yoshimoto*1, Tatsuya Nishida*3, Kenji Nagata*4, Kenichi Wakasa*5, Tomonori Hirashima*6, Kenichi Minami*1
*1Department of Respiratory Medicine, Ishikiriseiki Hospital, Osaka.
*2Department of Respiratory Medicine, Graduate School of Medicine, Osaka City University.
*3Department of Thoracic Surgery, *4Department of Radiation Oncology, *5Department of Diagnostic Pathology, *6Department of Thoracic Oncology, Ishikiriseiki Hospital.
Keywords:多発すりガラス状結節,体幹部定位放射線治療,集学的アプローチ/multiple ground glass nodules, stereotactic body radiotherapy, multidisciplinary approach
呼吸臨床 2021年5巻8号 論文No.e00134
Jpn Open J Respir Med 2021 Vol. 5 No. 8 Article No.e00134
DOI: 10.24557/kokyurinsho.5.e00134
受付日:2021年6月22日
掲載日:2021年8月13日
©️Kaho Hirai, et al. 本論文はクリエイティブ・コモンズ・ライセンスに準拠し,CC-BY-SA(原作者のクレジット[氏名,作品タイトルなど]を表示し,改変した場合には元の作品と同じCCライセンス[このライセンス]で公開することを主な条件に,営利目的での二次利用も許可されるCCライセンス)のライセンシングとなります。詳しくはクリエイティブ・コモンズ・ジャパンのサイト(https://creativecommons.jp/)をご覧ください。
主訴:胸部異常陰影。
既往歴:胆石症に対し38歳時に胆囊摘出術,子宮内膜ポリープに対し67歳時に子宮鏡下ポリープ切除術,子宮体癌に対し68歳時に子宮全摘+両側附属器摘出術(endometrioid adenocarcinoma,pT1aN0M0,pStageⅠA)
喫煙歴:なし。夫は20~40本/日を40年間,長男は10本/日を5年間の喫煙歴を有し,家庭内で夫と長男からの受動喫煙歴がある。家庭外での受動喫煙はない。
現病歴:子宮体癌術前の胸部CTにて左上葉に結節影を指摘された。
検査所見:胸部CTにて左S3に最大径20mm,充実成分の最大径10mmのpart solid noduleを認める(図1a)ほか,右S1にpart solid nodule,両肺にpure GGNの散在を認めた。PET-CT検査では左S3の病変のみにfluorodeoxyglucoseの異常集積を認めた。
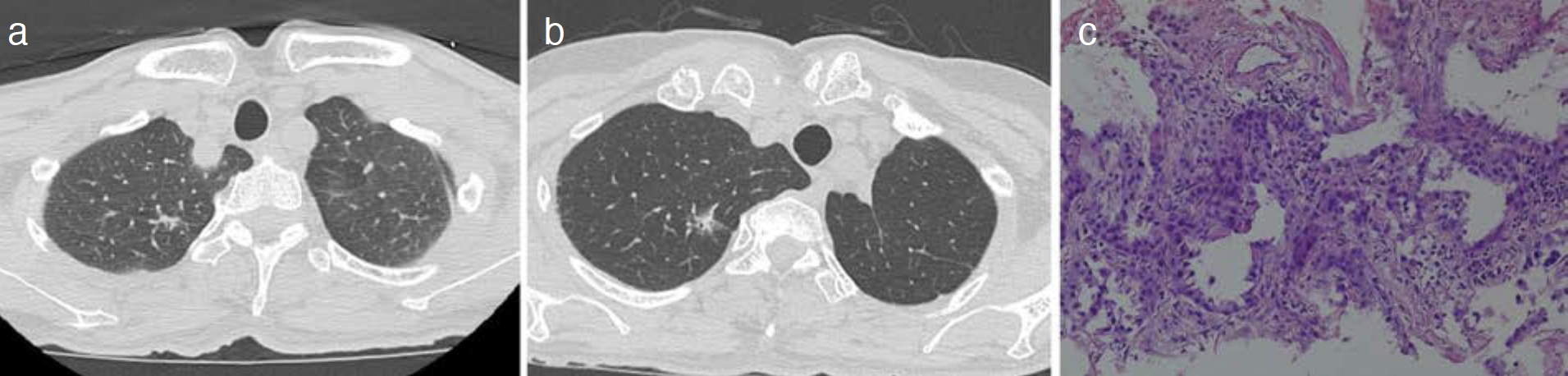
経過:左S3の病変に対しCTガイド下肺生検(CT-guided needle biopsy:CTGNB)を施行しpapillary adenocarcinoma(図1b)と診断した(第1癌)。手術までに病変最大径が33mmへ増大し胸腔鏡下左肺上葉切除術+縦隔リンパ節郭清(ND2a-1)を施行した。pT2aN0M0,pStage ⅠB(肺癌取扱い規約第8版)であった。術後補助化学療法としてcarboplatin+S-1を4コース施行した。
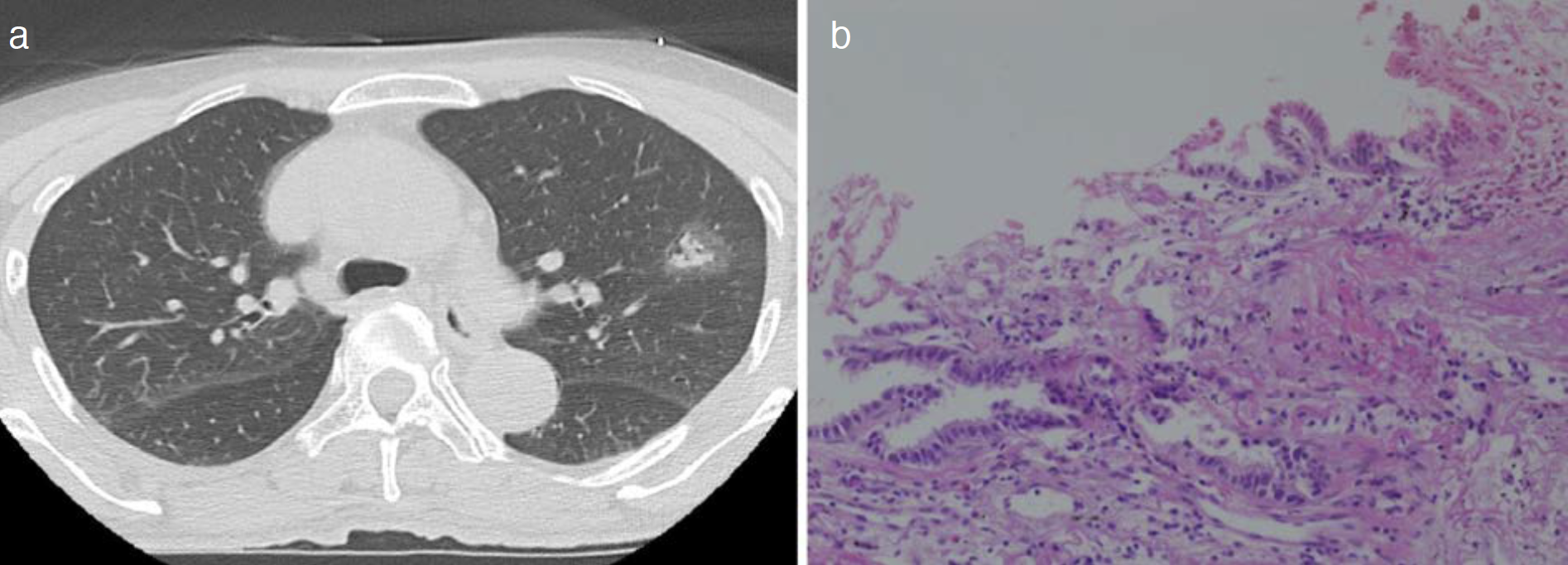
図1 第1癌
a. 胸部CT,b. 病理組織(Hematoxylin-Eosin染色)。
手術から2年半後,右S1のpart solid noduleが最大径8mmから14mm,充実成分の最大径7mmから8mmへと増大した(図2a,b)。CTGNBを施行しpapillary adenocarcinoma(図2c)と診断した(第2癌)。cT1aN0M0,cStageⅠA1(同規約第8版)であった。多部門で検討し手術を予定したが,患者が無治療を希望した。同時期に左S6に7×4mmの囊胞が出現した。手術から4年後,囊胞が18×10mmへと増大し壁肥厚を認めた(図3a,b)。CTガイド下に穿刺吸引細胞診を施行しadenocarcinoma(図3c)と診断した(第3癌)。臨床病期はcT1cN0M0,cStageⅠA3であった。この時第2癌はcT1bN0M0,cStageⅠA2(同規約第8版)であった。多部門で検討し手術の方針としたが,患者の希望で第2癌,第3癌に対し体幹部定位放射線治療(stereotactic body radiotherapy:SBRT)(48Gy/4Fr)を施行した。
図2 第2癌
a. 胸部CT(初診時),b. 胸部CT(手術2年半後),c. 病理組織(Hematoxylin-Eosin染色)。
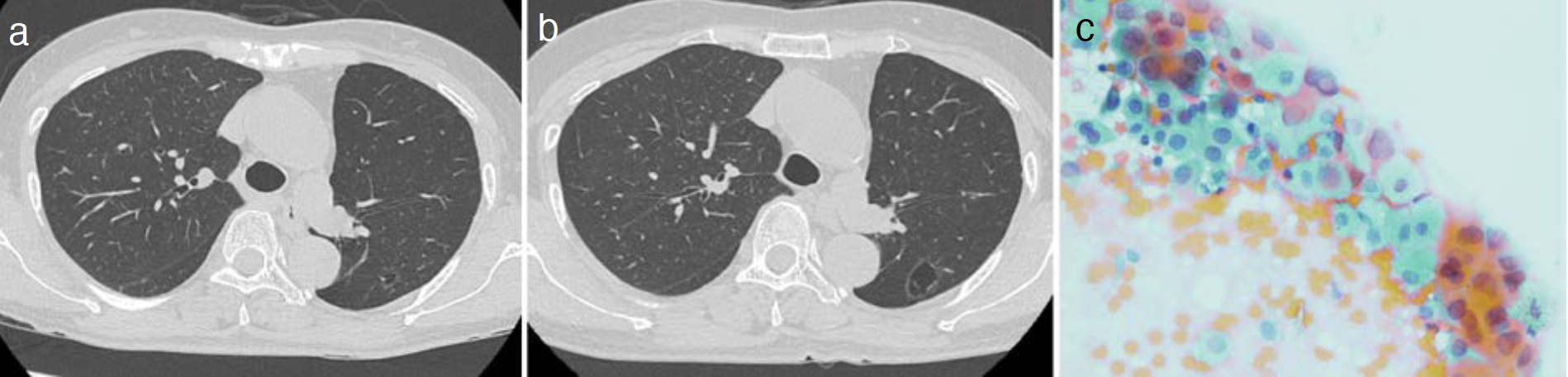
図3 第3癌
a. 胸部CT(手術2年半後,囊胞出現時),b. 胸部CT(手術4年後),c. 細胞診(papanicolaou染色)。
手術から4年後のSBRTと同時期に左S10に最大径8mmのpure GGNが出現し,最初の手術から8年半後に最大径13mmへと増大した(図4a,b)。CTGNBを施行しadenocarcinoma with lepidic pattern(図4c)と診断した(第4癌)。cTisN0M0,cStage0(同規約第8版)であった。多部門で検討したが,患者希望通りSBRT(48Gy/4Fr)を施行した。現在第4癌の治療後10カ月にわたり無再発生存を得ている。
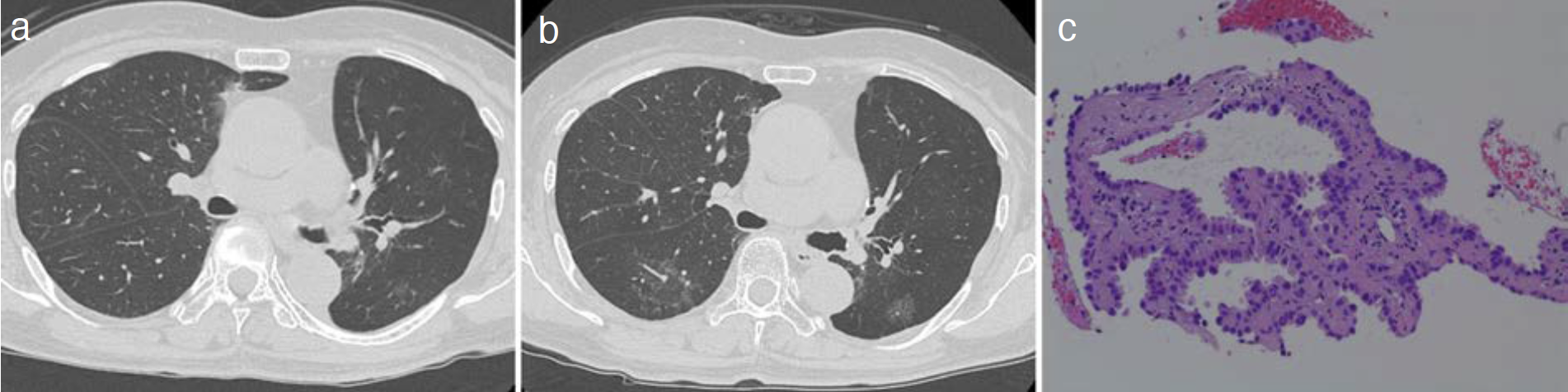
図4 第4癌
a. 胸部CT(手術4年後,pure GGN出現時),b. 胸部CT(手術8年半後),c. 病理組織(Hematoxylin-Eosin染色)。
近年診断技術が向上しGGNの検出が増加している[3]。GGNの鑑別には良性疾患も挙げられるが[4]消退しないGGNは悪性腫瘍である可能性が高い[5]。GGNの内part solid noduleの約40%,pure GGNの約20%が経時的に増大する一方で,残りの病変は長期間に渡り不変である[3]。GGNを適切に管理し,悪性腫瘍を疑わせる挙動を示す病変に対しては早期に診断・治療を行うことが重要である。
日本CT検診学会はGGNの管理に関する指針を示しており[6],我々はこの指針に基づきGGNの管理・治療を行い良好な結果を得た。
切除可能なⅠ〜Ⅱ期非小細胞肺癌に対する標準治療は,肺葉以上の切除による外科治療である[7]。しかし本症例のように異時性に複数の肺癌を発症した場合,残存肺機能が問題となる。
術後予測1秒量を800mL以上に保つことが望ましく[8],実臨床では区域切除などの縮小手術を選択することがある。2cm未満の非小細胞肺癌に対する区域切除は,肺葉切除と比較して腫瘍学的転帰に有意差がないというメタ解析[9]があり,本症例でも第2癌以降縮小手術での治療を検討した。医学的には手術可能であると判断したが,患者の同意が得られなかった。医学的な理由で手術困難な症例や患者が手術を希望しない症例では,SBRTなどの根治的放射線治療が推奨されており[7],医学的に手術可能である症例に対して十分な線量でSBRTを施行した場合の治療成績は,手術と同等であるとの報告もある[10]。近年SBRTについてさまざまな検討がなされ[11],今後GGNを呈する肺癌に対する有効な治療法として期待される。また外科治療に関しては,I期非小細胞肺癌を対象として,肺葉切除と区域切除での有効性および安全性を比較するJCOG0802/WJOG4607Lが行われ,安全性に関しては両群間に有意差がないと報告された[12]。今後区域切除が肺葉切除に対し残存肺機能において優越性を,全生存期間において非劣性を示すことができれば,区域切除も標準治療の1つとなりGGNの管理・治療にも大きな影響を与える可能性がある。
GGNの管理では多角的な視点で行うMultidisciplinary collaboration approachが推奨されている[2]。本症例では推奨の通り多部門が連携して多発GGNを伴う肺腺癌に対し第4癌まで適切に診断・治療をした点で報告に値すると考える。
本稿の要旨は第97回日本呼吸器学会近畿地方会(2021年,WEB)で報告した。
利益相反:なし。