【投稿/症例報告】次世代シーケンシングで診断しアレクチニブが奏効したALK陽性肺扁平上皮癌の1例

荻須智之*1,梶川茂久*1,田中博之*1,片野拓馬*1,米澤利幸*1,深見正弥*1,高原大志*2,都築豊徳*2,久保昭仁*1, *3,伊藤 理*1
*1愛知医科大学呼吸器・アレルギー内科(〒480-1195 愛知県長久手市岩作雁又1-1)
*2愛知医科大学病理診断科
*3愛知医科大学病院臨床腫瘍センター腫瘍内科
ALK-rearranged squamous cell lung carcinoma diagnosed using next generation sequencing and successfully treated with alectinib: a case report
Tomoyuki Ogisu*1, Shigehisa Kajikawa*1, Hiroyuki Tanaka*1, Takuma Katano*1, Toshiyuki Yonezawa*1, Masaya Fukami*1, Taishi Takahara*2, Toyonori Tsuzuki*2, Akihito Kubo*1, *3,Satoru Ito*1
*1Department of Respiratory Medicine and Allergology, Aichi Medical University
*2Department of Surgical Pathology, Aichi Medical University
*3Department of Medical Oncology, Oncology Center, Aichi Medical University Hospital
Keywords:扁平上皮癌,ALK融合遺伝子陽性肺癌,アレクチニブ,次世代シーケンシング,オンコマインTM Dx Target Test®/squamous cell carcinoma, ALK fusion gene-positive lung carcinoma, alectinib, next generation sequencing, OncomineTM Target Test®
呼吸臨床 2023年7巻7号 論文No.e00176
Jpn Open J Respir Med 2023 Vol. 7 No.7 Article No.e00176
DOI: 10.24557/kokyurinsho.7.e00176
受付日:2023年3月1日
掲載日:2023年7月14日
©️Tomoyuki Ogisu, et al. 本論文はクリエイティブ・コモンズ・ライセンスに準拠し,CC-BY-SA(原作者のクレジット[氏名,作品タイトルなど]を表示し,改変した場合には元の作品と同じCCライセンス[このライセンス]で公開することを主な条件に,営利目的での二次利用も許可されるCCライセンス)のライセンシングとなります。詳しくはクリエイティブ・コモンズ・ジャパンのサイト(https://creativecommons.jp/)をご覧ください。
症例は69歳,重喫煙歴のある男性。健康診断で胸部異常陰影を指摘され,精査目的で紹介受診となった。気管支鏡検査および全身検索により扁平上皮癌cT4N3M1a,Stage IVAと診断した。組織検体を次世代シーケンシング法であるオンコマインTM Dx Target Test®で解析した結果,anaplastic lymphoma kinase(ALK)融合遺伝子陽性が判明した。アレクチニブによる治療を開始し,6カ月後には完全奏効となった。重篤な有害事象は認めなかった。扁平上皮癌においても,ドライバー遺伝子変異検索を考慮してよいと考える。
Anaplastic lymphoma kinase(ALK)融合遺伝子は,epidermal growth factor receptor遺伝子変異と同様に,若年者,女性,非喫煙者,腺癌に多く認められるドライバー遺伝子変異である[1]。一方で,肺扁平上皮癌におけるALK融合遺伝子の陽性率は約1%と低く[2][3][4],ALKチロシンキナーゼ阻害薬(TKI)の有効性も十分明らかではない[2][5][6]。今回,次世代シーケンシング(next generation sequencing:NGS)法を用いた遺伝子パネル検査によりALK融合遺伝子陽性が判明し,アレクチニブによる治療が著効した,肺扁平上皮癌患者を経験したため報告する。
症例:69歳,男性。
主訴:咳嗽,胸部異常陰影。
併存症:狭心症,高血圧症,高尿酸血症。
アレルギー歴:特記事項なし。
家族歴:特記事項なし。
喫煙歴:15本/日,20~49歳の既喫煙。
粉塵職歴:特記事項なし。
現病歴:健康診断で胸部異常陰影を指摘され,乾性咳嗽を伴うことから,精査目的に当院呼吸器・アレルギー内科を紹介された。胸部画像所見より原発性肺癌が疑われ,気管支鏡検査目的で入院となった。
初診時現症:Performance status(PS)1,身長160.5cm,体重56.5kg,体温36.3℃,血圧145/77mmHg,心拍数75回/分,SpO2 95%(室内気)。心音異常なし。呼吸音は左下肺背側で減弱。
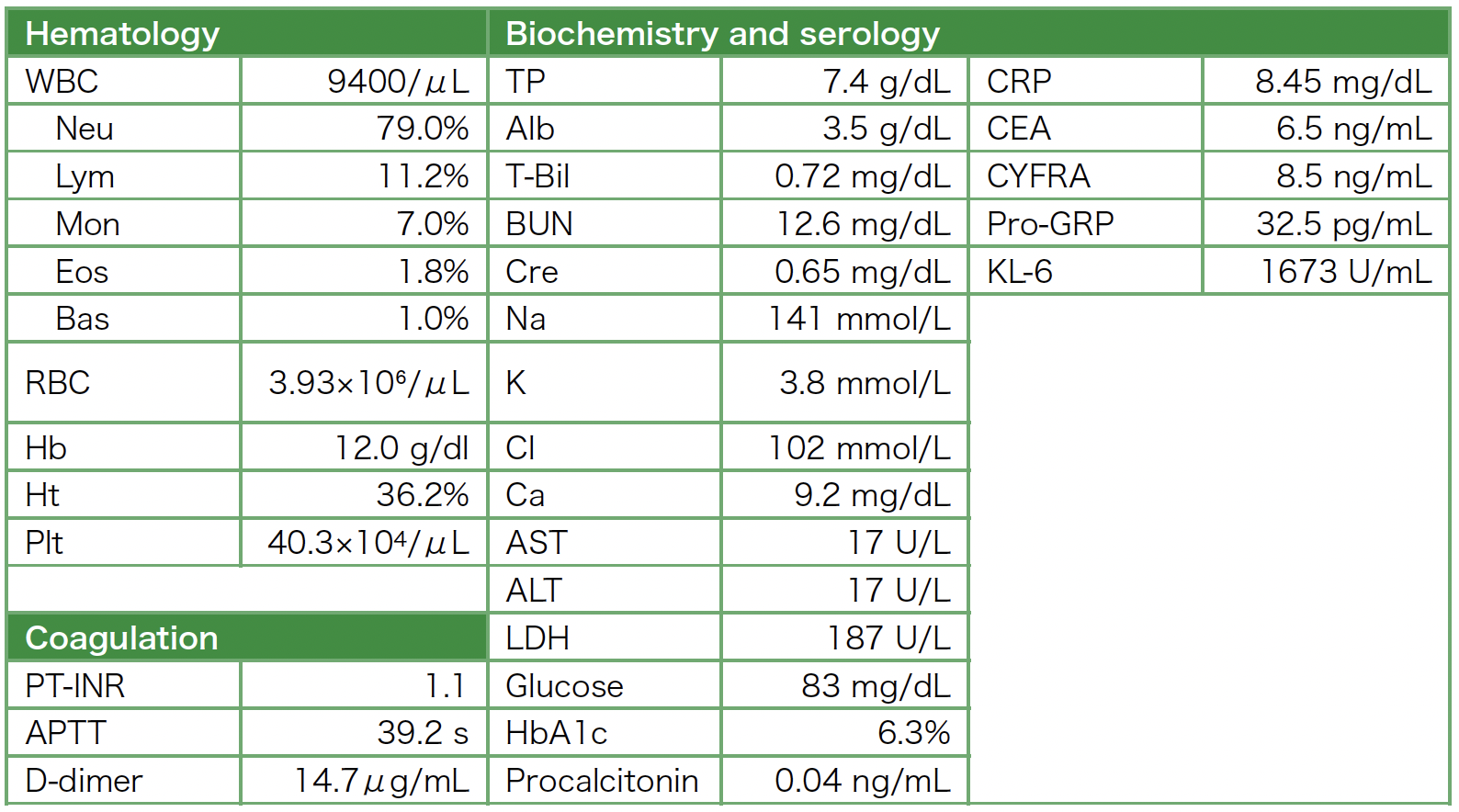
血液検査所見(表1):CEA,CYFRA,KL-6,CRPおよびD-dimerが高値を示した。
表1 入院時検査所見
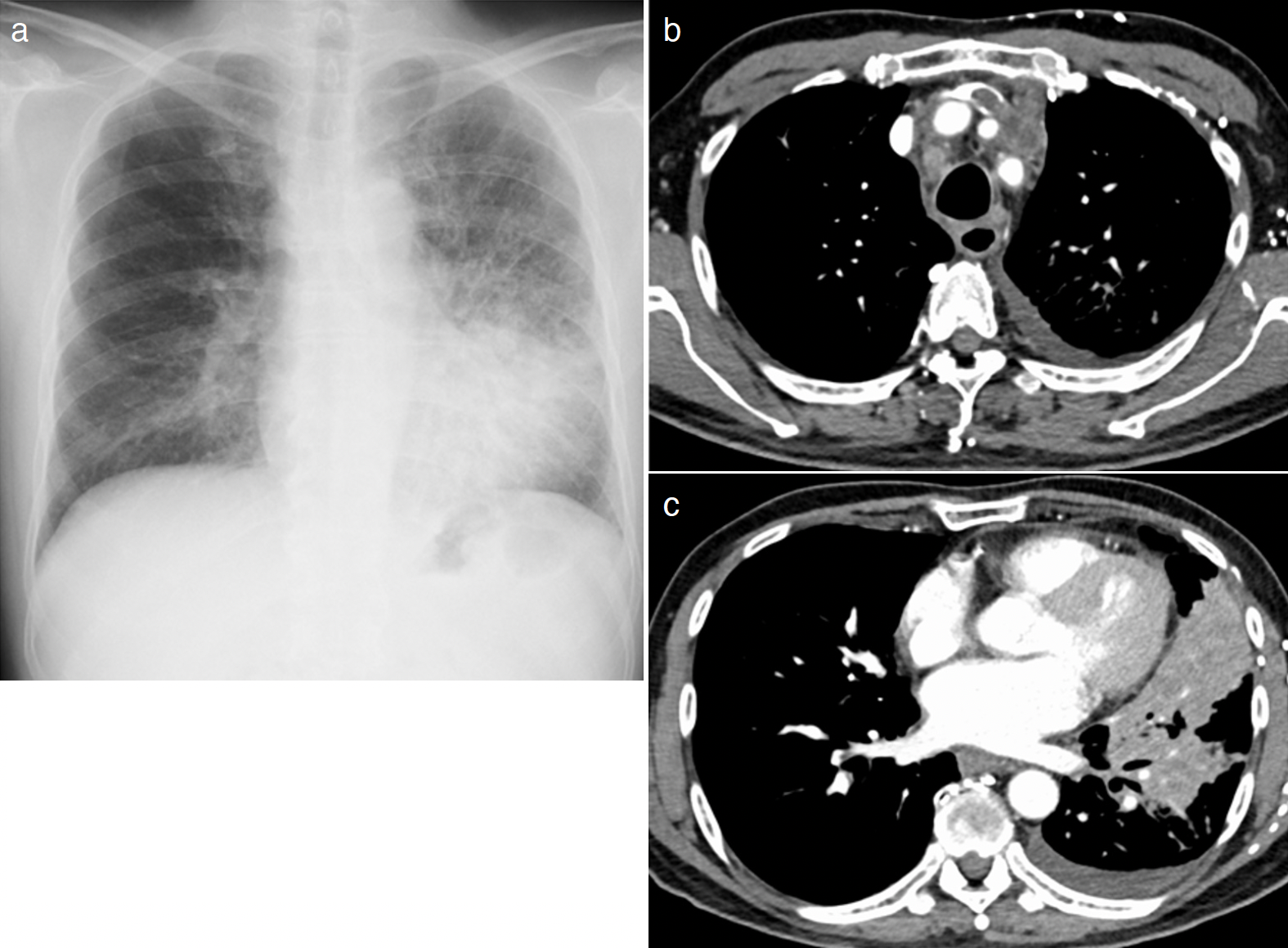
胸部単純X線(図1a):左下肺野に心陰影とシルエットサイン陽性の腫瘤影を認めた。
胸部造影CT:左腕頭,内頸静脈および鎖骨下静脈内に血栓を認めたが(図1b),肺動脈内の血栓は描出されなかった。左肺上葉に小葉間隔壁の肥厚,舌区と下葉に腫瘤影を認めた(図1c)。右肺上葉の結節影,両側肺門および縦隔リンパ節の腫大を認めた。
図1 入院時胸部画像所見
胸部X線左下肺野に心陰影とシルエットサイン陽性の腫瘤影を認めた(a)。胸部造影CTでは左腕頭,内頸静脈および鎖骨下静脈内に血栓を(b),左肺上葉に小葉間隔壁の肥厚,舌区と下葉に腫瘤影を認めた(c)。
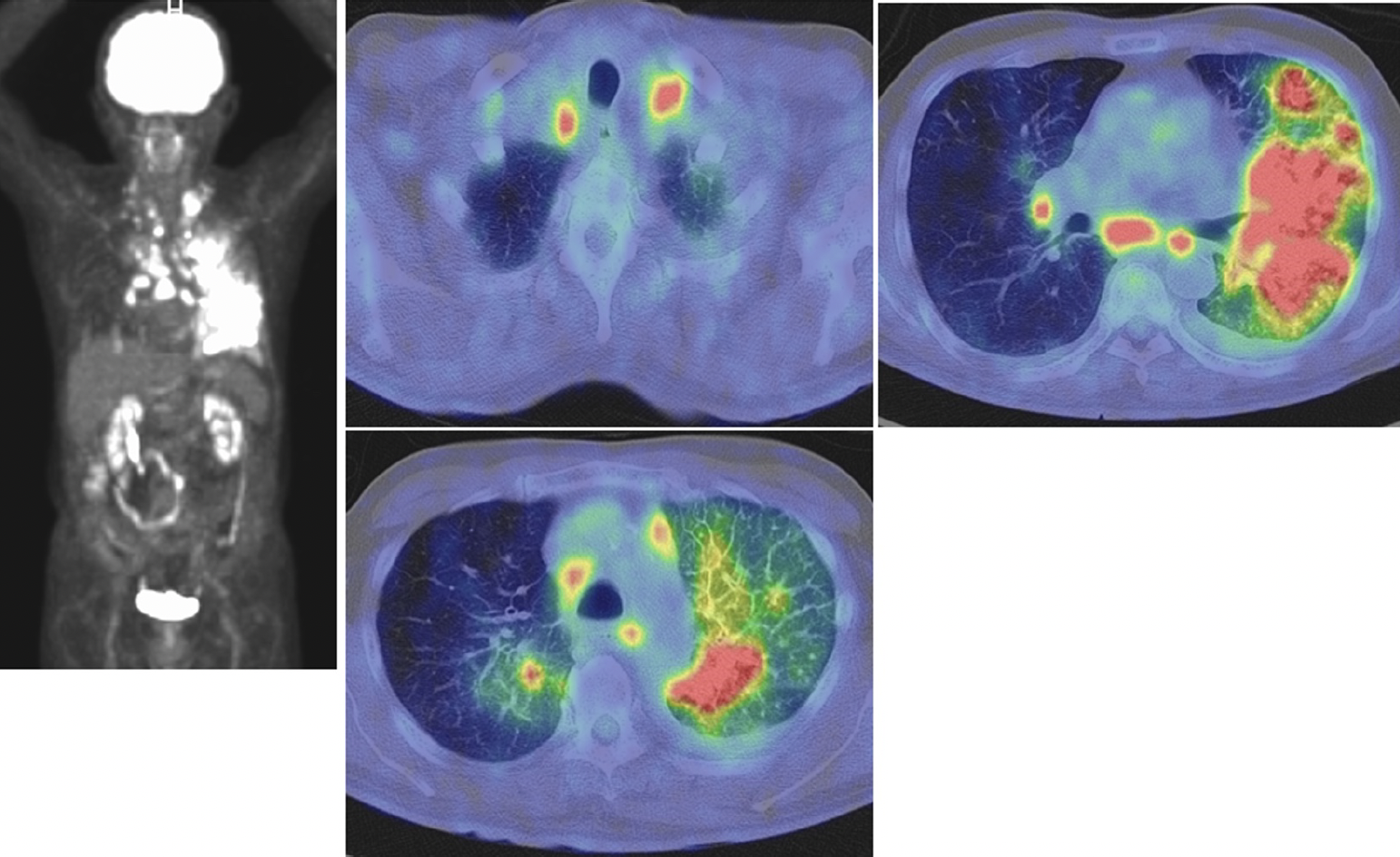
FDG-PET/CT(図2):原発巣と考えられる左舌区と下葉にまたがる腫瘤にSUV max 15.04のFDG集積を認め,両肺の結節に加え,両側肺門,縦隔,鎖骨上窩および下内深頸リンパ節に高集積を認めた。
図2 FDG-PET/CT
左舌区と下葉にまたがる腫瘤に加え,両側肺門,縦隔,鎖骨上窩および下内深頸リンパ節にFDGの高集積を認めた。
脳造影MRI:脳転移を認めなかった。
気管支鏡所見(図3):舌区支入口部に狭窄を伴う易出血性の白色隆起性病変を認め,同部位から生検を行った。
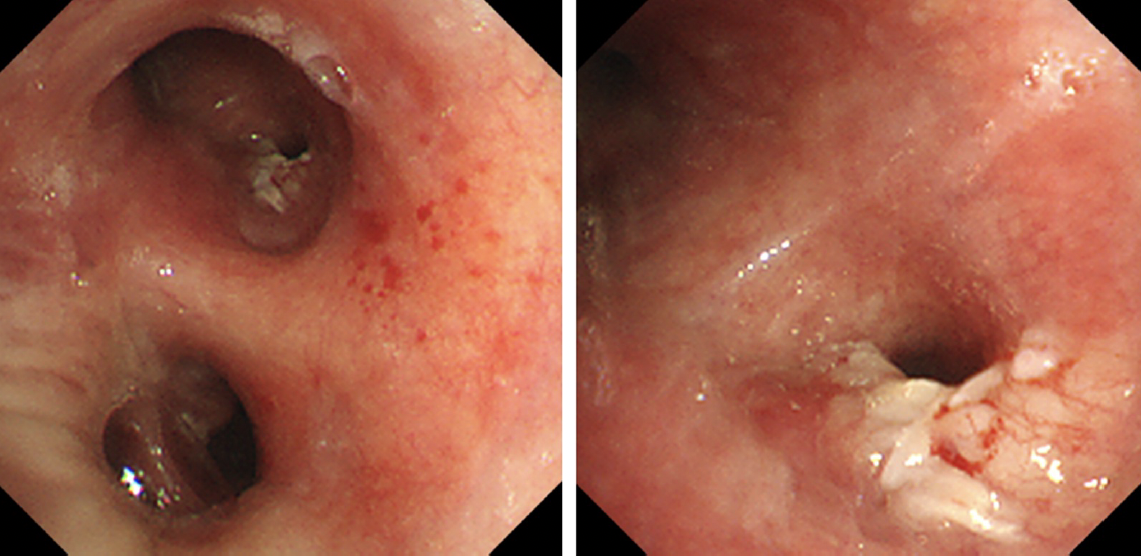
図3 気管支鏡内腔所見
舌区支入口部に狭窄を伴う易出血性の白色隆起性病変を認めた。
生検病理組織所見(図4):Hematoxylin-eosin染色では,核腫大を有する異型細胞が一部角化を伴い,充実胞巣性に増殖する像を認めた(図4a)。免疫染色ではthyroid transcription factor-1陰性(図4b)かつ基底細胞マーカーp40陽性(図4c)であり,扁平上皮癌の所見であった。得られた検体には腺癌成分は含まれていなかった。
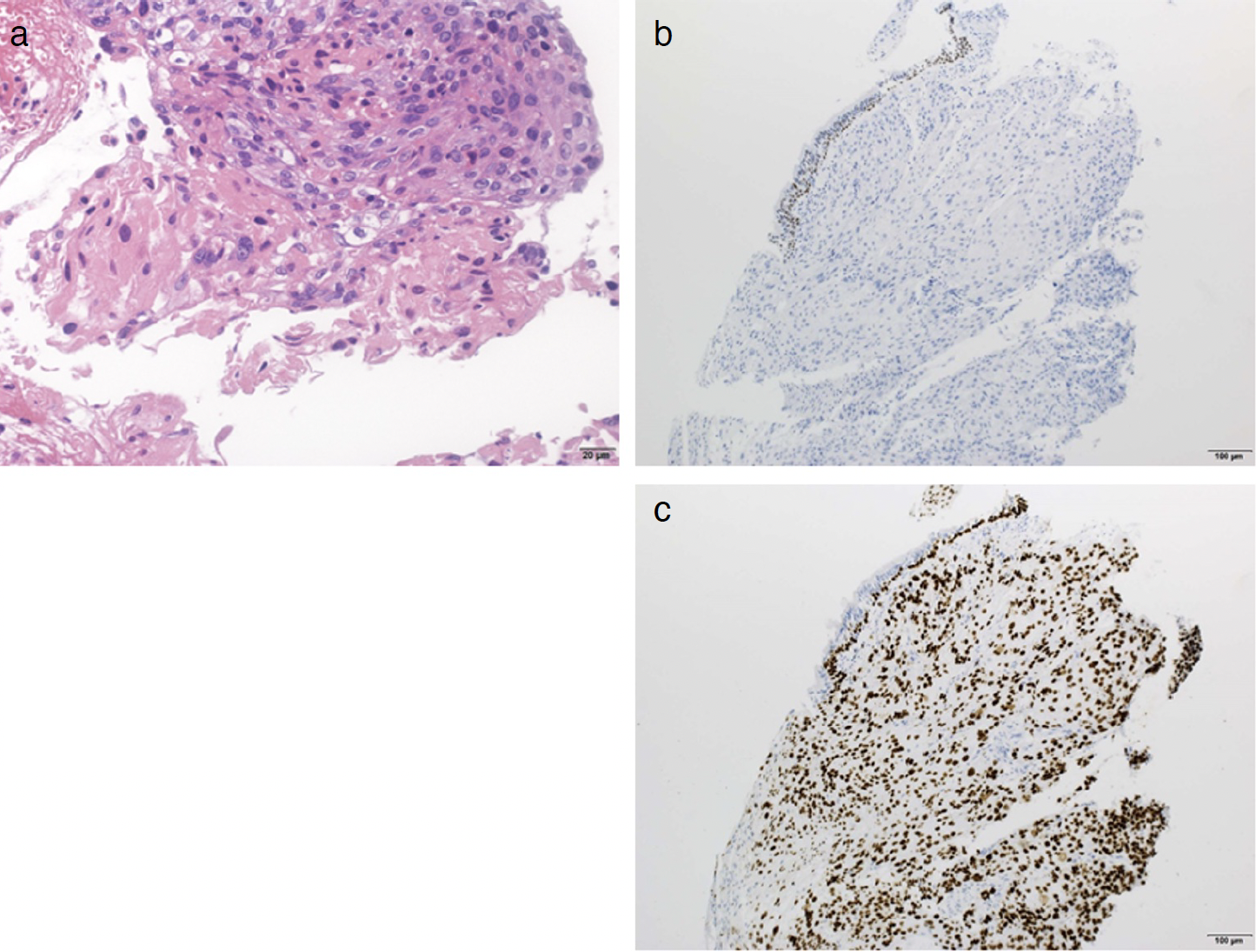
図4 気管支生検病理組織所見
Hematoxylin-eosin染色(a,×20)では,核腫大を有する異型細胞が一部角化を伴い,充実胞巣性に増殖する像を認めた。免疫染色ではthyroid transcription factor-1陰性(b,×10)かつ基底細胞マーカーp40陽性(c,×10)であり,扁平上皮癌の所見であった。
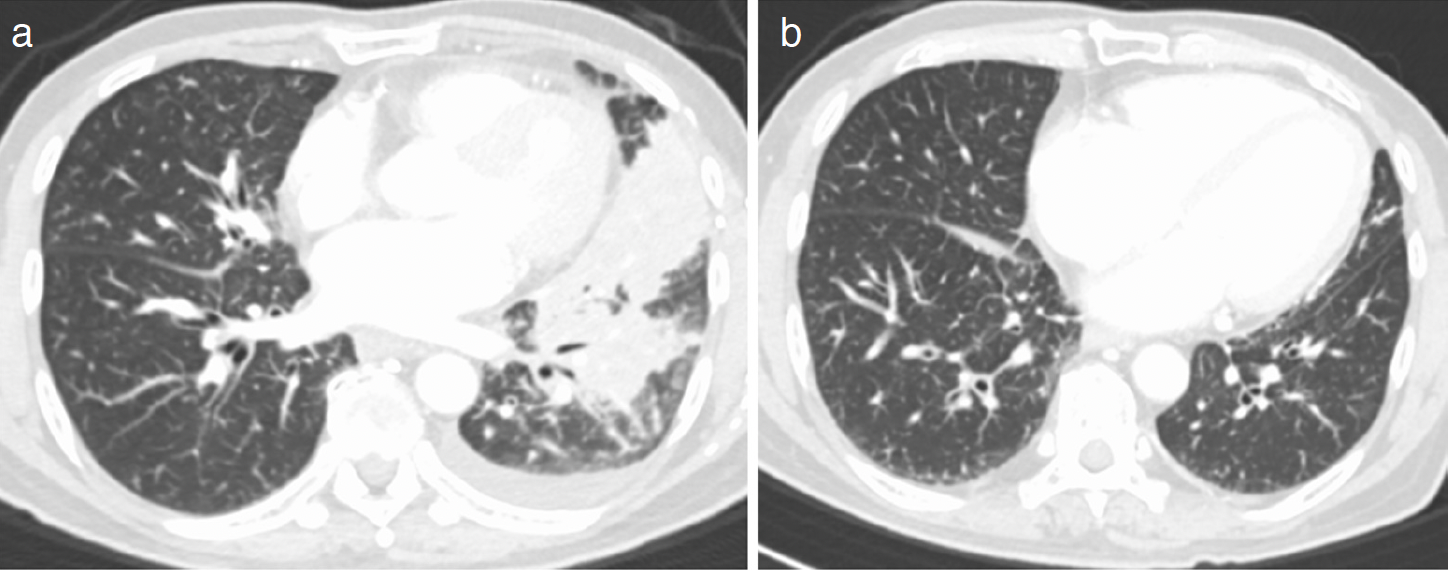
臨床経過:左肺原発扁平上皮癌cT4N3M1a(PUL),stage IVAと診断した。生検でNGS検査に足る十分な腫瘍検体量を採取できたことから,オンコマインTM Dx Target Test®による46遺伝子の検索を行ったところ,EML4-ALK融合遺伝子variant 3a/b(E6a/b;A20)陽性が判明した。その他の遺伝子変異は検出されず,PD-L1の発現はtumor proportion score が50%以上の強陽性であった。ALK融合遺伝子が本症例のoncogenic driverと考え,アレクチニブ600mg/日内服を開始した。また,造影CT検査で認められた静脈内血栓については,癌関連血栓症トルソー症候群と判断し,アピキサバン(20mg/日)による抗凝固療法を開始した。アレクチニブによる特記すべき有害事象は無く,投与開始15日後に退院となった。治療開始3カ月後には,胸部CTで部分寛解(partial response:PR)となり,静脈内の血栓も消失し,PSも0と改善した。6カ月後には完全寛解(complete response:CR)が得られ(図5),CEA(2.2ng/mL)およびCYFRA(2.6ng/mL)は正常域まで低下した。アレクチニブ投与12カ月後もCRが維持されており,アビキサバンも継続されていた。
図5 胸部CT
アレクチニブ治療前(a)と治療開始 6カ月後(b)。
今回,重喫煙歴のある69歳男性の肺扁平上皮癌患者において,NGS検査でALK融合遺伝子陽性が判明し,アレクチニブによる治療が著効した。ALK融合遺伝子陽性非小細胞肺癌を対象とし,アレクチニブとクリゾチニブの有効性および安全性を比較した,わが国における第III相非盲検ランダム化比較試験(J-ALEX試験)では,全207例のうち肺扁平上皮癌は2例(0.97%)のみであった[1]。同試験の肺扁平上皮癌に関する治療効果は不明である。腺癌成分を含まないALK融合遺伝子陽性の肺扁平上皮癌に対して,アレクチニブを含むALK-TKIによる治療により効果が得られたという報告が散見される[2][5]〜[10]。一方で,Tamiyaらはアレクチニブ無効であった喫煙男性例を報告している[11]。過去には,症例報告とその集積以上のまとまった臨床研究はなされていないものの,ALK-TKIは扁平上皮癌に対しても有効性が期待できると考えられている[2][10]。ただし,WatanabeらによるALK陽性肺癌に対するALK-TKI治療の検討では,腺癌と比べ,扁平上皮癌においてprogression-free survival(PFS)が有意に短かったと報告している[2]。Watanabeらは,fluorescence in situ hybridization(FISH)による検討も行い,ALK-FISH陽性を示す核の割合が多い患者ほど,ALK-TKIがより奏効するとの結果が得られている[2]。今回我々の患者は,過去のALK陽性肺扁平上皮癌の報告例と比べても,ALK-TKI治療効果が良好であったといえるが,FISH法による追加の検討は行っていない。
今回,EML4-ALK融合遺伝子は,variant 3a/b(E6a;A20)であり,加えてPD-L1発現も強陽性であった。中国のLiらは,進行非小細胞肺癌のコホートにおいて,このvariant 3a/b(E6a;A20)は,variant 1(E13;A20)に次ぐ頻度で認められ,PD-L1発現陽性に関連するvariantであること,PDL-1の強発現が第二世代ALK-TKIに対する治療抵抗性につながる可能性を報告している[12]。同様に,台湾のYangらは,ALK陽性肺腺癌における,PD-L1発現とクリゾチニブの治療効果との関連を検討し,PD-L1未発現群の方が,発現有群より有意にPFSの延長が得られたと報告している[13]。以上より,腺癌を主体とする非小細胞肺癌全体では,PD-L1強発現は,ALK-TKI治療効果に対して負の要因となることが示唆されるが,我々の患者を含め,肺扁平上皮癌に関しては不明である。ALK-TKIの効果に寄与する因子について,今後さらなる知見の集積が必要である。
小澤らは,喫煙歴のない49歳の女性に発症した病勢の急速なALK陽性肺扁平上皮癌に対し,アレクチニブ,ブリグチニブ,ロルラチニブの順序で治療を行い,各薬剤で腫瘍縮小効果を認めたものの,いずれの薬剤も効果持続期間は短く,長期奏効は得られなかったと報告している[8]。肺扁平上皮癌においては,いずれのALK-TKIが優先して投与されるべきか,治療抵抗性にどのような因子が寄与するかについては,定まった見解がない。
進行期非小細胞肺癌の標準治療は,ドライバー遺伝子変異/転座の有無とPD-L1の発現率によって選択される[14]。今回は,初回化学療法開始前にALK融合遺伝子陽性が判明したため,アレクチニブを導入した。しかし一方で,ドライバー遺伝子陽性であっても,肺扁平上皮癌の場合,肺腺癌と比べ分子標的治療薬の効果が劣る可能性も指摘されている。EGFR遺伝子変異陽性の肺扁平上皮癌に対するEGFR-TKIの奏効率は38%,PFS中央値は3.1カ月で,肺腺癌に比べ効果が劣るとされる[15]。Mengらは,自験例と過去の文献報告内容より,ALK融合遺伝子陽性の肺扁平上皮癌に対してALK-TKI治療を行った20例を解析した結果,奏効率55.0%,PFS中央値6.4カ月であったと報告している[6]。Lewisらは,米国テキサス州MD Anderson Cancer CenterにおけるIV期肺扁平上皮癌のうち,EGFR遺伝子変異陽性と,ALK融合遺伝子陽性でTKI治療を行った症例の後方視検討を行った[10]。EGFR陽性例では8例中7例(87.5%)でpartial response(PR)もしくはstable disease(SD)が得られ,PFSは4.9カ月,一方ALK陽性例では6例中4例(66.7%)でPRもしくはSDが得られ,PFSは2.9カ月と,肺腺癌に比べると治療効果に乏しい結果であったと報告している[10]。以上より,EGFR遺伝子変異陽性の場合と同様,ALK融合遺伝子陽性の肺扁平上皮癌においてもTKIがどの程度奏効するかについては未解決であり,今後のさらなる検討が必要である。
肺扁平上皮癌では,腺癌と比べドライバー遺伝子変異の陽性頻度が低いため,2013年肺癌分子診断に関する国際ガイドラインでは,腺癌成分を含まない扁平上皮癌でのALK検索は,推奨されていなかった[16]。同ガイドライン2018年のアップデート版では,Key Question 3にExpert consensus opinionとして,ドライバー遺伝子変異が予測される場合において,検索を行ってもよいとされた[17]。同様に,わが国の肺癌診療ガイドライン2022年版では,扁平上皮癌患者においても,若年や非喫煙者などの臨床背景により遺伝子検査を考慮してもよい,とされている[14]。また,日本肺癌学会による肺癌バイオマーカー検査全般に関するお知らせにおける検査アルゴリズム[18]でも,進行および再発非小細胞肺癌がマルチ検査の対象となっていると記載されている。興味深いことに,本症例は,過去喫煙男性であり,ドライバー遺伝子変異が予測されにくい背景であった。
近年,NGSを用いたがんゲノム解析とその結果に基づくがんゲノム診療が急速に広まってきた。Huangらは,重喫煙歴を有する肺扁平上皮癌においてNGS解析によりALK融合遺伝子陽性を確認し,アレクチニブ治療が奏効した,本例同様の症例を報告している[19]。日本肺癌学会による遺伝子パネル検査の手引き[20]では,遺伝子検査の提出において生検検体の大きさ,検体に含まれる腫瘍含有量が遺伝子診断率向上において重要とされている。生検検査で十分な大きさの検体が採取できた場合は,肺扁平上皮癌であってもNGSなどによるドライバー遺伝子変異検索を考慮してよいと考えられる。一方で,Ariyasuらは,オンコマインTM Dx Target Test®によりALK融合遺伝子陽性が認められた5例のうち,1例ではALK免疫染色が陰性かつアレクチニブの治療反応性に乏しかった扁平上皮癌の症例を報告している[21]。生検検査手法と,組織検体の腫瘍量により診断率が影響を受けることもあるため[20][21],肺扁平上皮癌の場合のみならず,NGS検査結果の解釈には,細心の注意が必要である。
扁平上皮癌におけるALK融合遺伝子出現頻度は稀であるものの,分子標的薬の効果が期待できるため,遺伝子病理診断をしてよいと考える。
利益相反の有無:開示すべき利益相反はない。
A 69-year-old male heavy smoker presented with a chest abnormal shadow at a medical health checkup and was referred to our hospital. He was diagnosed with squamous cell lung carcinoma (cT4N3M1a, Stage IVA) by bronchoscopy and systemic radiological examinations. Next generation sequencing of biopsy samples using OncomineTM Dx Target Test® revealed positive for anaplastic lymphoma kinase (ALK) fusion gene. Six months after treatment with alectinib, complete response was achieved without adverse events. Molecular testing for oncogenic drivers would be considered in patients with squamous cell carcinoma.
- Hida T, et al. Alectinib versus crizotinib in patients with ALK-positive non-small-cell lung cancer (J-ALEX): an open-label, randomized phase 3 trial. Lancet. 2017; 390: 29-39. doi: 10.1016/S0140-6736(17)30565-2.
- Watanabe J, et al. Clinical features of squamous cell lung cancer with anaplastic lymphoma kinase (ALK)-rearrangement: a retrospective analysis and review. Oncotarget. 2018; 9: 24000-13. doi: 10.18632/oncotarget.25257.
- Wang J, et al. Detection of ALK protein expression in lung squamous cell carcinomas by immunohistochemistry. J Exp Clin Cancer Res. 2014; 33: 109. doi: 10.1186/s13046-014-0109-2.
- Lam VK, et al. Targeted tissue and cell-free tumor DNA sequencing of advanced lung squamous-cell carcinoma reveals clinically significant prevalence of actionable alterations. Clin Lung Cancer. 2019; 20: 30-6. e3. doi: 10.1016/j.cllc.2018.08.020.
- Wang H, et al. A study of ALK-positive pulmonary squamous-cell carcinoma: from diagnostic methodologies to clinical efficacy. Lung Cancer. 2019; 130: 135-42. doi: 10.1016/j.lungcan.2019.02.015.
- Meng Q, et al. ALK-rearranged squamous cell carcinoma of the lung. Thorac Cancer. 2021; 12: 1106-14. doi: 10.1111/1759-7714.13818.
- Mamesaya N, et al. ALK-rearranged lung squamous cell carcinoma responding to alectinib: a case report and review of the literature. BMC Cancer. 2017; 17: 471. doi: 10.1186/s12885-017-3468-1.
- 小澤亮太, ほか. ALK-TKIシークエンスで治療したALK陽性肺扁平上皮癌の1例. 肺癌. 2022; 62: 1001-8.
- Shiihara J, et al. Dramatic response to alectinib in a patients with ALK-rearranged squamous cell lung cancer. Thorac Cancer. 2021; 12: 2420-3. doi: 10.1111/1759-7714.14092.
- Lewis WE, et al. Efficacy of targeted inhibitors in metastatic lung squamous cell carcinoma with EGFR or ALK alterations. JTO Clin Res Rep. 2021; 2: 100237. doi: 10.1016/j.jtocrr.2021.100237.
- Tamiya A, et al. A case of squamous cell carcinoma harboring an EML4-ALK rearrangement that was unsuccessfully treated with the ALK inhibitor alectinib. J Thorac Oncol. 2015; 10: e74. doi: 10.1097/JTO.0000000000000575.
- Li M, et al. ALK fusion variant 3a/b, concomitant mutations, and high PD-L1 expression were associated with unfavorable clinical response to second-generation ALK TKIs in patients with advanced ALK-rearranged non-small cell lung cancer (GASTO 1061). Lung Cancer. 2022; 165: 54-62. doi: 10.1016/j.lungcan.2022.01.006.
- Yang CY, et al. Association of programmed death-ligand 1 expression with fusion variants and clinical outcomes in patients with anaplastic lymphoma kinase-positive lung adenocarcinoma receiving crizotinib. Oncologist. 2020; 25: 702-11. doi: 10.1634/theoncologist.2020-0088.
- 日本肺癌学会, 編集. 肺癌診療ガイドライン―悪性胸膜中皮腫・胸腺腫瘍含む. 2022年版. 2022.
- Shukuya T, et al. Efficacy of gefitinib for non-adenocarcinoma non-small-cell lung cancer patients harboring epidermal growth factor receptor mutations: a pooled analysis of published reports. Cancer Sci. 2011; 102: 1032-7. doi: 10.1111/j.1349-7006.2011.01887.
- Lindeman NI, et al. Molecular testing guideline for selection of lung cancer patients for EGFR and ALK tyrosine kinase inhibitors: Guideline from the College of American Pathologists, International Association for the Study of Lung Cancer, and Association for Molecular Pathology. J Thorac Oncol. 2013; 8: 823-59. doi: 10.1097/JTO.0b013e318290868f.
- Lindeman NI, et al. Updated molecular testing guideline for the selection of lung cancer patients for treatment with targeted tyrosine kinase inhibitors: Guideline from the College of American Pathologists, the International Association for the Study of Lung Cancer, and the Association for Molecular Pathology. J Thorac Oncol 2018; 13: 323-58. doi: 10.1016/j.jtho.2017.12.001.
- 日本肺癌学会. バイオマーカー委員会. 肺癌バイオマーカー検査全般に関するお知らせ. 検査アルゴリズムについて. 2022年10月21日.
- Huang T, et al. EML4-ALK rearrangement in squamous cell carcinoma shows significant response to anti-ALK inhibitor drugs crizotinib and alectinib. Cancer Chemother Pharmacol. 2018; 81: 965-8. doi: 10.1007/s00280-018-3571-2.
- 日本肺癌学会バイオマーカー委員会. 肺癌患者における次世代シークエンサーを用いた遺伝子パネル検査の手引き. 第2.0版. 2021年10月20日.
- Ariyasu R, et al. Feasibility of next-generation sequencing test for patients with advanced NSCLC in clinical practice. Thorac Cancer. 2021; 12: 504-11. doi: 10.1111/1759-7714.13786.