神原穂奈美,大成洋二郎,高橋 広,井原大輔
マツダ株式会社マツダ病院呼吸器内科(〒735-8585 広島県安芸郡府中町青崎南2-15)
A case of carcinomatous pleurisy due to prostate cancer in which PSA immunohistochemical staining for cell block from pleural fluid was useful for diagnosis
Honami Kambara, Yojiro Onari, Hiroshi Takahashi, Daisuke Ihara
Department of Respiratory Medicine, Mazda Hospital, Mazda Motor Corporation, Japan
Keywords:前立腺特異抗原,前立腺癌,免疫組織化学/prostage specific antigen(PSA),prostate cancer,immunohistochemistry(IHC)
呼吸臨床 2023年7巻12号 論文No.e00182
Jpn Open J Respir Med 2023 Vol. 7 No12 Article No.e00182
DOI: 10.24557/kokyurinsho.7.e00182
受付日:2023年9月8日
掲載日:2023年12月15日
©️Honami Kambara, et al. 本論文はクリエイティブ・コモンズ・ライセンスに準拠し,CC-BY-SA(原作者のクレジット[氏名,作品タイトルなど]を表示し,改変した場合には元の作品と同じCCライセンス[このライセンス]で公開することを主な条件に,営利目的での二次利用も許可されるCCライセンス)のライセンシングとなります。詳しくはクリエイティブ・コモンズ・ジャパンのサイト(https://creativecommons.jp/)をご覧ください。
症例:68歳,男性。
主訴:乾性咳嗽・労作時呼吸困難。
現病歴:受診2週間前から咳嗽・労作時呼吸困難があり,近医を受診した。胸部X線検査で左胸水貯留を認め,胸部CT検査では左胸水貯留・縦隔および肺門リンパ節腫大・両側胸膜の多発結節を指摘された。精査加療目的に当院を紹介受診した。
既往歴:うつ病,不眠症。
内服薬:スルピリド,ミルナシプラン,トリヘキシフェニジル,ブロチゾラム,エスタゾラム,クエチアピンフマル酸。
生活歴:Current smoker(10本×48年),石綿曝露歴なし。
入院時現症:意識晴明。身長161cm,体重53kg。血圧129/79 mmHg,脈拍120 bpm・整,SpO2 92%(room air),呼吸数 20/min。聴診で左肺野の呼吸音減弱を認めた。
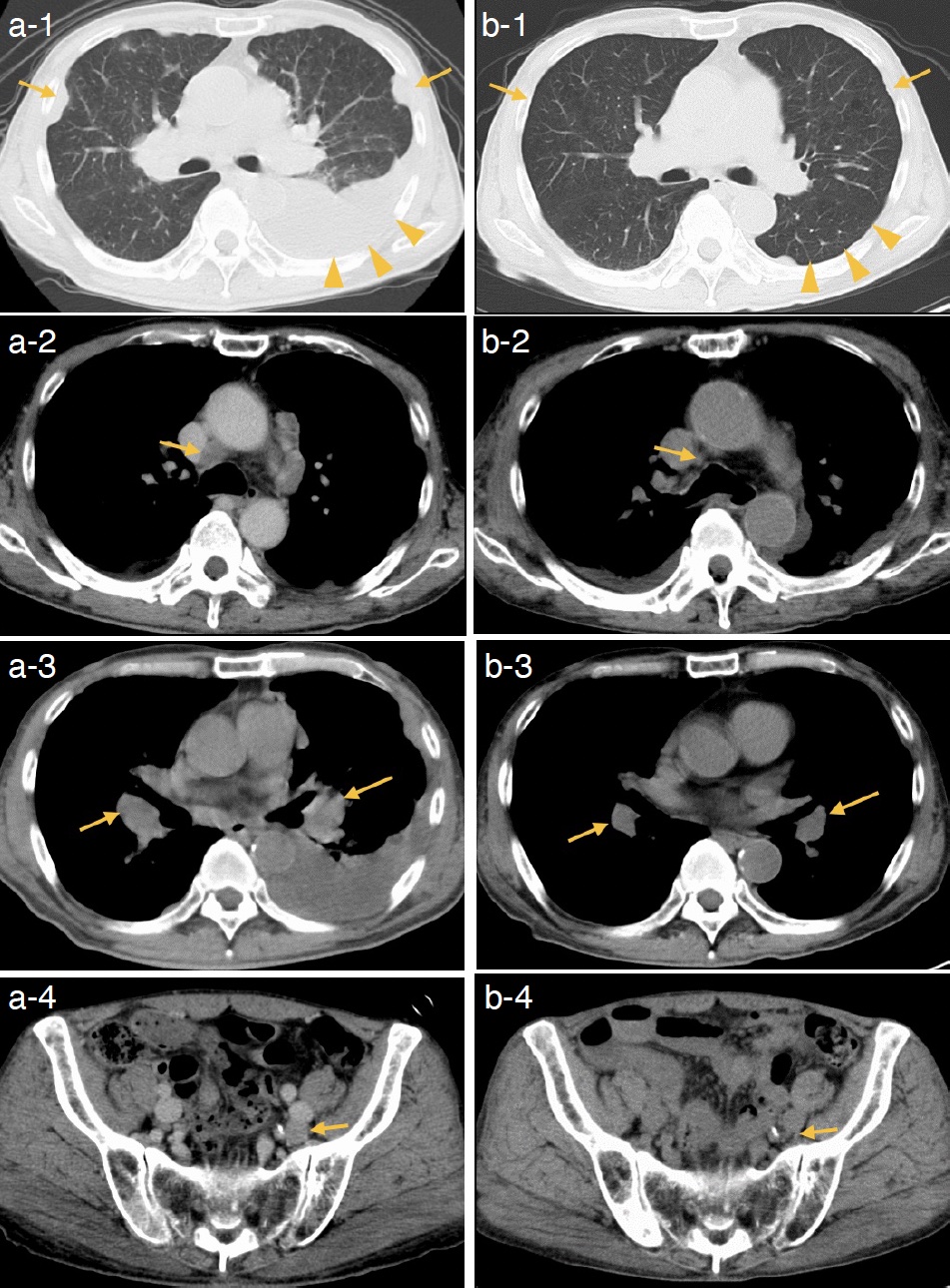
入院時検査所見:血液検査ではCRP,D-dimerの軽度上昇を認め,腫瘍マーカーはCEA,CYFRA,Pro-GRPいずれも正常であった。尿検査では異常を認めなかった(表1)。胸部単純X線写真で左胸水貯留および左肺門部腫大を認め(図1a),胸部単純CTでは左胸水貯留,縦隔リンパ節腫大および両側胸膜の不整形肥厚を認めた(図1b〜d)。
表1 初診時の血液・尿検査所見
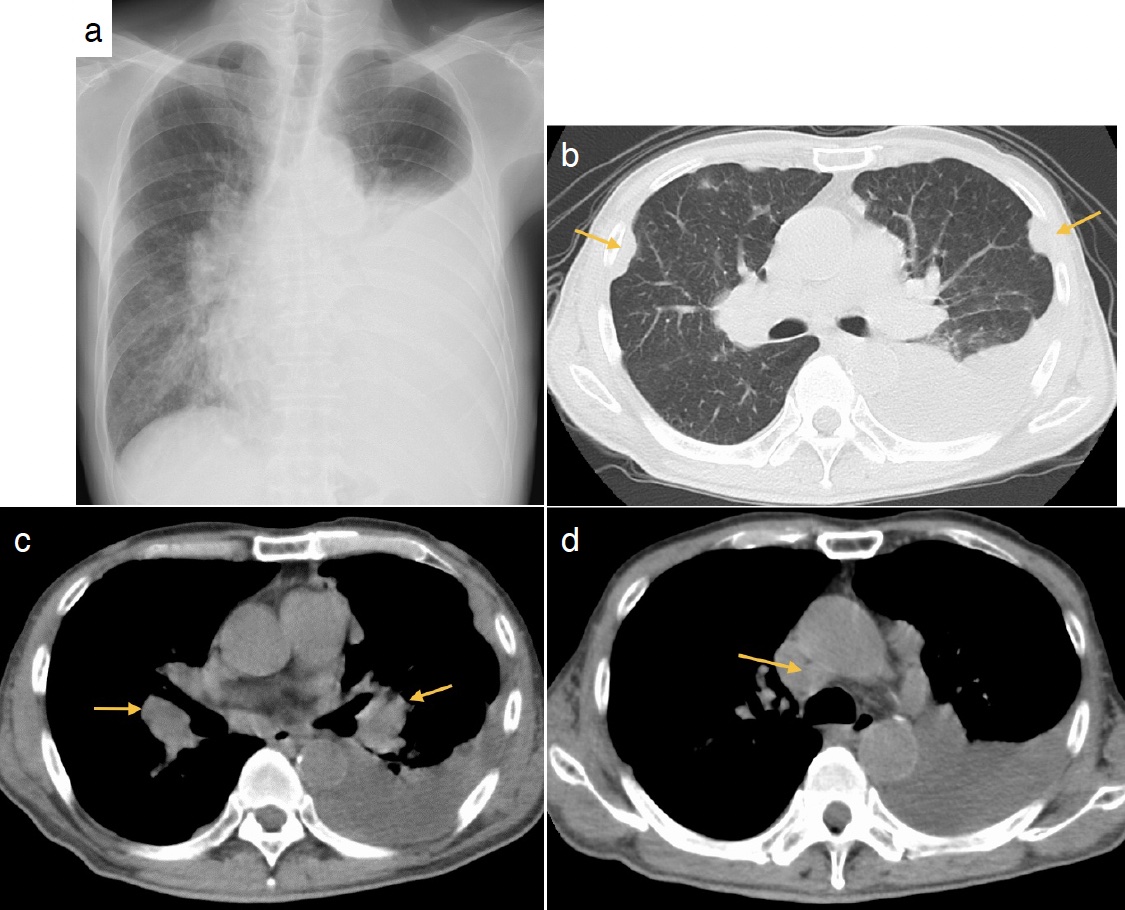
図1 初診時の胸部X線,CT検査
a. 左肺野の 2/3 以上を占める胸水貯留を認める。
b〜d. 左胸水貯留,両側胸膜に複数の不整な肥厚,縦隔・肺門リンパ節腫大を認める。
(b.矢印:胸膜肥厚,c. 矢印:両側肺門リンパ節腫大,d. 矢印:縦隔内リンパ節腫大を示す)
入院後経過:CT上は原発巣を認めなかったが,その他所見から原発性肺癌を第一に疑った。左胸腔ドレナージを行い胸水検査に提出した。胸水はリンパ球優位の滲出性胸水で,一般細菌・抗酸菌培養ともに陰性であった。胸水細胞診で腫瘍細胞を認めたセルブロック標本で行った免疫組織化学的染色では,原発性肺腺癌のマーカーであるTTF-1,Napsin Aは陰性であった(図2a, c, d)。癌性胸膜炎として,原発巣の検索のため全身造影CT検査を行ったところ,既に指摘されていた縦隔および肺門リンパ節腫大・両側胸膜の多発結節の他に,前立腺に造影効果を伴う腫瘤を認め,また,骨盤内リンパ節や骨盤骨に転移性腫瘍を疑う病変を認めた(図3)。両側肺門リンパ節転移を伴う前立腺癌はまれではあるものの,前立腺癌の胸膜転移を疑い左胸水のセルブロック標本にPSA免疫組織化学的染色を追加したところ陽性を示し(図2b),血液生化学ではPSA 301.4ng/mLと高値を示したため,前立腺癌の両側胸膜転移と考えた。その後行った前立腺生検ではGleason score 4+5=9の腺癌を認め,PET-CT検査の結果と合わせて,前立腺癌cT4N1M1c,cStage IVと診断した。
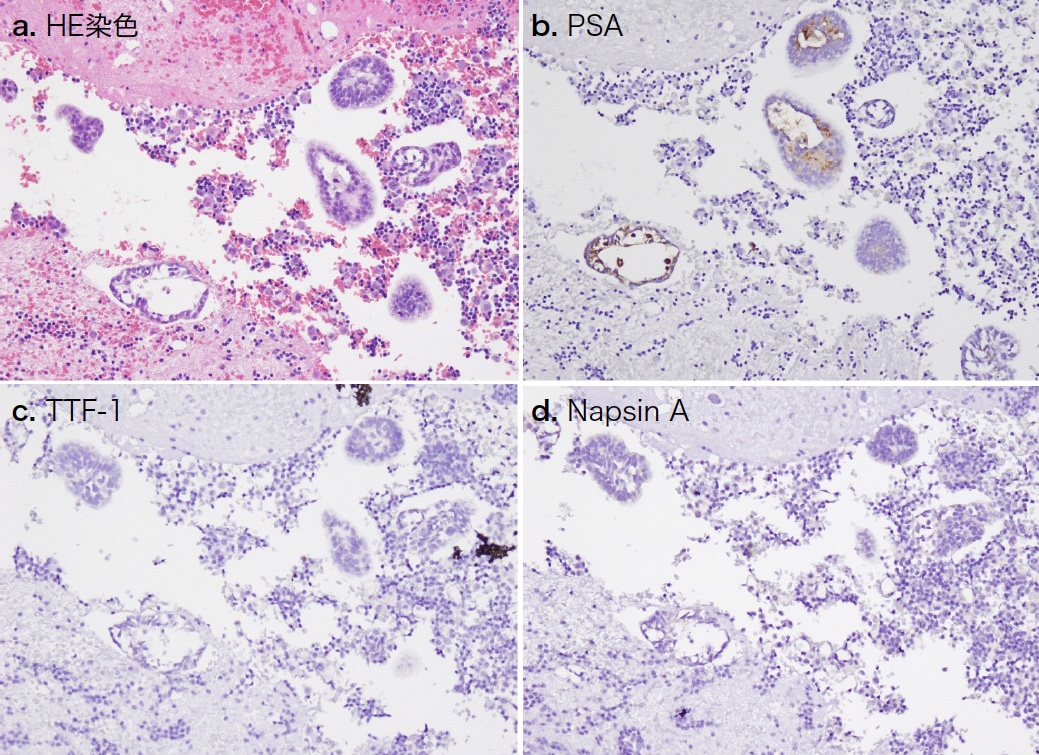
図2 胸水細胞診
a. へマトキシン・エオジン(HE)染色で,小型で軽度の核型不整を示し,核小体が一部で目立つ異型細胞からなる集塊を認める。免疫組織化学的に異型細胞はPSA陽性(b),TTF-1(c),Napsin A(d)陰性を示した。
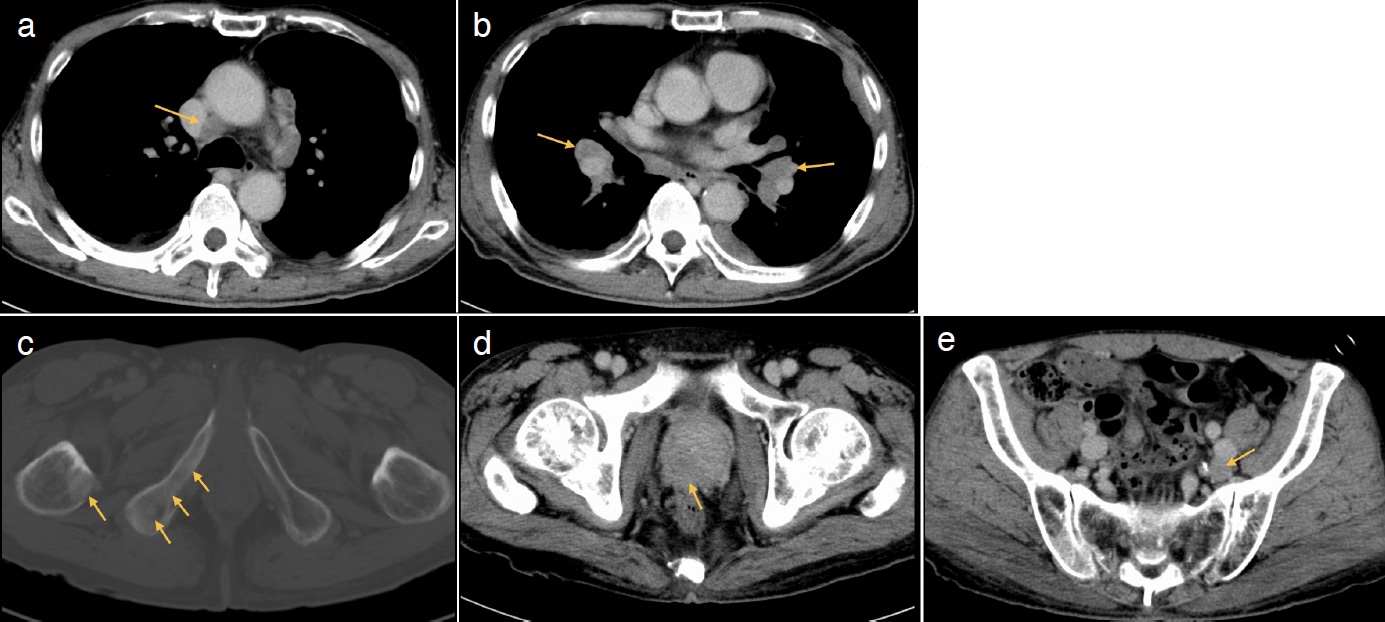
図3 全身造影CT検査
胸部では単純CTと同様に縦隔リンパ節腫大(a. 矢印)および両側肺門リンパ節腫大(b. 矢印)を認める。
体幹部では,骨盤骨の多巣性の造骨性変化(c. 矢印),前立腺の不染領域(d. 矢印),骨盤内リンパ節腫(e. 矢印)を認める。
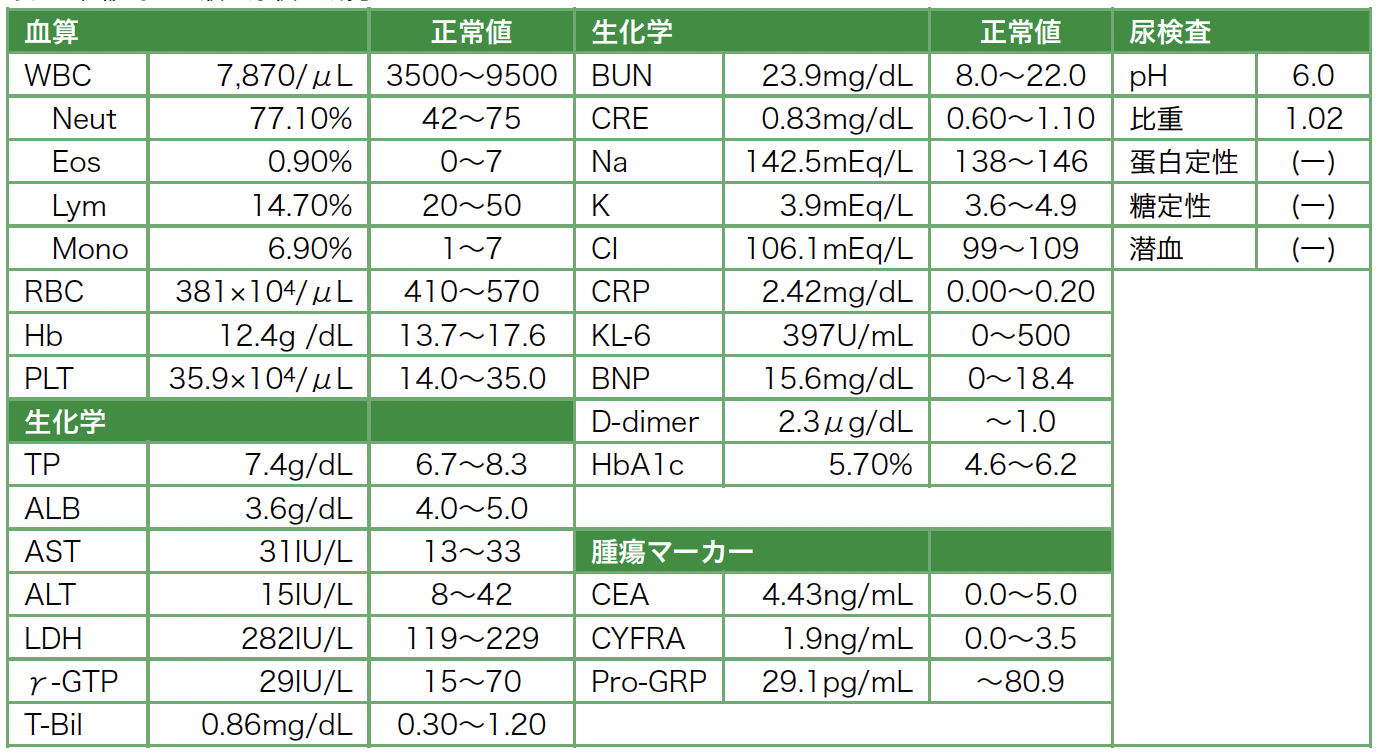
治療経過:抗ホルモン療法により血清PSAは減少・陰性化し,治療開始から約5カ月後の治療終了時には,咳嗽・呼吸困難は改善し,左胸水貯留は消失,両側胸膜やリンパ節の転移巣は著明に縮小ないし消失していた(図4)。
図4 治療前後CT比較(a. 治療開始前,b. 治療開始5カ月後)
a-1. 初診時単純CT。a-2〜4. 治療開始前造影CT。b. 治療開始後5カ月時点での全身単純CT。
左胸水(a-1. 矢頭)はドレーン抜去後再貯留を認めず(b-1. 矢頭)。多発胸膜転移(a-1. 矢印),縦隔リンパ節腫大(a-2. 矢印),肺門リンパ節腫大(a-3. 矢印),骨盤内リンパ節腫大(a-4. 矢印)はいずれも縮小・消失を認めた(b.矢印)。
前立腺癌は男性の部位別がん罹患数1位で,罹患数・死亡者数ともに増加傾向にある[2][3]。その予後は悪性腫瘍の中では比較的良好であり[4][5],進行癌の場合でも,ホルモン療法を早期に導入することで予後の改善が期待できる[6]。
胸水貯留の原因疾患は多岐にわたるが,特に片側胸腔で胸腔2/3以上を占める胸水貯留の原因の約55%は悪性腫瘍である[1]。悪性胸水の原因疾患は肺癌に次いで,乳癌,悪性リンパ腫が多く,前立腺癌は約0~2%とまれである[7][8]。一方、剖検での検討では,前立腺癌の胸膜転移は骨(90.1%),肺(45.7%),肝(25.0%)への転移に次いで21.0%との報告があり[9],生前の臨床側の報告と乖離している。これらの乖離は,生前に前立腺癌胸膜転移の診断を得られていない症例が多く存在する可能性を示唆している。
癌性胸水を疑う胸水の細胞診に対しては,免疫組織化学的検討が腫瘍細胞の有無および原発巣の検索に有用である。特にPSA免疫染色は前立腺癌細胞検出における感度100%,特異度99%との報告があり,精度が高い[10]。本症例では,後日行った前立腺生検で前立腺癌の確定診断を得たが,胸水PSA染色を行ったことで肺癌合併を除外し,肺病変を含め同一疾患であると診断することができた。
前述のように前立腺癌の胸膜転移は病理学的にまれでない可能性があり,高齢男性の片側胸水貯留を認めた場合,前立腺癌の胸膜転移も考慮すべきである。原発臓器の特定に難渋する悪性胸水に対しては胸水セルブロック標本を作製し,免疫組織化学的検討を加えるべきである。
利益相反:本論文執筆に関して申告する利益相反はない。
A 68-year-old man presented with dry cough and dyspnea on exertion for the past 2 weeks. Chest radiographs and simple chest computed tomography revealed left pleural effusion, enlarged bilateral hilar and mediastinal lymph nodes, and multiple pleural nodules. However, no mass lesions were noted in the lung parenchyma. A pleural fluid examination revealed an exudative pleural effusion with lymphocyte predominance and positive cytology. Subsequent whole-body contrast-enhanced computed tomography revealed a prostatic mass and multiple bone metastases. The serum prostate-specific antigen (PSA) level was high; therefore, PSA immunohistochemical staining was performed on cell block from pleural fluid, which was positive, thus confirming the diagnosis of pleural metastasis of prostate cancer. This case suggests that PSA immunohistochemical staining for cell block from pleural fluid may be useful in identifying the causative disease of malignant pleural effusions.