【投稿/症例報告】肝膿瘍穿孔による腹腔内出血を来した非小細胞肺癌の1例

林 伸好,湯澤 基,松本建志
さいたま市民医療センター内科(〒331-0054 埼玉県さいたま市西区島根299-1)
Case of non-small cell lung cancer with intraperitoneal bleeding following the rupture of a liver abscess
Nobuyoshi Hayashi, Motoi Yuzawa, Kenshi Matsumoto
Department of Internal Medicine, Saitama Citizens Medical Center, Saitama
Keywords:非小細胞肺癌,免疫チェックポイント阻害薬,免疫関連有害事象,肝膿瘍,腹腔内出血/non-small cell lung cancer,immune checkpoint inhibitor,immune-related adverse event,liver abscess,intraperitoneal bleeding
呼吸臨床 2025年9巻6号 論文No.e00201
Jpn Open J Respir Med 2025 Vol. 9 No. 6 Article No.e00201
DOI: 10.24557/kokyurinsho.9.e00201
受付日:2025年4月17日
掲載日:2025年6月17日
©️Nobuyoshi Hayashi, et al. 本論文はクリエイティブ・コモンズ・ライセンスに準拠し,CC-BY-SA(原作者のクレジット[氏名,作品タイトルなど]を表示し,改変した場合には元の作品と同じCCライセンス[このライセンス]で公開することを主な条件に,営利目的での二次利用も許可されるCCライセンス)のライセンシングとなります。詳しくはクリエイティブ・コモンズ・ジャパンのサイト(https://creativecommons.jp/)をご覧ください。
症例は76歳,男性。右上葉肺腺癌に対してX年1月よりcarboplatin+nab-paclitaxel療法を施行するもPDになったため,pembrolizumab療法を実施した。自己免疫性膵炎および胆管狭窄を発症したためprednisoloneを開始した。X年9月より肝膿瘍が生じ抗菌薬治療を施行したが,肝膿瘍穿破による腹腔内出血が出現した。出血源である右肝動脈に対して塞栓術を行い救命し得た。
PembrolizumabはPD-1(programmed cell death 1)阻害作用をもつヒト化免疫グロブリンIgG4モノロナール抗体である。Pembrolizumabは腫瘍表面に存在するPD-L1(programmed cell death ligand 1)とPD-1(programmed cell death 1)とのリガンド結合を阻害し,非小細胞肺癌の治療効果を改善してきたが[1][2],さまざまな免疫関連有害事象(immune-related adverse event;irAE)が報告されている[3]。PembrolizumabによりirAEと思われる自己免疫性膵炎後,腹腔内出血を伴った肝膿瘍が発生した症例を報告する。
症例:76歳,男性。
主訴:右下腹部痛,発熱および全身倦怠感。
既往歴:右上葉肺腺癌,自己免疫性膵炎,慢性閉塞性肺疾患および胃潰瘍。
家族歴:特記事項なし。
喫煙歴:20本/日,20〜70歳。
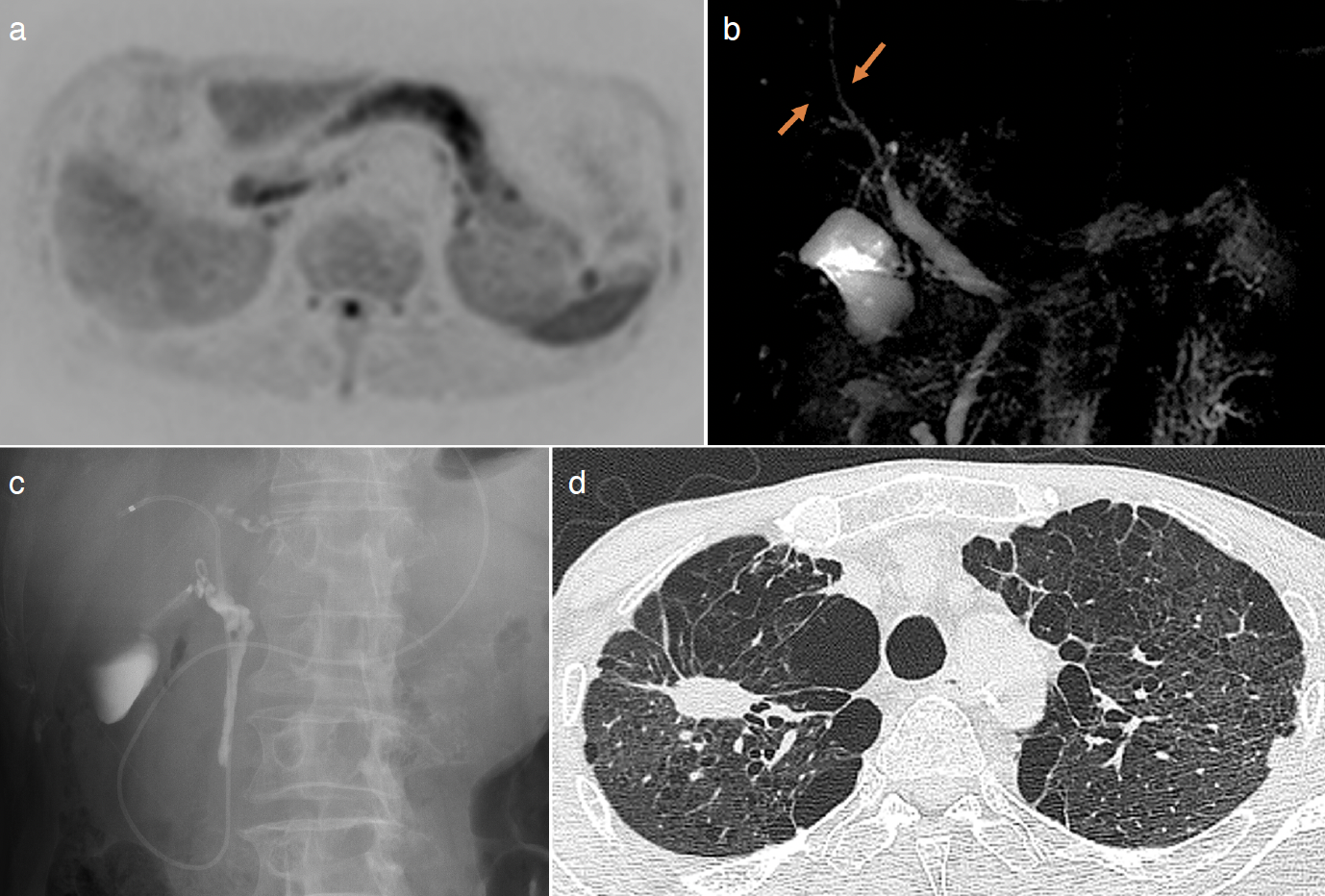
現病歴:右肩甲骨転移のある右上葉肺腺癌cT3N1M1b stage ⅣBに対してX年1月からcarboplatin+nab-paclitaxel療法を4コース行ったが,治療効果の判定では病態進行(progressive disease:PD)であった。腫瘍組織におけPD-L1発現割合が1~49%であったためX年4月から2次治療としてpembrolizumab療法を5コース施行した。X年8月にirAEと思われる自己免疫性膵炎を発症しため(図1a,b),30mg/日(0.5mg/kg/日)のprednisoloneを開始した。またirAE胆管炎による狭窄による閉塞性黄疸が出現しており内視鏡的胆管ステント留置術(endoscopic biliary stenting:EBS)を行った(図1c)。膵炎および胆管炎の所見は軽快したためprednisolone内服量を漸減していたが,9月中旬より食思不振および全身倦怠感が出現し,さらに右下腹部痛および発熱を認め緊急入院となった。
図1 膵炎および胆管炎の発症時の画像所見
a. 拡散強調磁気共鳴画像(MRI)。膵臓全体に異常信号が認められた。
b. 磁気共鳴胆道膵管造影(MRCP)。肝内胆管および肝外胆管に,明らかな閉塞は認められなかった(矢印)。
c. 内視鏡的逆行性胆道膵管造影(ERCP)。軽度の壁不整と胆管の軽度狭窄が認められた。
d. 入院後のコンピュータ断層撮影(CT)画像所見。入院時の胸部単純CTでは,右S1に4 cm大のスピキュラを伴う腫瘤が認められ,両肺に気腫性変化が認められた。
入院時身体所見:身長175cm,体重90kg,BMI 29.4kg/m2,体温37.8℃,血圧112/64mmHg,脈拍66回/分,不整。呼吸数16回/分,SpO2 95%(室内気)。腹部 平坦やや硬,右上腹部に圧痛あるも反跳痛なし。腸蠕動音減弱していた。
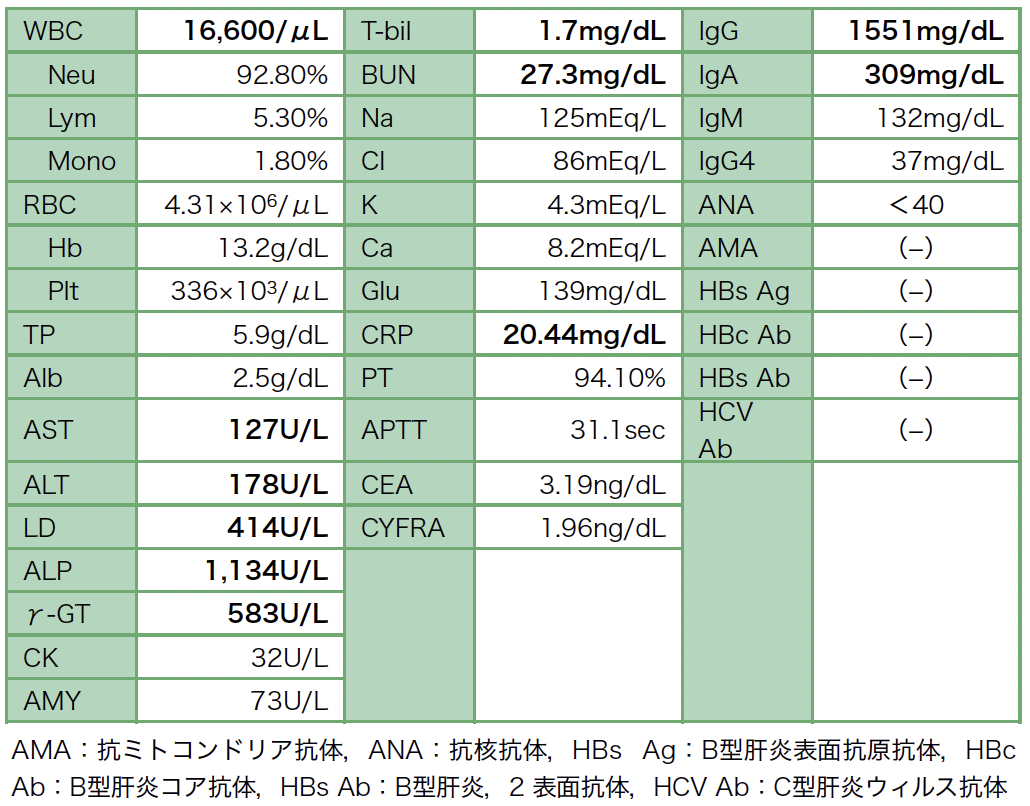
入院時血液検査(表1):白血球およびCRPの上昇といった炎症所見,肝胆道系酵素高値,凝固能検査の軽度異常また脱水によるBUNの上昇を認めた。Pembrolizumab療法前のX年1月におけるCYFRAの値が2.8ng/mL,CEAの値が141.9ng/mLが高値であったが,CEAとCYFRAは正常値であった。またIgG4の値は低値で,抗核抗体,抗ミトコンドリア抗体など自己免疫性肝炎や肝炎ウィルスの感染を示唆するものはなかった。
表1 入院時の臨床検査値
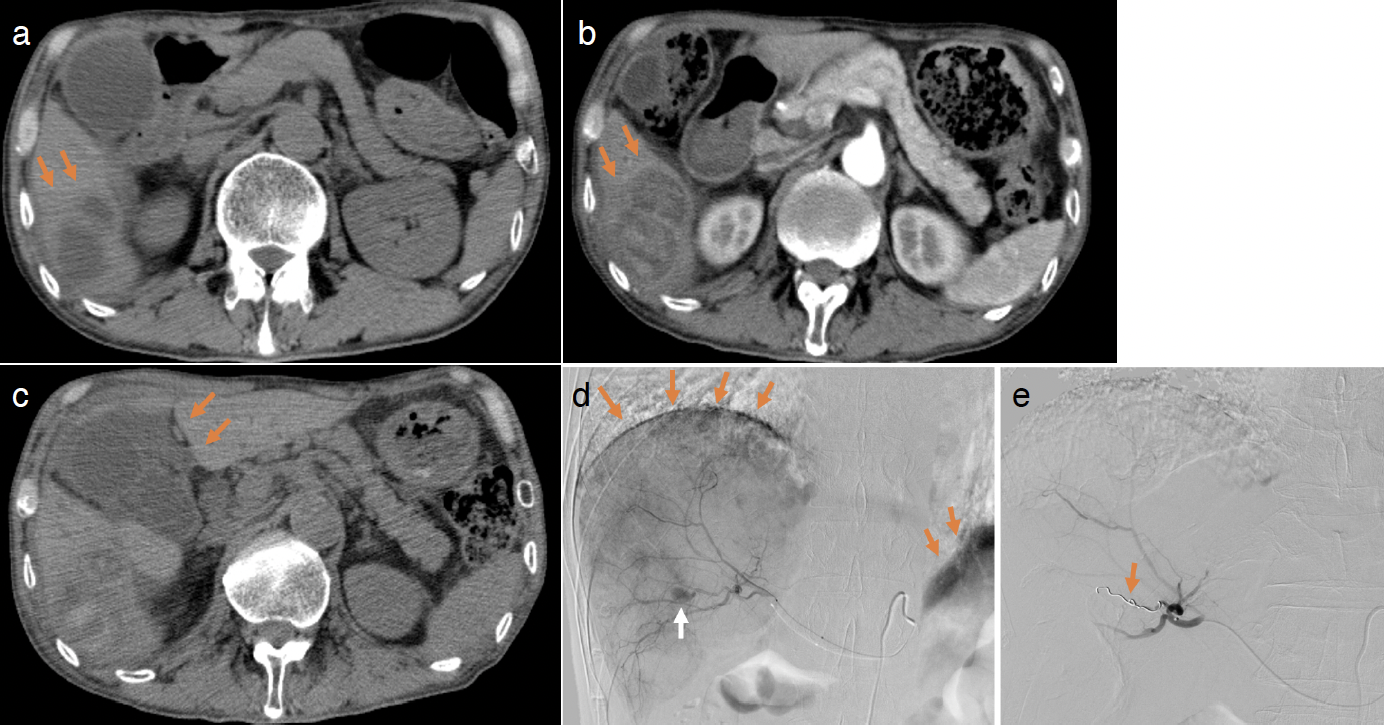
臨床経過:胸部単純CT画像所見では右上葉の腫瘤影を認めるも,以前からの肺癌の増大および新たな転移巣の出現はみられず,stable disease(SD)状態を保っていた(図1d)。また右下腹部痛および発熱の原因として,臨床症状,血液検査および腹部CT所見(図2a)から肝膿瘍と診断した。入院日より肝膿瘍に対してampicillin sodium sulbactam sodiumによる抗菌薬治療開始し,第3病日metronidazoleによる追加抗菌薬療法したが,第5病日に右下腹部痛が増悪した。造影腹部CT画像所見(図2b)にて肝膿瘍増大しており内部には出血と思われる像が出現した。アセトアミノフェンで腹痛を改善できたため,慎重に経過をみることにした。第10病日に腹痛が再度増悪し,さらに腹膜刺激症状もみられ,単純CT画像所見(図2c)では肝膿瘍周囲の血腫を認めたため,第11病日に肝動脈塞栓術(transcatheter arterial embolization:TAE)を施行し止血した(図2d,e)。
図2 入院時の腹部単純CT
膵頭から膵体部にかけてソーセージ状に腫大した膵臓が認められ,自己免疫性膵炎が示唆された(a)。肝臓S6に結節が認められ,肝膿瘍と思われ,大きさは10~30mmで,辺縁に淡い低吸収域を認めた(a.矢印)。入院5日目の腹部造影CTでは,入院時に認められた肝膿瘍が拡大し,内部に出血を伴うと疑われる高吸収域が認められた(b.矢印)。入院10日目の腹部単純CTでは,肝膿瘍の拡大と周囲の血腫の出現により肝膿瘍の境界が不明瞭であった(c.矢印)。腹腔内出血による造影剤の腹腔内へextravasationがみられ(d.橙矢印),さらに右肝動脈から仮性動脈瘤と思われる造影剤プールが認められた(d.白矢印)。標的血管の根元からゼラチンスポンジと3×2.5 mmコイル2本を用いて塞栓術を施行した(e.矢印)。
血液培養からKlebsiella oxytoca検出したため第20病日より感受性のあるcefmetazoleによる静注療法し,第30病日よりlevofloxacinの経口抗菌薬の治療を施行して,肝膿瘍の病勢は安定した。またADLが低下していたため,理学療法を3週間程度継続して退院となった。患者が抗悪性腫瘍薬療法の継続を希望しなかったため,3次以降の薬物療法は施行しなかった。それにもかかわらず,小脳転移が出現するまで約2年間SDの状態を保っていた。
ICI施行後にirAEによる膵炎および胆管炎が発生し,さらに肝膿瘍を伴った非小細胞性肺癌の1例を経験した。ICIは切除不能進行および再発非小細胞肺癌の治療において,臨床的な有効性を示しているが[1],免疫系の制御不能な活性化によるirAEが発生することがある[2]。irAEは,消化管,肺,内分泌器および皮膚などに多くみられ,ICIによりirAEによる膵炎は1.9%(150/7702)発生する[4]。ICIであるpembrolizumabを5コース施行後に,膵酵素の上昇と腹部MRI画像所見(図2a,b)にて胆道狭窄および膵頭部から膵体部にかけてソーセージ様に腫大がみられ,ICIによる自己免疫膵炎が起こったものと考えた。胆管狭窄による閉塞性黄疸や腹痛を有するgrade 2以上免疫関連の膵炎に対してステロイド治療が推奨され[5][6],胆管炎に対してEBSを施行してprednisoloneを開始した。
本症例ではさらに肝膿瘍が出現した。肝膿瘍の流入経路は経胆道性によるものが約50%と報告されている[7]。感染した胆汁が直接肝細胞に接触するためであり,本症例のようにEBSの留置や内視鏡的乳頭括約筋切開術などが肝膿瘍のリスクとなる[7]。さらに肝膿瘍のリスク因子として免疫不全や,糖尿病,悪性疾患,慢性肺疾患があり[8],本症例でも,prednisoloneの内服に伴う免疫不全および進行性の非小細胞性肺癌があり,肝膿瘍の高リスクであった。
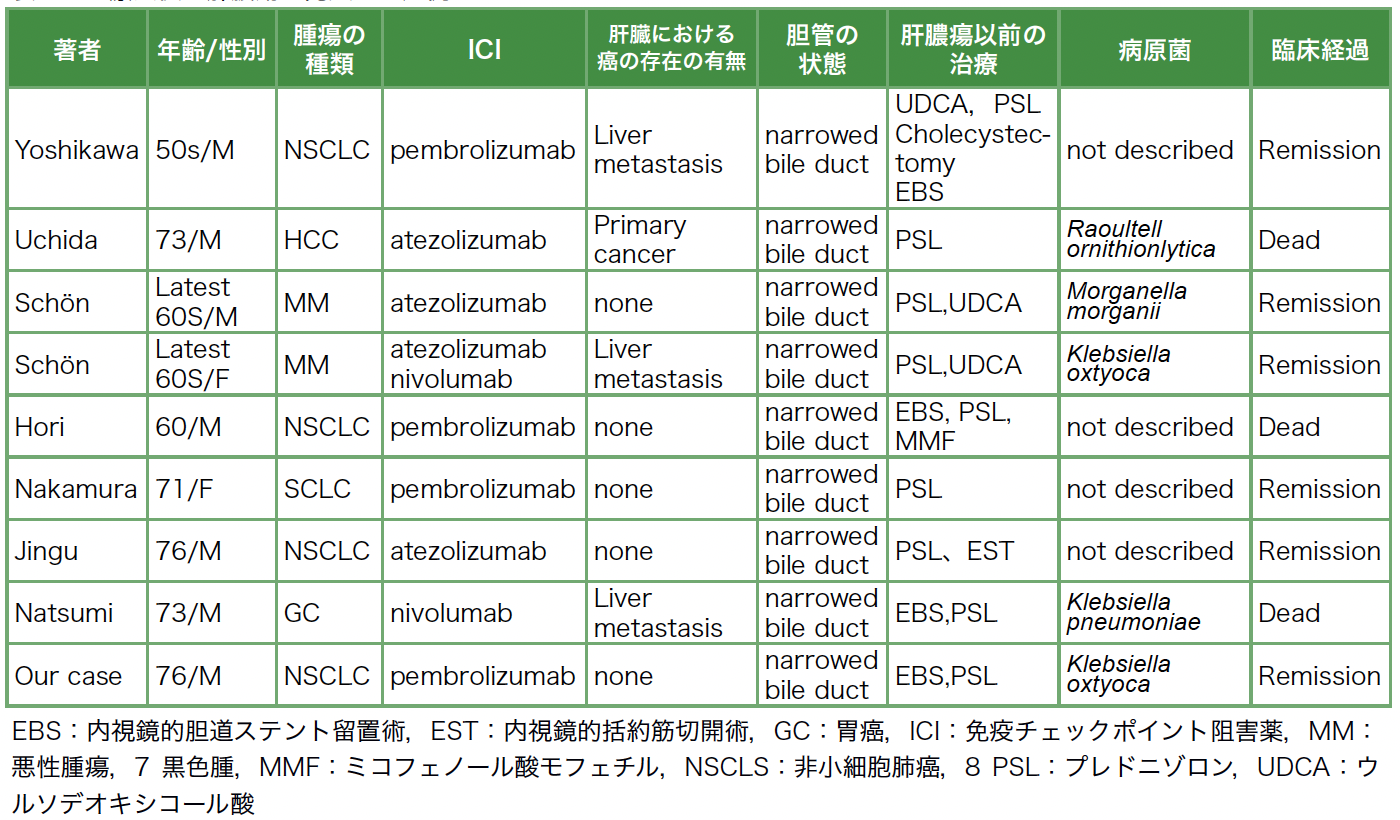
医学中央雑誌およびPubMedで調べた限りはICI療法後に肝膿瘍を来した症例は本症例含めて9例と報告は少ないが3例が死亡しており緊急性がある(表2)[9]〜[15]。肝臓に転移巣や原発巣が存在し,肝膿瘍となった症例は4例しかない。すべての症例では胆管狭窄がみられており[9]〜[15],EBS留置術および内視鏡的乳頭括約筋切開術などを施行した症例は5例である。従来,自己免疫性膵炎における閉塞性黄疸に対してEBSなどの胆道ドレナージ療法がされてきたが[16],胆管ドレナージ療法なしでステロイド療法だけで治療できると報告されている[17]。さらにHoriらによるとirAEによる胆管狭窄が考えられるときも,EBS留置では患者の状態が改善せず勧めていない[12]。少数の検討ではあるが,むしろirAEによる胆管狭窄にEBS留置術および内視鏡的乳頭括約筋切開術は肝膿瘍のリスクになる可能性がある。
表2 ICI療法後に肝膿瘍が発生した症例
本邦の肝膿瘍の153例の検討では9例(5.9%)に肝外への出血・穿破がみられている[18]。本症例も第10病日腹膜刺激症状が出現,肝動脈造影検査で周囲の膿瘍壁の造影剤漏出がみられ肝外への出血・穿破しており,肝外への出血は肝臓の仮性動脈瘤によるものであった。肝動脈瘤破裂例では動脈壁の脆弱性,周囲炎症などを合併していることが多く,血行再建を伴う手術は困難であるため,TAEが第1選択と考えられる[19]〜[21]。本症例もTAEにて止血し救命できた。
irAEによりICI療法を中止した症例にはその後の薬物療法を施行せずに,腫瘍に対する活動性T細胞浸潤を回復させ,特異的免疫応答による持続的な効果を示す報告がなされており[21],退院後薬物療法は継続できなかったが,本症例は約2年間SDの状態を保っていた。
irAEによる膵炎および胆管炎治療後に肝膿瘍を伴った非小細胞性肺癌の1例を経験した。肝膿瘍は致命的なことが多く,本症例も腹腔内出血を来したがTAEにて救命できた。
謝辞:本症例の診療にご協力いただいた当院島田裕司先生および小林智博先生に深謝します。
利益相反:本主題に関して利益相反はない。
The patient was a 76-year-old man with stage IVB cT3N1M1b right upper lobe lung adenocarcinoma. He had been treated with carboplatin + nab-paclitaxel therapy since January of year X, but due to disease progression, pembrolizumab monotherapy was initiated. After completing five courses of monotherapy, he developed immune-related adverse events called autoimmune pancreatitis and bile duct stricture, so prednisolone therapy was administered. In mid-September of year X, the patient complained of right lower abdominal pain and fever. He was diagnosed as a liver abscess and treated with antibiotics, but intraperitoneal bleeding occurred due to the rupture of the liver abscess. Embolization was performed on the pseudoaneurysm to stop the bleeding from the right hepatic artery, and the patient survived.
- Martin Reck, et al. Pembrolizumab versus chemotherapy for PD-L1-positive non small cell lung cancer. N Engl J Med. 2016; 375: 1823-33.
- 日本肺癌学会,編. 肺癌診療ガイドライン2024年版. 2024: 234-5.
- Postow MA, et al. Immune-related adverse events associated with immune checkpoint blockade. N Engl J Med 2018; 378: 158-68.
- George J, et al. Incidence of pancreatitis with the use of immune checkpoint inhibitors (ICI) in advanced cancers: A systematic review and meta-analysis. Pancreatology. 2019; 19: 587-94.
- 日本膵臓学会・厚生労働省 IgG4 関連疾患の診断基準並びに治療指針を目指す研究班. 自己免疫性膵炎診療ガイドライン 2020. 膵臓. 2020; 35: 468-550.
- Thompson JA, et al. Management of immunotherapy-related toxicities, Version 1. 2019. J Natl Compr Canc Netw. 2019; 17: 255-89.
- 竹中 完, ほか. 肝胆膵・術後病態を学ぶ:その他関連疾患 肝膿瘍 胆道疾患関連肝膿瘍を中心に(解説/特集). 肝胆膵2014; 6: 93-8.
- Losie JA, et al. Epidemiology and risk factors for pyogenic liver abscess in the Calgary Health Zone revisited: a population-based study. BMC Infect Dis. 2021; 10: 587-94.
- 吉川成一, ほか. 胆管炎, 胆嚢炎を発症後, 胆管狭窄による肝膿瘍を発症したirAE胆管炎の1例. 胆道. 2021; 35: 549.
- Uchida K, et al. Liver abscess in advanced hepatocellular carcinoma after atezolizumab plus bevacizumab treatment: A case report. Medicine. 2022; 101: e30486.
- Schön V, et al. Immune-related sclerosing cholangitis and subsequent pyogenic liver abscesses in two patients with melanoma treated by triplet therapy: A case report. J Immunother. 2023; 46: 346-50.
- Hori H, et al. Pembrolizumab-related cholangitis with multiple fatal liver abscesses after endoscopic biliary drainage: a case report and review of the literature. A Clin J Gastroenterol. 2022; 15: 475-9.
- 中村初音, ほか. ペムブロリズマブによる硬化性胆管炎を契機に肝被膜下膿瘍を呈した肺小細胞癌の一例. 日本消化器病学会関東支部例会プログラム・抄録集. 2023; 374: 31.
- Jingu D, et al. Atezolizumab-related sclerosing cholangitis with multiple liver abscesses in a patient with lung squamous cell carcinoma: A case report. Respirol Case Rep. 2024; 12: e01324.
- Suzuki N, et al. Rapid tumor progression complicated with liver abscess in a patient with gastric cancer receiving nivolumab therapy. Int Cancer Conf J. 2024; 13: 119-23.
- Okazaki K, et al. Japanese consensus guidelines for management of autoimmune pancreatitis: I. Concept and diagnosis of autoimmune pancreatitis. J Gastroenterol.2010; 45: 249-65.
- Yan Bi, et al. Obstructive jaundice in autoimmune pancreatitis can be safely treated with corticosteroids alone without biliary stenting. Pancreatology. 2016; 16: 391-6.
- 重福隆太, ほか. 過去20年間における肝膿瘍153例臨床的検討. 肝臓. 2018; 59: 466-80.
- Hosn MA, et al. Visceral artery aneurysms: decision making and treatment options in the new era of minimally invasive and endovascular surgery. Int J Angiol. 2019; 28: 11-6.
- 貝原正樹, ほか. 肝膿瘍治療過程で生じた仮性肝動脈の1例. 日腹部救急医会. 2016; 36: 1111-4.
- 村田智, ほか. 胆道・肝・膵の出血.日腹部救急医会誌. 2004; 24: 869-73.
- Michielin O, et al. Defining unique clinical hallmarks for immune checkpoint inhibitor-based therapies. J Immunother Cancer. 2022; 10: e003024. doi: 10.1136/jitc-2021-003024.