岡田茉莉花*1,片野拓馬*1,米澤利幸*1,田中博之*1,梶川茂久*1,加藤俊夫*1, 久保昭仁*1,川谷陽子*2,清水由希*2,大石 大*3,津田雅庸*3,武山直志*3,伊藤 理*1
*1愛知医科大学医学部内科学講座(呼吸器・アレルギー内科)
(〒480-1195 愛知県長久手市岩作雁又1-1)
*2愛知医科大学病院看護部
*3愛知医科大学救命救急科
A case of severe COVID-19 pneumonia successfully treated with ECMO
Marika Okada*1, Takuma Katano*1, Toshiyuki Yonezawa*1, Hiroyuki Tanaka*1, Shigehisa Kajikawa*1, Toshio Kato*1, Akihito Kubo*1, Yoko Kawatani*2, Yuki Shimizu*2, Dai Oishi*3, Masanobu Tsuda*3, Naoshi Takeyama*3, Satoru Ito*1
*1Department of Respiratory Medicine and Allergology, Aichi Medical University, Aichi
*2Department of Nursing, Aichi Medical University Hospital, Aichi
*3Department of Emergency and Critical Care Medicine, Aichi Medical University, Aichi
Keywords:新型コロナウイルス感染症(COVID-19),人工呼吸管理,体外式膜型人工肺(ECMO),リクルートメント手技,リハビリテーション/coronavirus infectious disease 2019 (COVID-19), mechanical ventilation, extracorporeal membranous oxygenation (ECMO), recruitment maneuver, rehabilitation
呼吸臨床 2021年5巻9号 論文No. e00136
Jpn Open J Respir Med 2021 Vol. 5 No. 9 Article No.e00136
DOI: 10.24557/kokyurinsho.5.e00136
受付日:2021年7月6日
掲載日:2021年9月17日
©️Marika Okada, et al. 本論文はクリエイティブ・コモンズ・ライセンスに準拠し,CC-BY-SA(原作者のクレジット[氏名,作品タイトルなど]を表示し,改変した場合には元の作品と同じCCライセンス[このライセンス]で公開することを主な条件に,営利目的での二次利用も許可されるCCライセンス)のライセンシングとなります。詳しくはクリエイティブ・コモンズ・ジャパンのサイト(https://creativecommons.jp/)をご覧ください。
症例:50歳代男性,20本/日×33年の現喫煙者。
既往歴:顔面神経麻痺。
併存症:2型糖尿病のためビルダグリプチン・メトホルミン配合剤およびダパグリフロジンで治療中。
現病歴:COVID-19の日本国内における流行第2波の最中,発熱と倦怠感が出現したため,発症4日目に前医を受診した。新型コロナウイルス抗原検査で陽性となり,胸部X線(図1a)およびcomputed tomography(CT)画像(図2a,b)で新型コロナウイルス肺炎と診断され,前医に緊急入院した。入院日よりシクレソニド吸入とファビピラビル内服が開始された。入院時には酸素需要はなかったが,前医入院3日目には酸素吸入1L/分が必要となり,デキサメタゾン6.0mg/日の内服が追加された。前医入院7日目に呼吸不全が悪化したため人工呼吸器管理が必要と判断され,愛知医科大学病院(以下,当院)へ転院搬送となった。搬送後,救急外来で気管内挿管され,集中治療室(ICU)へ入室した。
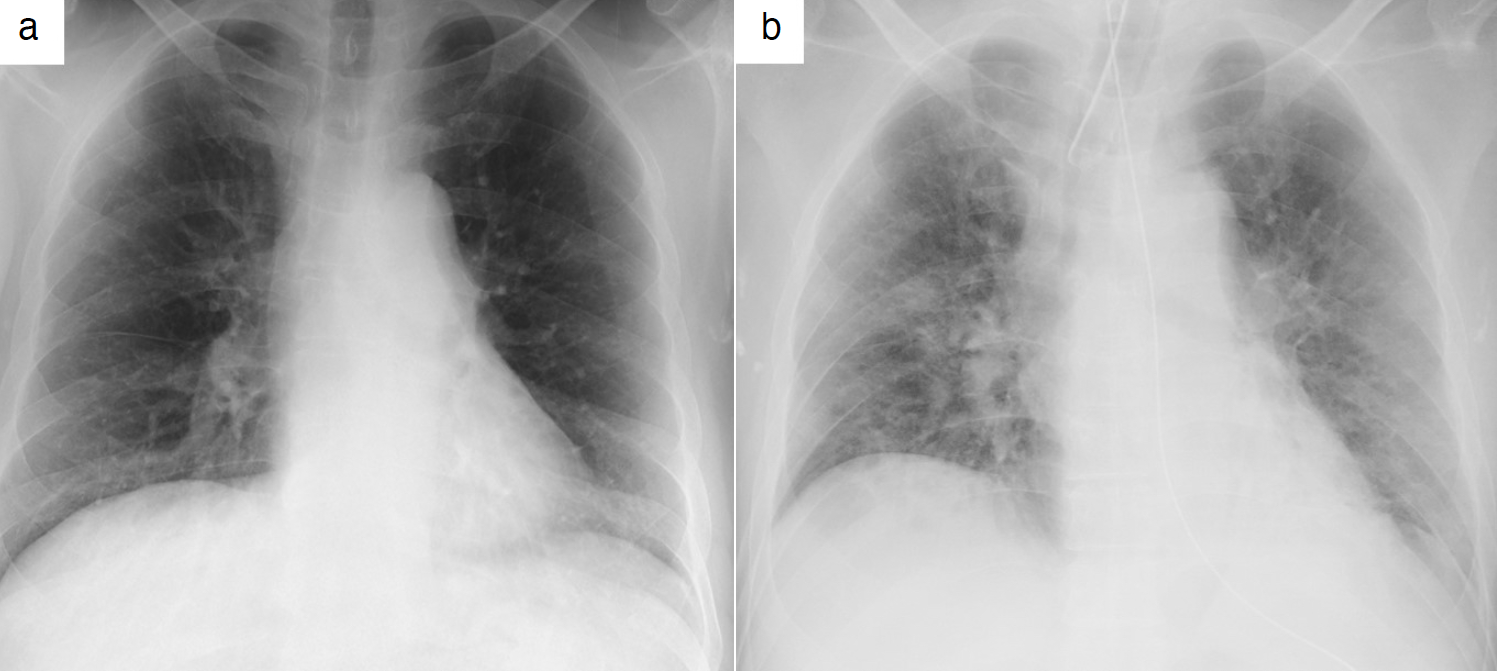
図1 胸部X線画像
a. 前医入院時。両下肺野の辺縁主体にすりガラス陰影を認めた。
b. 気管内挿管直後。両肺全体にすりガラス影を認めた。
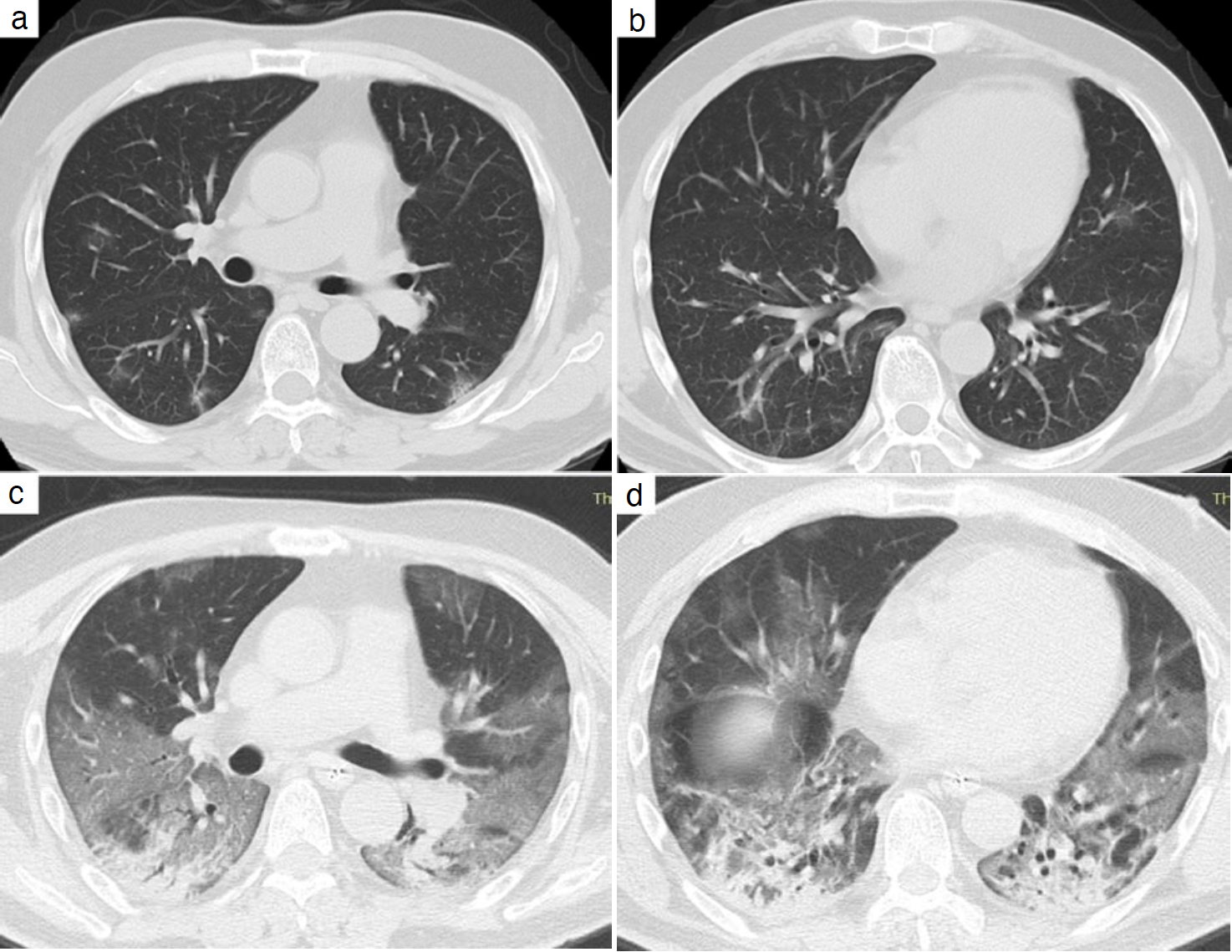
図2 胸部CT画像
a, b. 前医入院時。両側の胸膜直下に斑状のすりガラス陰影を認めた。
c, d. 気管内挿管直後。両側肺の背側優位にびまん性の広範なすりガラス陰影と内部に気管支及び細気管支拡張を伴う浸潤影を認めた。
入院時現症:身長175cm,体重65.6kg,BMI 21.4,心拍数;79回/分,血圧98/61mmHg,SpO2 88%(酸素マスク15L/分),呼吸音は両側fine cracklesを聴取した。
胸部画像所見:前医入院時(発症4日目)では,胸部X線上,両下肺野の辺縁主体にすりガラス陰影を認め(図1a),胸部CT上,両側肺の胸膜直下に斑状のすりガラス陰影を認めた(図2a,b)。当院に転院し,気管内挿管後(発症10日目)に撮影した胸部X線では両肺全体にすりガラス影を認め(図1b),胸部CTでは両側肺の背側優位にびまん性の広範なすりガラス陰影と内部に気管支及び細気管支拡張を伴う浸潤影を認めた(図2c,d)。
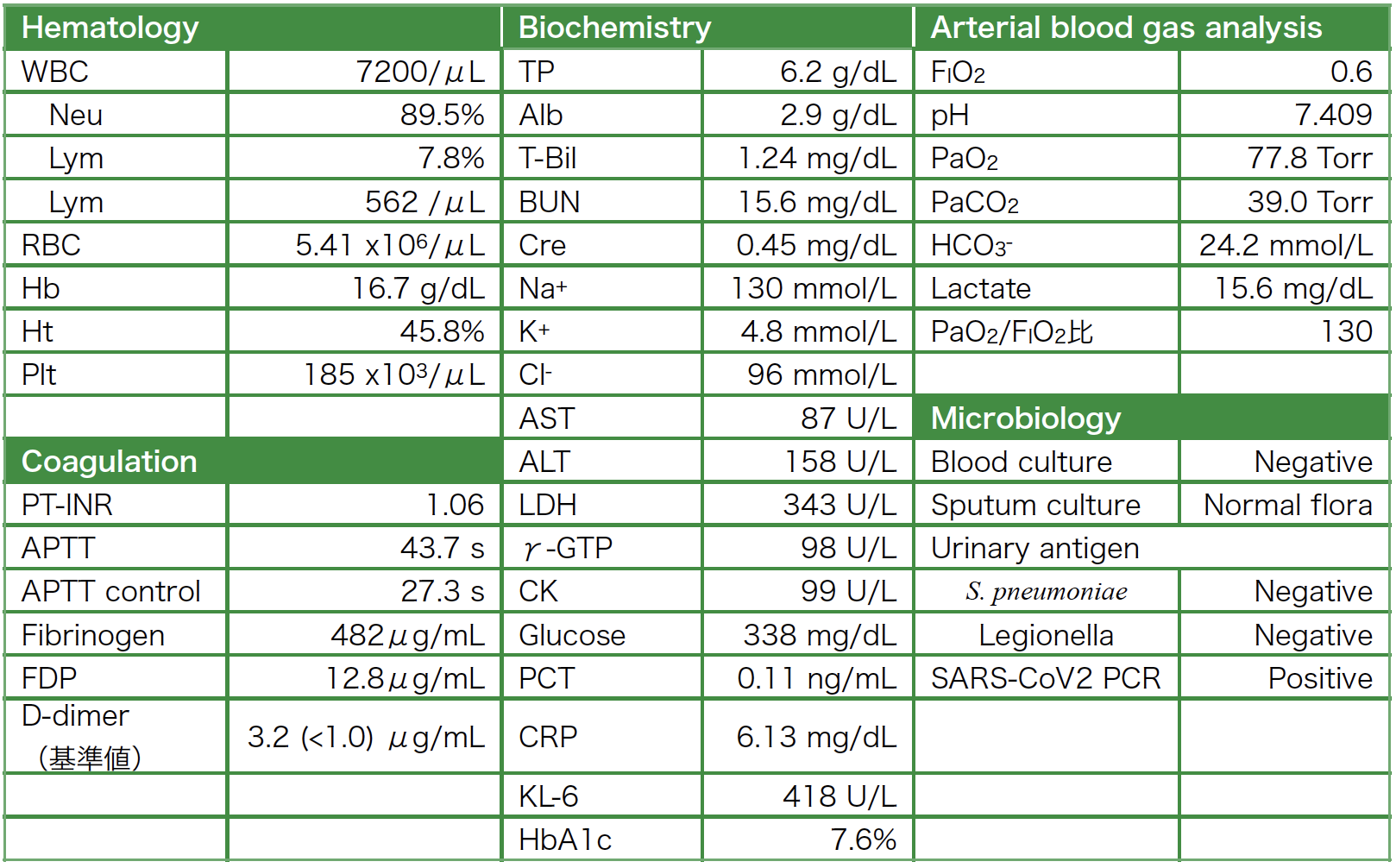
入院時検査所見:表1に示す。白血球数7200/μL,うちリンパ球数は562/μLと減少していた。AST 87U/L,ALT 158U/Lと軽度の肝機能異常を認めた。CRP 6.13mg/dLおよびD-dimer 3.20μg/mLは高値であった。プロカルシトニン0.11ng/mL,KL-6 418U/mLは正常範囲内であった。HbA1c 7.6%と糖尿病コントロールは良好ではなかった。動脈血液ガス所見は人工呼吸器装着下(FIO2 0.6,PEEP 8cmH2O)でPaO2 77.8Torr,PaO2/FIO2比は130mmHgとBerlin基準[3]中等症のARDSを呈していた。鼻咽頭ぬぐい液検体での核酸増幅検査でSARS-CoV-2陽性が確認された。
経過を図3に示す。当院転院直後から人工呼吸管理となり,デキサメタゾン6.6mg/日の点滴静注およびファビピラビルの経管投与による治療を継続し,ナファモスタットメシル酸塩の持続静脈注射を追加した。細菌二次感染の可能性も考えタゾバクタム・ピペラシリン13.5g/日併用を開始した。鎮静のためプロポフォールとフェンタニルを併用し,看護師により他動関節可動域(range of motion:ROM)訓練,2時間毎に側臥位までの体位変換を開始した。栄養管理としては中心静脈栄養に並行して経管栄養を転院第2日より開始した。転院第2日に高サイトカイン血症に対してポリミキシンB固定化線維カラムを用いた直接血液灌流法(direct hemoperfusion using a polymyxin B immobilized fiber column:PMX-DHP)によるエンドトキシン吸着療法を開始し,2日間継続した。転院第4日にファビピラビルを終了して,レムデシビルを開始,転院第6日よりD-dimer値の上昇も認めたため,ヘパリンの持続静脈注射を開始した。PMX-DHP終了後,一時的に胸部X線画像の改善を認めたが,転院第8日に急激に呼吸不全の悪化を認め,ECMOを導入した。ECMO導入時の胸部X線を図4aに示す。右大腿静脈脱血,右内頸静脈送血によるveno-venous ECMOで,導入時の条件は血液流量4.5L/分,酸素送気はFIO2 1.0で4.5L/分だった。ECMO使用中の人工呼吸器設定はlung rest設定であるpressure controlled ventilation(PCV),FIO2 0.21,PEEP 10cmH2O,pressure control(PC)5cmH2Oとした。ECMO中の抗凝固療法は活性化全血凝固時間を基準にヘパリンの持続静脈注射を調整し,抗菌薬はセフトリアキソンを併用した。転院第16日にECMOからの離脱を試みたが,PCV設定(PEEP 15cmH2O,PC 15cmH2O)でも1回換気量が約300mL程度と,肺の十分な膨張が得られず,自己肺換気での呼吸維持が困難であり離脱を断念した。この時の胸部X線画像を図4bに示す。転院第17~23日(ECMO導入から9~16日目)の間,気道陽圧開放換気(airway pressure release ventilation:APRV)設定(FIO2 0.21,最大吸気圧26cmH2O,最低圧0cmH2O)で1日5時間のリクルートメント手技を施行した。転院第23日(ECMO導入16日目)に自己肺換気での呼吸維持が可能となったため,ECMOを離脱した。この時の胸部X線画像を図4cに示す。同日の血液培養でEnterococcus faeciumが検出されたため,ダプトマイシンを開始した。ECMO離脱後の造影CTで両側腸骨静脈の深部静脈血栓症を認めたため,ヘパリンを継続した。ECMO離脱直後はPCV設定(FIO2 0.6,PEEP 8cmH2O,PC 12cmH2O)で人工呼吸器管理を行い,徐々にウィーニングした後,転院第27日目に抜管となった。四肢と体幹の廃用による筋力低下が著しく,抜管後は看護師介助下でベッド上座位,端座位訓練とタブレット端末を用いたリハビリ動画視聴下で下肢リハビリを開始した。嚥下機能の低下はなく,転院第33日目より経口摂取を開始した。理学療法士から看護師へのリハビリ指導下で転院第34日に介助下での立位保持が可能となった。転院第36日に発熱があり,タゾバクタム・ピペラシリンを開始した。血液培養の結果から播種性カンジダ血症が判明し,ミカファンギンを開始し速やかに改善した。転院第38日に酸素吸入を離脱し,転院第41日にICUを退室した。転院第44日目から深部静脈血栓症に対するヘパリンの持続静脈注射をアピキサバン10mg/日の内服に切り替えた。SARS-CoV-2 PCRの2回連続陰性確認から14日後の転院第44日に理学療法士によるリハビリ介入を開始した。転院第47日には室内歩行訓練を開始した。合併症もなく状態安定していたため,転院第58日にリハビリの継続を目的に,紹介元の前医に再度転院となった。再転院前の胸部X線およびCT画像を図5に示す。再転院先で約1カ月のリハビリを継続し,最終的に自力歩行可能となり自宅退院となった。
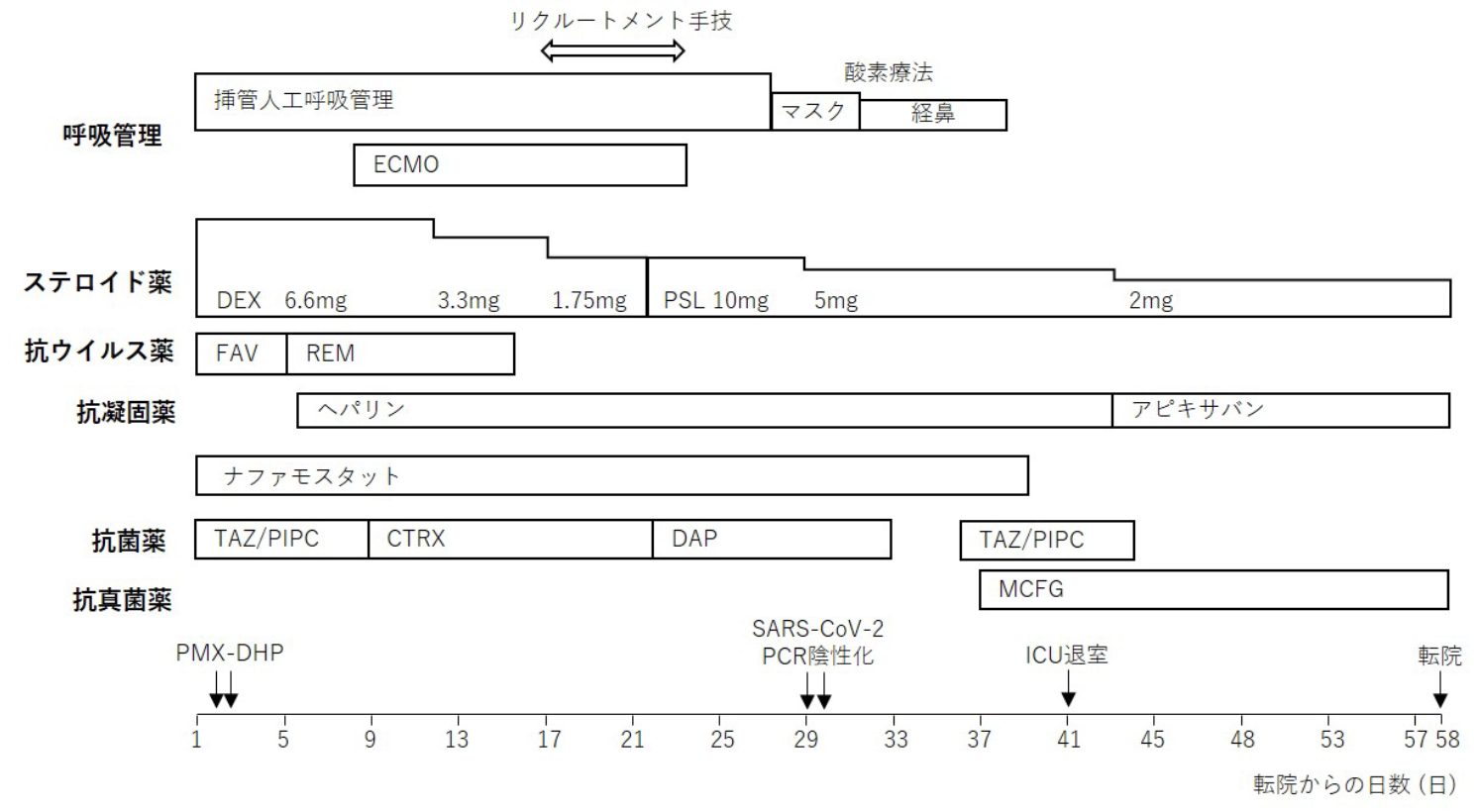
図3 呼吸管理および薬物療法の経過
CTRX: ceftriaxone(セフトリアキソン),DAP: daptomycin(ダプトマイシン),DEX: dexamethasone(デキサメタゾン),FAV: favipiravir(ファビピラビル),MCFG: micafungin(ミカファンギン),PSL: prednisolone(プレドニゾロン),PMX-DHP: ポリミキシンB固定化線維カラムを用いた直接血液灌流法,REM: remdesivir(レムデシビル),TAZ/PIPC: tazobactam piperacillin(タゾバクタム・ピペラシリン)
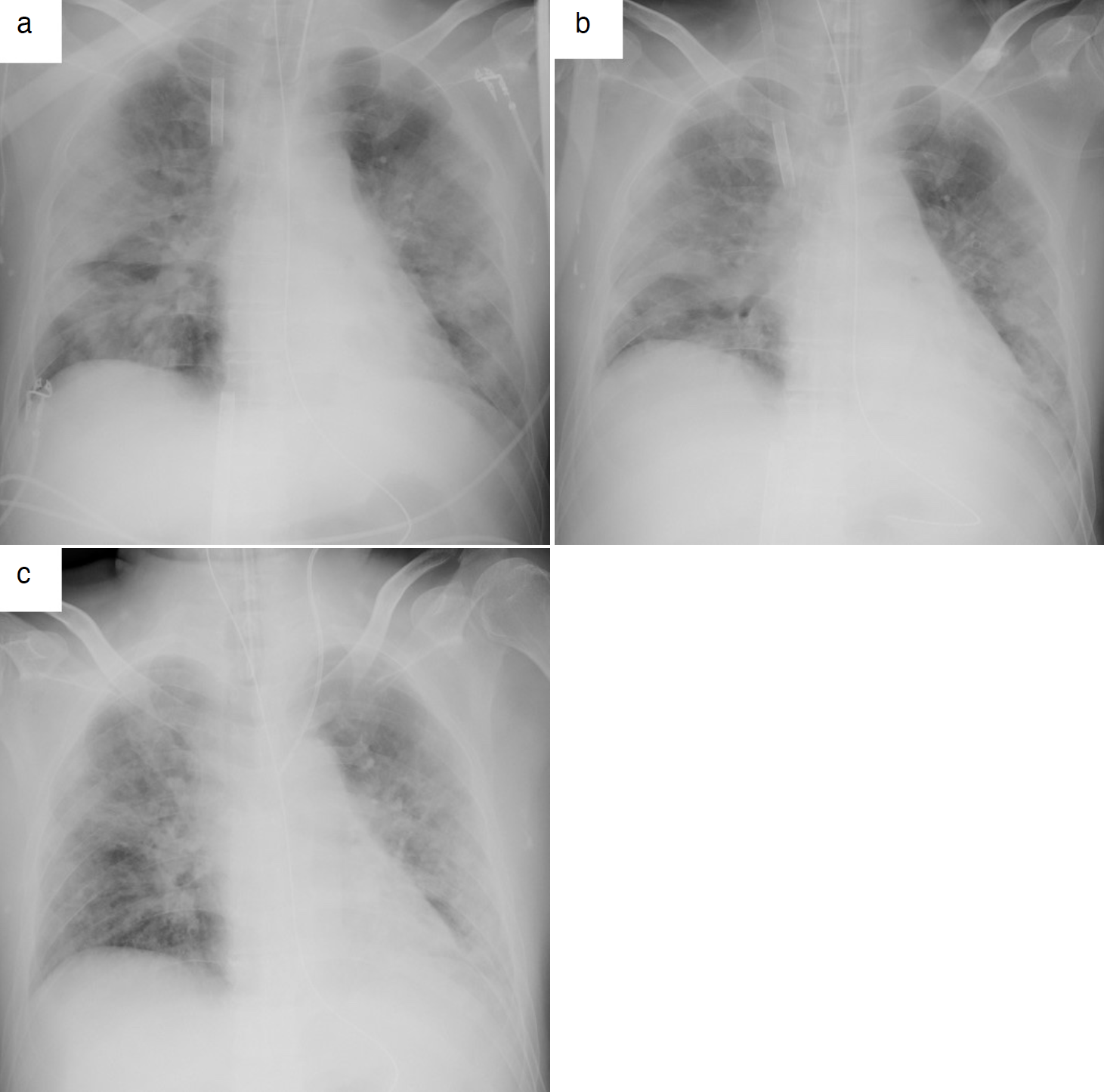
図4 経過中の胸部X線画像
a. ECMO導入直後。両肺辺縁主体に浸潤影を認めた。
b.リクルートメント手技開始前。右中肺野辺縁に浸潤影および両肺全体にすりガラス影を認めた。
c. ECMO離脱後。リクルートメント手技開始前と比較して,右中肺野辺縁の浸潤影の改善および容積減少の改善を認めた。
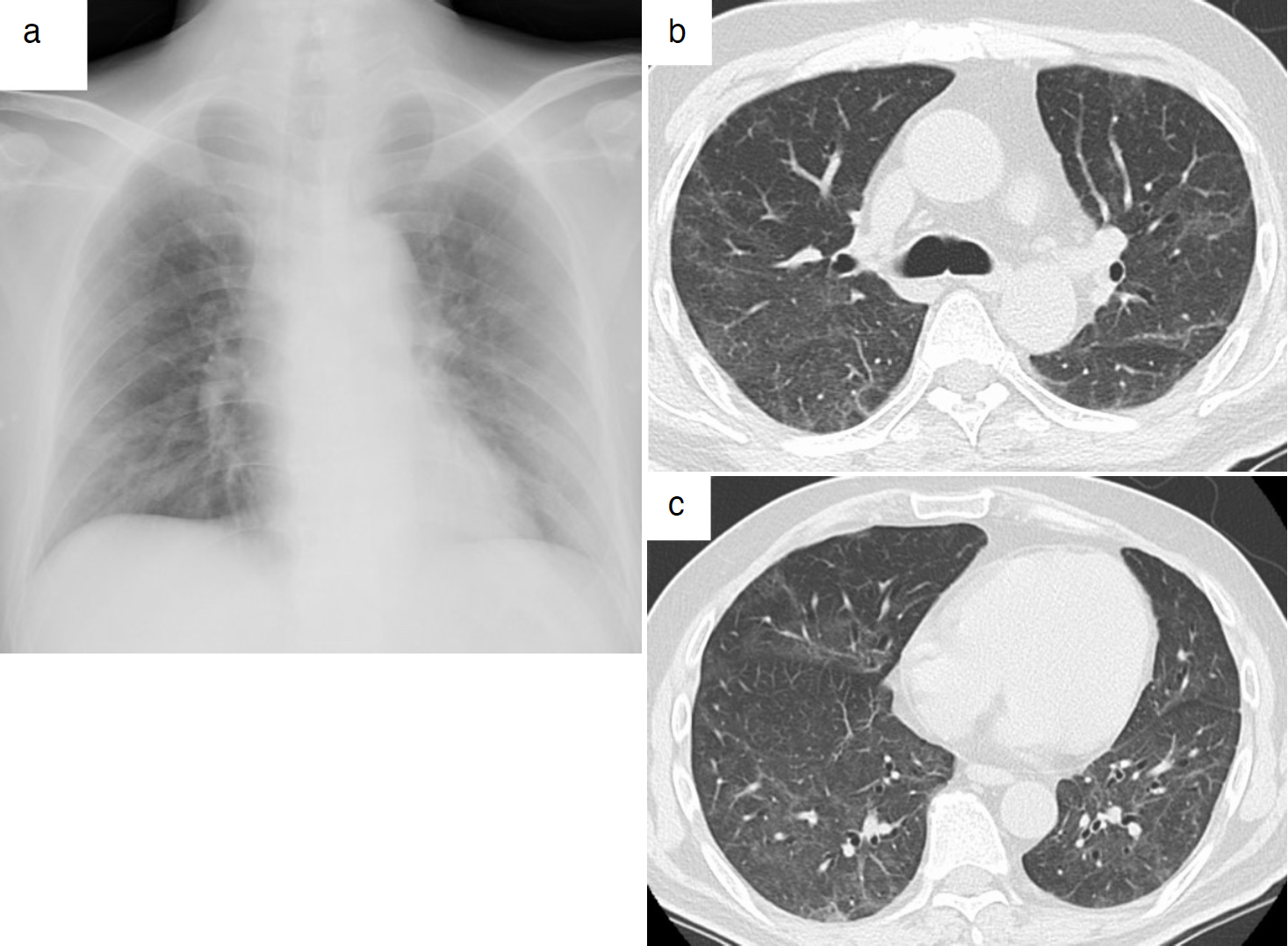
図5 再転院前の胸部X線画像と胸部CT
a. 胸部X線画像では両肺のすりガラス影および浸潤影は消退した。
b, c. 胸部CTでは両肺びまん性のすりガラス陰影や浸潤影が消退した。
本症例では抗ウイルス薬としてファビピラビルおよびレムデシビル,抗炎症薬としてデキサメタゾンによる治療が行われたものの,発症10日目にCOVID-19による重症ARDSに進展し,挿管人工呼吸器管理となり,更なる呼吸不全の悪化に伴いECMO導入となった。長期臥床に伴い,肺胞と気道が虚脱したため,ECMO離脱に際して肺リクルートメント手技が有用となった。なお,流行第2波当時,バリシチニブは承認されておらず,ナファモスタットが有効と考えられていたため,本症例でも使用した。
COVID-19の臨床経過は,流行初期の中国での検討では,約80%が無症候性または軽症のまま治癒し,14%は発症から7〜10日程度で酸素投与が必要になり,5%が急激な低酸素血症で人工呼吸器管理を要し,さらに呼吸不全の悪化があればECMO導入を必要とすると報告されている[2]。ARDSにおいては,人工呼吸器管理による陽圧換気と肺の過伸展は人工呼吸器関連肺損傷を生じる可能性があり[4],重症ARDSに陥ったCOVID-19肺炎では肺保護戦略としてECMO導入が検討される[5]。しかしながら,COVID-19に対するECMO導入については,慎重かつ総合的な判断が必要であり[6],日本のECMOnetによる指針では,人工呼吸器設定でPEEP 10cmH2OでPaO2/FIO2比100以下かつ進行性に悪化する場合がECMO導入の目安とされている[7]。ECMO導入時期について,国際的なコホート研究で挿管からECMO装着までの日数が中央値4日(四分位範囲1.8〜6.4日)で院内死亡には関連しなかったという報告[8]や,挿管して10日以上後にECMOが開始されると治療成功の確率は低いとされる[9]。ECMO使用期間の中央値は13.9日と報告されている[8]。本症例は,比較的若年で挿管7日目にECMOを導入し,効果が得られたが,ECMO装着期間は延長し,離脱できるまで16日間を要した。ECMO離脱に際して,PCV設定では十分な1回換気量が得られず,コンプライアンス低下が顕著であった。その原因として,肺がすでに線維化してしまった可能性と,肺胞および末梢気道が高度に虚脱した可能性が挙げられたが,転院時のCT画像およびECMO中は仰臥位の時間が長かったことから後者をより強く疑い,人工呼吸器設定のAPRVモードを用いることで,リクルートメント手技を行った結果,十分な肺の膨張を認め,ECMO離脱に至った。実際に改善後のCT画像では背側の浸潤影は軽快しており,陰影の残存は軽微であった(図5)。COVID-19では,ECMO使用中にresting lungをどのように維持するかを含め,装着期間や離脱に向けた呼吸管理法に関する明確な規定はない。リクルートメント手技は,虚脱した気道と無気肺を開通させるために有用な手段である一方で[10],本症例(最高圧26cmH2O)のように比較的高い気道内圧が負荷される。そのため,肺の炎症状態によっては肺保護戦略に逆行し,人工呼吸器関連肺損傷を惹起するかもしれない,というジレンマが生じる。Xiらは,ARDSに対してhigh PEEPなどの共介入なしで,リクルートメント手技の使用を検討したランダム化比較試験を行った。その結果,リクルートメント手技の使用により死亡率が有意に低下したと報告している[11],この研究結果などに基づき,2017年に発表されたARDSの呼吸管理に関する米国と欧州のガイドラインでは条件付き推奨とされている[12]。Ballらは,イタリアの単施設において,人工呼吸器装着下の重症新型コロナウイルス肺炎に対するPEEPによる肺胞リクルートメントの効果を検討し,PEEP値8cmH2Oと比較してhigh PEEP(16cmH2O)によるリクルートメント効果およびガス交換能の有効性は限定的であったと報告している[13]。COVID-19によるARDSは,従来の他の原因によるARDSと多くの共通の特徴を有することから呼吸管理も類似するが,COVID-19に伴うARDSでは,従来のARDSに比して肺コンプライアンスの低下が低酸素血症の程度に比して軽度であることも確認されており[14],リクルートメント手技の適応は個々の病態を評価して検討する必要がある。今回は,ECMO管理中に腹臥位療法が行えなかったことが肺と気道の虚脱に深く関わったと考えられた。ECMO離脱については,離脱時期に加え,離脱に向けた人工呼吸器設定に関する適切な対応が必要である。
重症COVID-19では,ECMOを含めた全身管理に伴うカテーテル挿入,人工呼吸器管理,ステロイド治療などによる免疫抑制に伴い,カテーテル感染症や人工呼吸器関連肺炎などの二次感染が重要な合併症と位置づけられる[15][16][17]。本例では,人工呼吸器離脱後にカンジダ血症を伴ったが,ミカファンギンにより速やかに改善した。二次感染もしくはその予防のため抗菌薬治療が併用される場合が多いことから,耐性菌感染症や,カンジダ血症を含む真菌感染症に留意することが重要である[18][19]。
本症例では,人工呼吸器離脱後,歩行訓練開始まで20日を要した。重症COVID-19においては,人工呼吸器管理中の鎮静薬の使用,ステロイド治療に伴い,ICU-acquired weaknessによる筋力低下と極期を乗り越えた後の離床困難が問題となる。本例では,看護師が挿管管理後から可及的にリハビリを行った。ECMO使用中も体位変換およびROM訓練を行い,ECMO離脱後も端座位,車いす座位を行うことにより早期離床を図った。その結果,大きな合併症を伴わずに離床を促すことができた。ICU管理を要した重症COVID-19患者における早期リハビリの有用性が示唆されている。Thomasらは,急性期病院におけるCOVID-19患者に対する理学療法として,他動および自動関節運動,端座位,座位バランス,歩行練習などを推奨している[20]。しかしながら,厳重な感染防御策をとった上で行えるリハビリの内容には制限があり,身体機能回復が遅延することもありうる。COVID-19とフレイルの重症度(clinical frailty scale:CFS)の相関を調査した研究では,フレイルが重度の患者ほど入院期間が長期間になり,死亡率も上昇すると報告されている[21]。本症例はCOVID-19の重症化のリスク因子[22][23]として糖尿病を有していたが,比較的若年であり,CFSが2点と活動性も良好であったことから,回復につながったと考えられる。挿管下のCOVID-19重症例のリハビリに関して,医療従事者に対するワクチン接種が進んでいるものの,感染対策を包括した介入法の確立が必要と考えられる。
謝辞:多大なる貢献をいただいた,愛知医科大学病院のスタッフの皆様に深謝致します。
本論文の要旨は第7回日本呼吸ケア・リハビリテーション学会東海支部学術集会(2021年4月3日Web開催)で発表した。
著者のCOI開示:本論文発表内容に関して特に申告すべきものはない。