森川 昇*1,石田真樹*2,鈴本 潤*2,坂口 才*2,土谷美知子*2,石橋孝文*3,長坂行雄*4,
*1市立奈良病院呼吸器内科(〒630-8305 奈良県奈良市東紀寺町50-1)
*2洛和会音羽病院呼吸器内科,*3,同血液内科,*4,同洛和会京都呼吸器センター
A case of lung adenocarcinoma complicated pancytopenia due to aplastic anemia successfully treated with immune checkpoint inhibitors
Noboru Morikawa*1,,Masaki Ishida*2,Jun Suzumoto*2,Chikara Sakaguchi*2,Michiko Tsuchiya*2,Takafumi Ishibashi*3,Yukio Nagasaka*4
*1Department of Respiratory Medicine, Nara City Hospital, Nara
*2Department of Respiratory Medicine, *3Department of Hematology, *4Rakuwakai Kyoto Pulmonary Center, Rakuwakai-Otowa Hospital, Kyoto
Keywords:肺腺癌,再生不良性貧血,免疫チェックポイント阻害薬,アテゾリズマブ,アブスコパル効果/lung adenocarcinoma, aplastic anemia, immune checkpoint inhibitors, atezolizumab, Abscopal effect
呼吸臨床 2020年4巻8号 論文No.e00109
Jpn Open J Respir Med 2020 Vol. 4 No. 8 Article No.e00109
DOI: 10.24557/kokyurinsho.4.e00109
受付日:2020年3月18日
掲載日:2020年8月11日
©️Noboru Morikawa, et al. 本論文はクリエイティブ・コモンズ・ライセンスに準拠し,CC-BY-SA(原作者のクレジット[氏名,作品タイトルなど]を表示し,改変した場合には元の作品と同じCCライセンス[このライセンス]で公開することを主な条件に,営利目的での二次利用も許可されるCCライセンス)のライセンシングとなります。詳しくはクリエイティブ・コモンズ・ジャパンのサイト(https://creativecommons.jp/)をご覧ください。
現病歴:73歳女性。X年7月中頃から嗄声の自覚があり,近医受診して当院耳鼻科に紹介となった。同月末,耳鼻科受診して喉頭ファイバーで右声帯固定と頸部エコーで両側頸部リンパ節腫脹を認めた。PET-CTでは両側頸部リンパ節にFDG集積,右上葉に5mm径の結節陰影を認めた。肺癌を疑われて当科に紹介となった。
既往歴:特記なし。
家族歴:特記なし。
嗜好歴:never smoker。
常用薬:なし。
職業歴:専業主婦。
入院時現症:PS 0,両側頸部にリンパ節腫脹あり。弾性硬,圧痛なしで左優位。鎖骨上窩,腋窩,滑車上にはリンパ節触知せず。呼吸音・清,左右差なし。心音・整,心雑音なし。ばち指なし。
入院時検査所見(表1):末梢血;白血球3100/μL(Neu 45.4%,Ly 47.7%,Mo 4.6%,Eo 2.0%),ヘモグロビン10.1g/dL,血小板70×103,網赤血球2.0%。生化学;Na 141mEq/L,K 3.9mEq/L,Cl 105mEq/L,CEA 207.7ng/mL,SLX 43U/mL,SCC 2.3ng/mL,pro-GRP 42.1pg/mL。
表1 血液検査所見
胸部X線所見:特記すべき異常所見なし。
CT所見:右上葉に5mm径の腫瘤陰影。左優位に両側頸部リンパ節腫脹あり,最大で17.5mm。鎖骨上窩,縦隔,肺門部にリンパ節腫脹あり(#1R,#1L,#2R,#3a,#4R,#6,#10R)。遠隔転移所見なし(図1)。
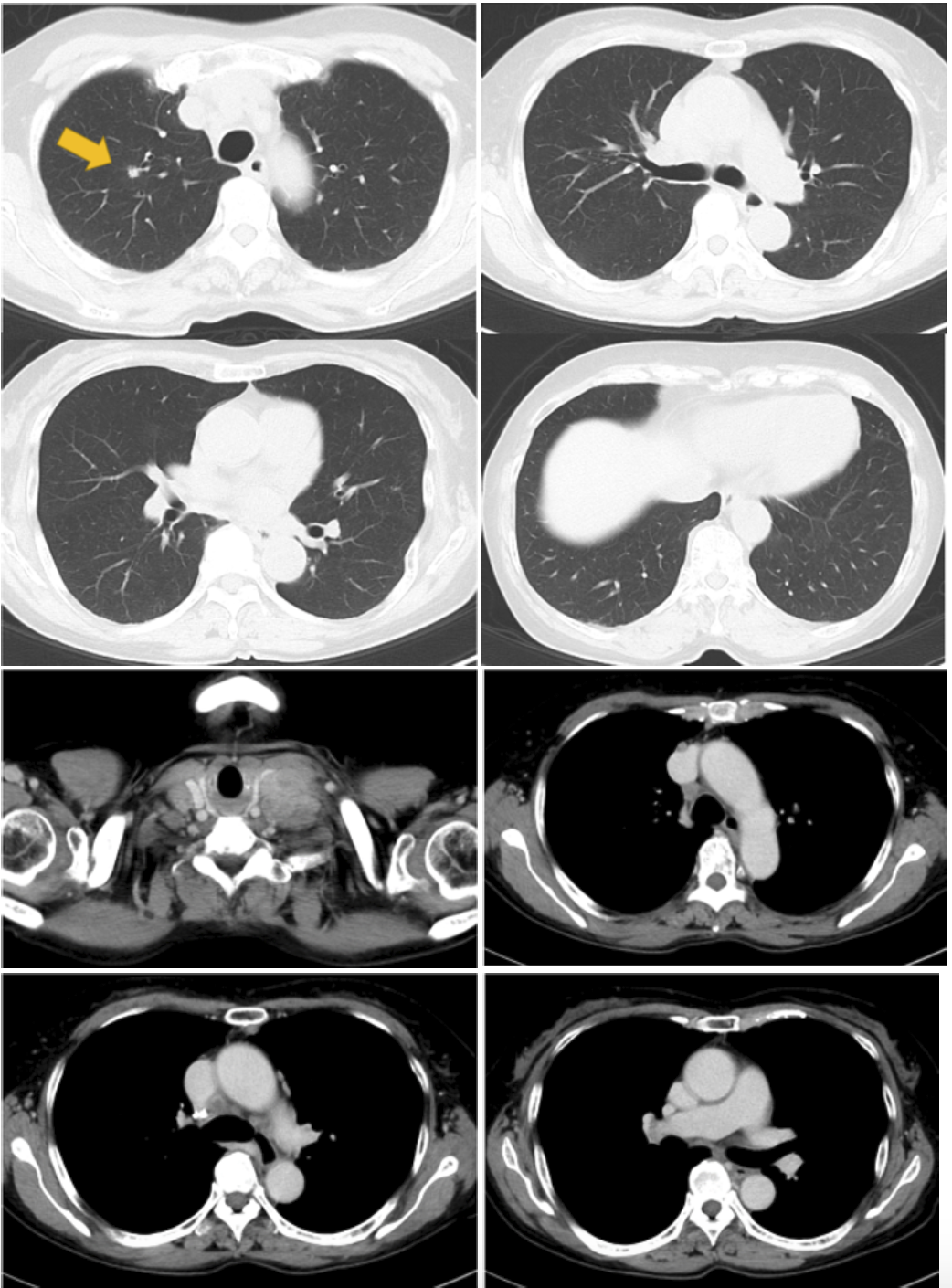 図1 治療前胸部CT
図1 治療前胸部CT
頭部造影MRI:転移なし。
臨床経過:右上葉の腫瘤陰影は気管支鏡でのアプローチが困難であることから,耳鼻科に依頼して頸部リンパ節生検を行った。頸部リンパ節生検の病理像から,転移性の腺癌で免疫染色では,陽性;TTF-1,CK-7,陰性;napsinA,p40,CK5/6,CK20であった。以上より肺腺癌の頸部リンパ節転移と診断した。生検検体からPD-L1を測定(Tumor Proportion Score)してPD-L1:100%であった。網羅的な遺伝子検索を行い,遺伝子変異はすべて陰性であった。また,PET-CT/頭部MRIの結果からcT1aN3M0 stageIIIBと病期診断した。
汎血球減少も認められたので血液内科にコンサルトした。骨髄検査ではdry tapなし,骨髄中に腫瘍細胞なし。有核細胞数・巨核球数ともに著減しており,骨髄低形成の状態であった。脊椎MRI施行した。脂肪髄(T1強調像で高信号,T2強調脂肪抑制像で低信号)がまだらにあり,残存する骨髄が代償的に活性化して一部赤色髄(T1/2強調像で低信号,T2強調脂肪抑制像で高信号)となっている状態であった。厚生労働省特発性造血障害に関する調査研究班から出される基準を満たし再生不良性貧血の診断に至った[1]。
また,本症例では抗核抗体(Discrete)1,280倍以上と高値であった。抗セントロメア抗体陽性,手指の軽度腫大とレイノー現象の病歴があった。当院膠原病科にコンサルトして限局性強皮症の診断となった。症状は軽微であり肺癌治療には支障はないと判断した。
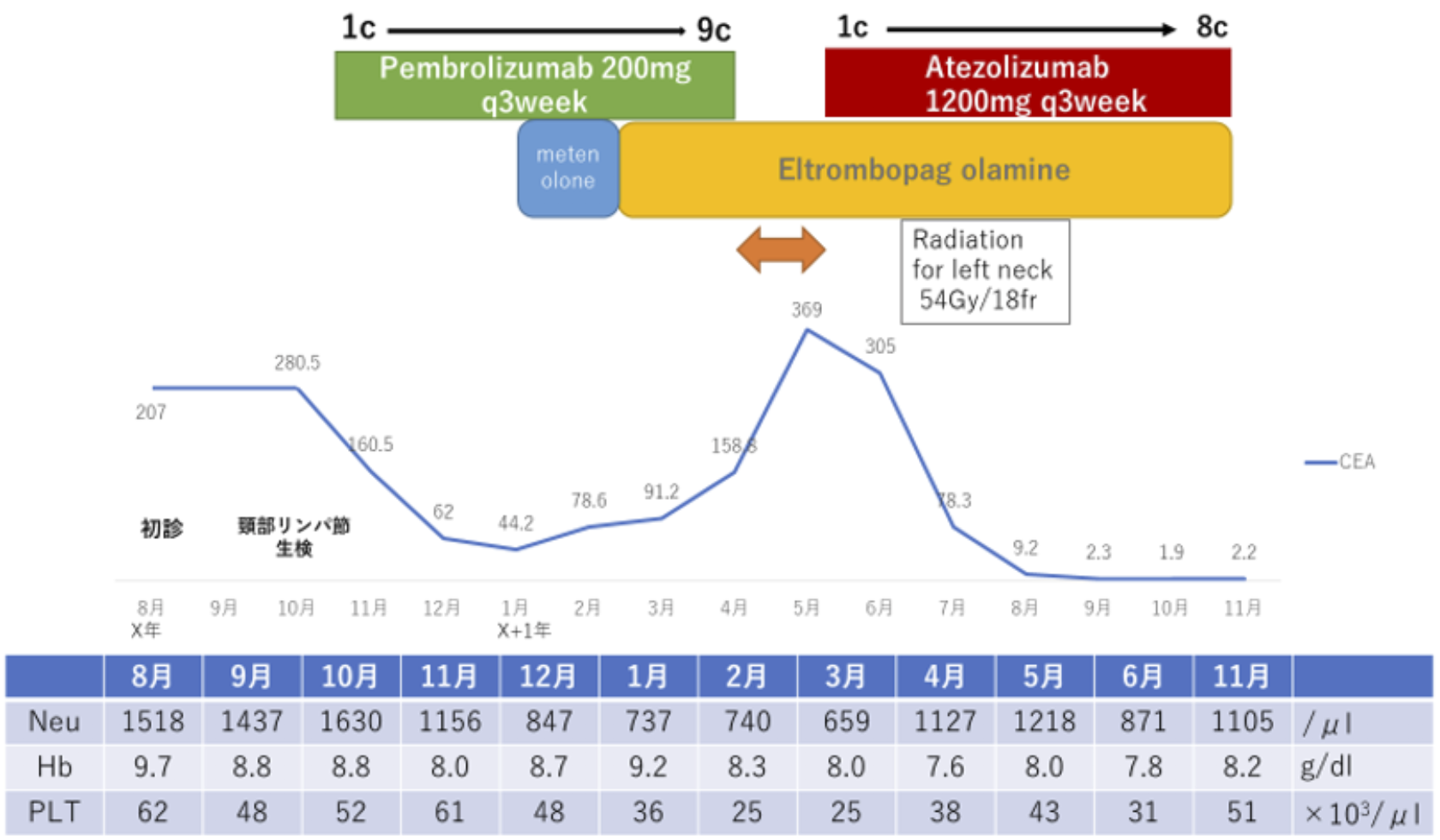
汎血球減少がある状態での化学放射線療法や細胞障害性抗癌薬の使用は避け,患者と相談の上PD-L1 100%であり肺癌に対してペンブロリズマブでの加療を行う方針とした[2]。X年10月末からペンブロリズマブを開始して3コース終了後に効果判定目的でCTを撮影して,右上葉陰影は不変であったものの,頸部リンパ節や縦郭リンパ節に関しては縮小して,腫瘍マーカーも減少していた(図2)。ただし,腫瘍縮小とともに汎血球減少も進行した。しかし,骨髄抑制はGrade3までに留まっていたことから4コース目以降も継続し,血液内科で再生不良性貧血に対して蛋白同化ステロイドを開始した。限局性強皮症に関しては病勢の変化はなかった。
図2 経過表と血球の推移
X+1年1月から開始した蛋白同化ステロイドによる消化器症状が出現して,X+1年2月からエルトロンポバグが開始された。減少していたCEAがX+1年2月から上昇に転じた。9コース施行後に撮影したPET-CTでは,原発巣は著変なく,#1Lは増大傾向かつ初診時にはなかった箇所にFDG集積を認めた。その他頸部・縦隔・右肺門リンパ節に関しては著明に改善してほぼFDG集積はなかった(図3)。治療開始当初はペンブロリズマブPRであったが経過で新たな病変が出現した事からPDと判断した。病巣が左頸部に限局していたことから局所コントロール目的で,X+1年6月から放射線治療を開始した(54Gy/18fr)。放射線治療中は免疫チェック阻害薬(ICI)を一時休薬した。
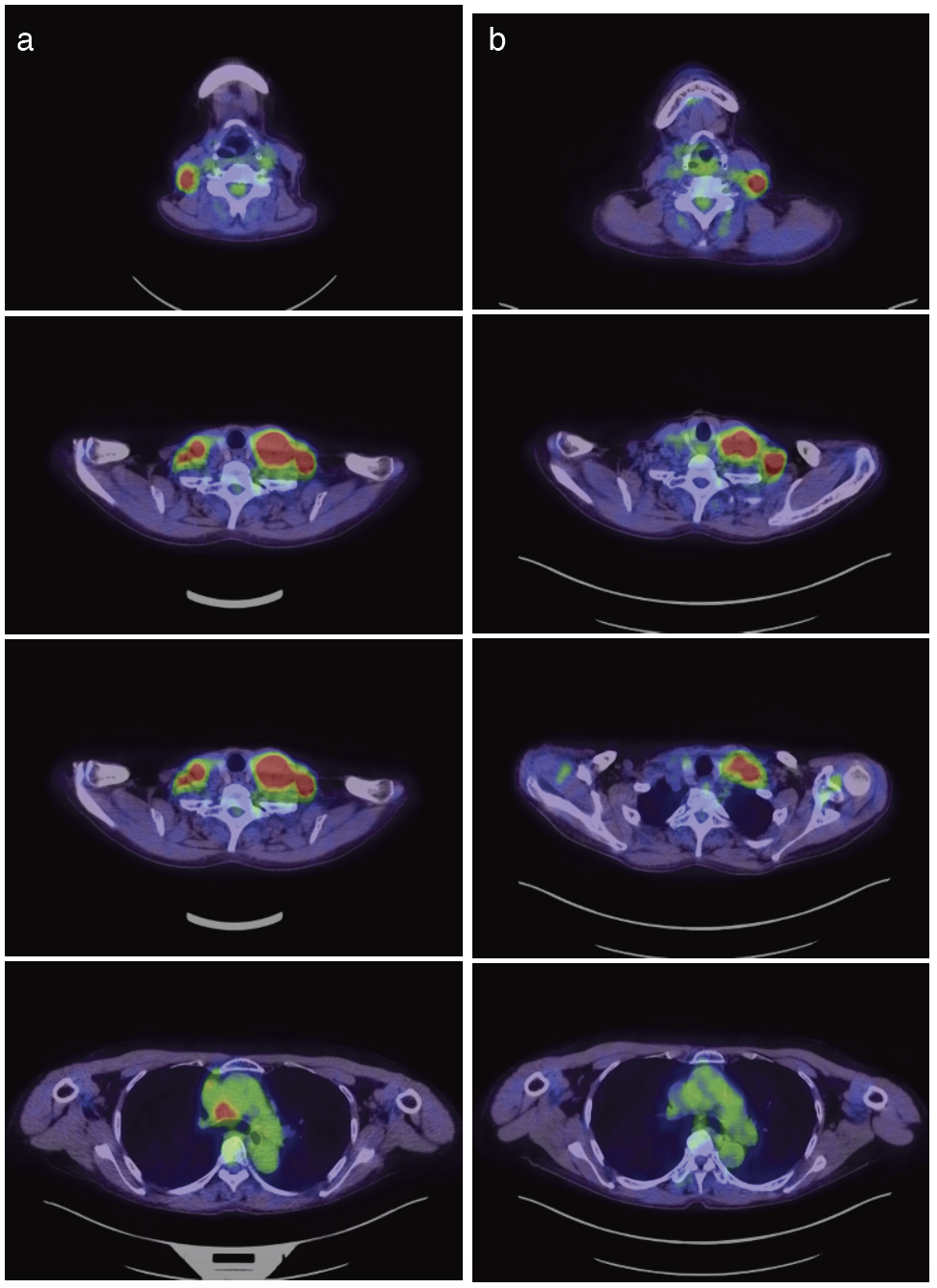
図3 PET-CT
a. 治療前
b. pembrolizumab 7コース施行後
放射線治療終了後のX+1年5月からアテゾリズマブを開始した。CEAは,ピークでは369ng/mlまで上昇したが,アテゾリズマブ開始後から減少に転じて,4コース後に効果判定目的で撮影したPET-CTではCR判定であった。以後外来でアテゾリズマブを継続し,CEA 2ng/ml前後で推移して再発なく良好な経過を辿っている(図2)。
再生不良性貧血は,先天性・後天性・特殊型に分類されるが,後天性では免疫学的機序による造血幹細胞の傷害と造血幹細胞自身の質的異常の2つが重要と考えられている[3]。今回,免疫チェックポイント阻害薬開始に伴い進行した汎血球減少は,免疫賦活による再生不良性貧血の病勢悪化を反映した可能性がある。ただし,本症例では骨髄抑制は進行したもののICIの忍容性を保てたのは,再生不良性貧血の治療を併用した可能性があると思われる。再生不良性貧血の治療として血液製剤での支持療法以外に造血回復を目的とした治療として,蛋白同化ステロイド,免疫抑制薬,エルトロンボパグ,抗ヒト胸腺細胞免疫グロブリン,骨髄移植,臍帯血移植などがある[3]。
本症例ではICIを使用していたことから免疫抑制剤使用には制限があった。73歳と高齢でかつ肺腺癌を合併しており骨髄移植や臍帯血移植は困難で,血液内科にて蛋白同化ステロイドをまず開始したが,消化器症状で継続困難であったことから,エルトロンボパグに変更された。エルトロンボパグは,トロンボポエチン受容体作動薬で特発性血小板減少性紫斑病に対する治療薬で,トロンボポエチン受容体との特異的な相互作用を介して巨核球だけでなく骨髄前駆細胞の増殖及び分化を促進させると言われている。再生不良性貧血の標準治療にエルトロンポバグを加えることで良好な結果が得られ[4],再生不良性貧血へ適応が拡大された。エルトロンボバグの使用で骨髄抑制を抑えながらICIによる腫瘍効果が得られた。
放射線治療後にアテゾリズマブを投与して腫瘍マーカーが減少し,画像上でもリンパ節転移が改善した。KEYNOTE-001試験の二次解析で放射線治療後に免疫チェックポイント阻害薬を投与することでprogression free survival(PFS)が延長した報告がある[5]。放射線治療により腫瘍免疫環境が変化して,免疫チェックポイント阻害薬の効果を増強する可能性が示唆されている。過去の報告で,放射線治療を行うことで照射範囲外にも抗腫瘍効果が認められた症例があり,これをアブスコパル効果と呼んでいる[6]。アブスコパル効果も放射線治療により抗腫瘍免疫が増強される可能性が示唆されている[7]。アブスコパル効果は,放射線治療中に起こる稀な事象と言われていた。しかし,悪性黒色腫の症例であるが,免疫チェックポイント阻害薬と放射線治療を併用した患者の52%にアブスコパル効果が認められた[8]。本症例は放射線治療が局所制御目的で行われ,また免疫チェックポイント阻害薬も使用しているので,縮小効果がアブスコパル効果による可能性はあるが,確実にその効果とは断言できない。免疫チェックポイン阻害薬と,放射線治療を行った事で腫瘍免疫環境が変化して,抗腫瘍効果を発揮した可能性もあると思われた。
本症例は再生不良性貧血による汎血球減少があることと,PD-L1高発現であることから,細胞障害性抗抗癌薬は使用せず,免疫チェックポイント阻害薬であるペンブロリズマブを1st lineで投与開始したがPDとなり,局所制御目的で放射線治療を行い,アテゾリズマブに変更して腫瘍の病勢コントロール良好でかつ,汎血球減少も許容範囲内で輸血も行わずに経過し忍容性が保たれた。今後,免疫学的機序による汎血球減少を起こす疾患に肺癌が合併した時にはICIは治療選択肢になるが,原疾患の悪化に注意し,必要に応じて専門科と協力して診療を行う必要がある。
再生不良性貧血患者にICIを投与した同様の報告は検索した限りではなく,貴重な症例と考えた。
本論文の要旨は第92回日本呼吸器学会近畿地方会で発表した。
利益相反の有無:本発表における利益相反は,共著者含めてなし。

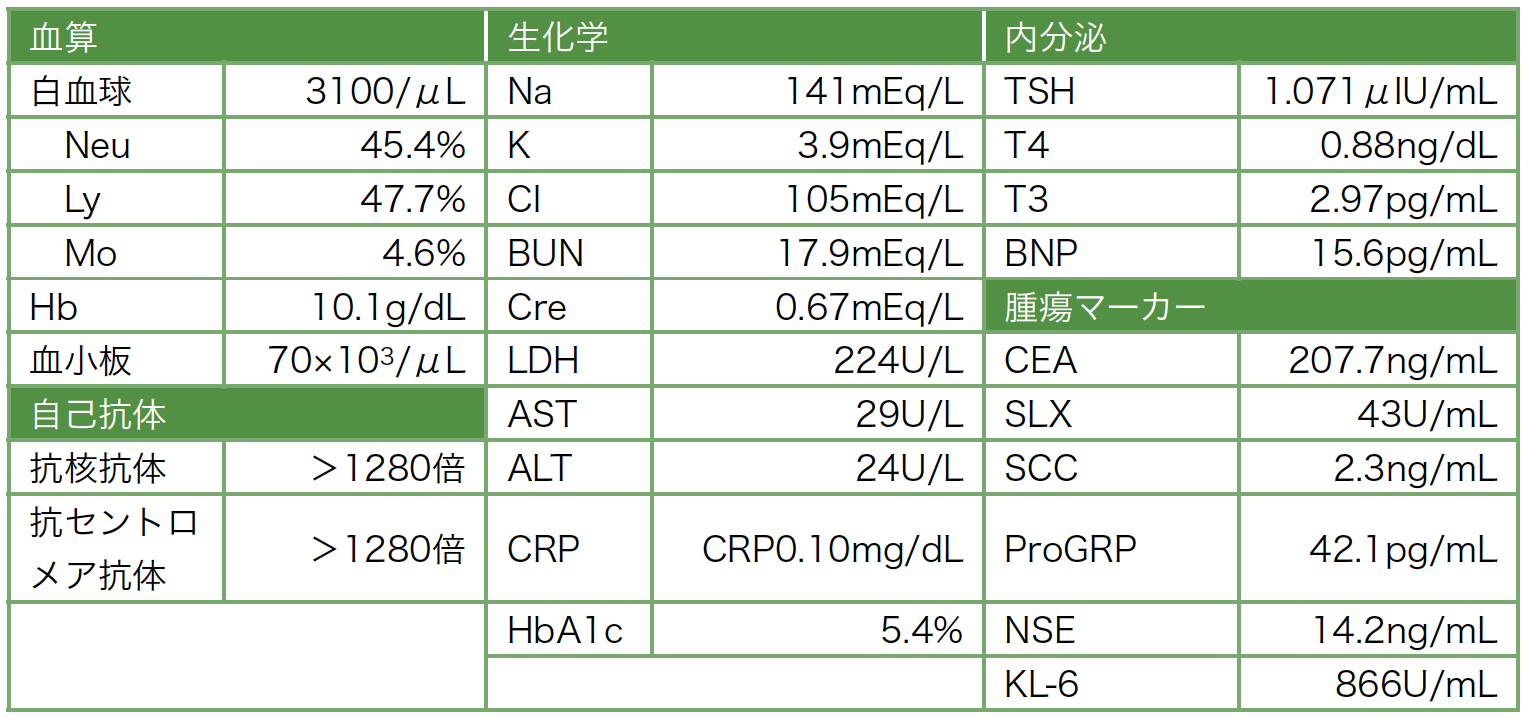
 図1 治療前胸部CT
図1 治療前胸部CT