島田長茂*,小高倫生*,中野千裕*
,押尾剛志*,大原関利章**,松瀬厚人*
*東邦大学医療センター大橋病院呼吸器内科(〒153-8515 東京都目黒区大橋2-22-36)
**同病理診断科
A case of small cell lung cancer with pineal metastasis
Nagashige Shimada*, Norio Kodaka*, Chihiro Nakano*, Takeshi Oshio*, Toshiaki Oharazeki**, Hiroto Matsuse*
*Division of Respiratory Medicine, Department of Internal Medicine, Toho University Ohashi Medical Center, Tokyo
**Department of Pathology, Toho University Ohashi Medical Center, Tokyo
Keywords:松果体転移,小細胞肺癌/pineal region metastasis, small cell lung cancer
呼吸臨床 2021年5巻6号 論文No.e00131
Jpn Open J Respir Med 2021 Vol. 5 No. 6 Article No.e00131
DOI: 10.24557/kokyurinsho.5.e00131
受付日:2021年4月1日
掲載日:2021年6月29日
©️Nagashige Shimada, et al. 本論文はクリエイティブ・コモンズ・ライセンスに準拠し,CC-BY-SA(原作者のクレジット[氏名,作品タイトルなど]を表示し,改変した場合には元の作品と同じCCライセンス[このライセンス]で公開することを主な条件に,営利目的での二次利用も許可されるCCライセンス)のライセンシングとなります。詳しくはクリエイティブ・コモンズ・ジャパンのサイト(https://creativecommons.jp/)をご覧ください。
患者:51歳,男性。
主訴:頭痛,意識障害。
既往歴:高血圧症。
家族歴:特記すべき事項なし。
生活歴:喫煙 30本/日,飲酒 機会飲酒。
現病歴:20XX-1年11月頃から頭痛や見当識障害が出現。12月上旬に近医にて頭部MRI施行。松果体に腫瘤性病変を認め,脳室の拡大も伴っており,精査加療目的に当院へ紹介となった。
身体所見:意識レベルJCSI-2,身長176cm,体重140kg,体温36.4℃,呼吸数18回/分,脈拍66回/分,血圧128/70mmHg,経皮的動脈血酸素飽和度98%(室内気),頸部リンパ節腫脹なし,呼吸音は清,ラ音は聴取なし。Performance status(PS)は1,認知症スクリーニング検査(Mini-Mental State Examination:MMSE)は14点であった。
検査所見(表1):血清 ProGRPの上昇を認めた。
表1 入院時検査所見
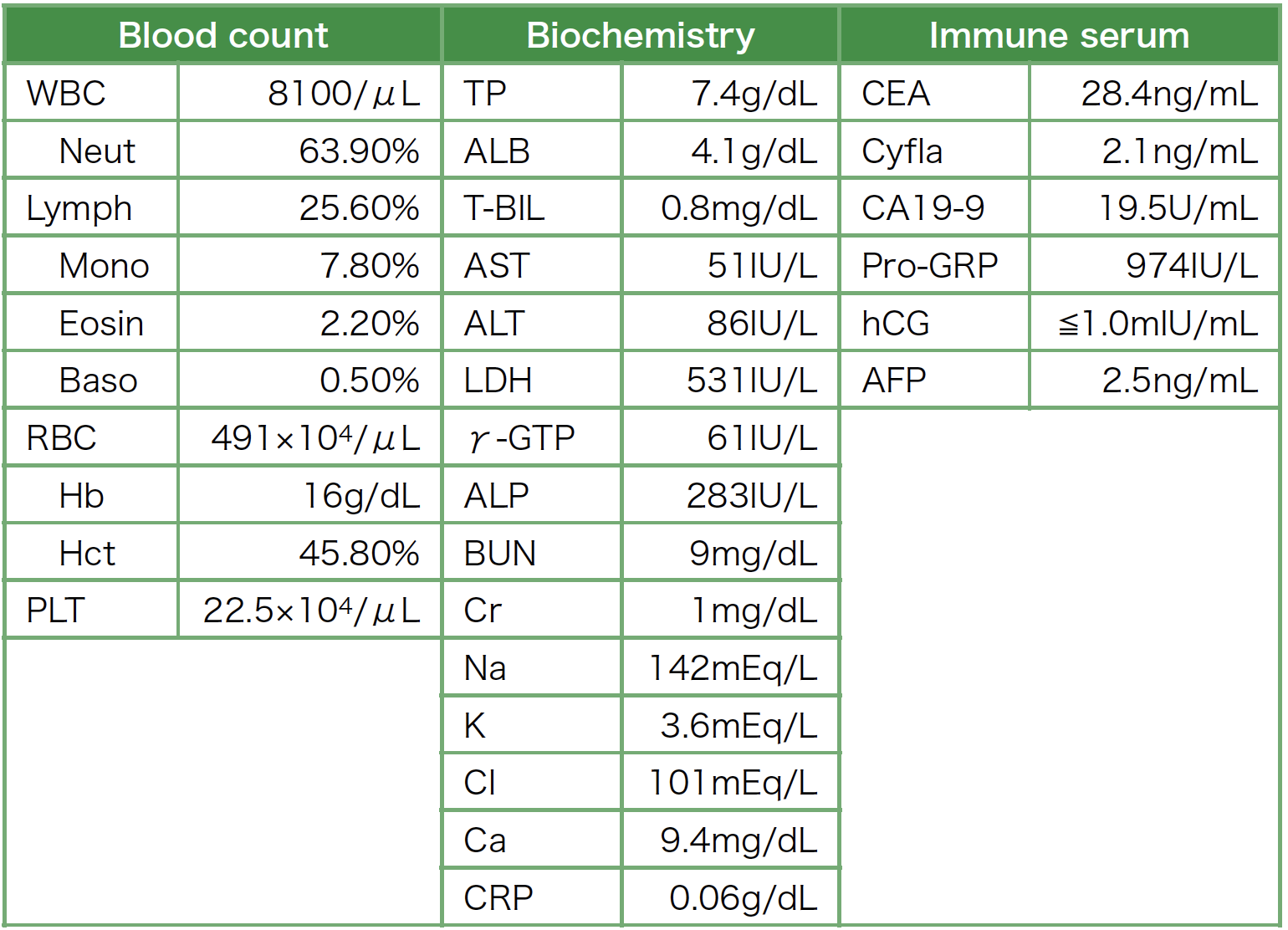
胸部単純X線写真:右肺門の拡大を伴い,右上縦隔に接する頸胸部徴候陰性の腫瘤陰影と右横隔膜の挙上を認める(図1a)。
胸部CT所見:肺野条件では腫瘤により右上葉気管支は閉塞され,無気肺を呈している。造影CT縦隔条件では縦隔リンパ節腫脹と右肺門部に67×46mmの造影効果の乏しい不整形の腫瘤性病変を認める(図1b,c)。
図1 胸部画像所見
a. 胸部単純X線写真:右肺門の拡大を伴い,右上縦隔に接する頸胸部徴候陰性の腫瘤陰影と右横隔膜の挙上を認める。
b. 胸部単純CT所見(肺野条件):腫瘤により右上葉気管支は閉塞され,無気肺を呈している。
c. 胸部造影CT所見(縦隔条件):縦隔リンパ節腫脹と右肺門部に67×46mmの造影効果の乏しい不整形の腫瘤性病変を認める。
頭部MRI所見(T1強調画像):松果体部に石灰化を伴う21×16mmの腫瘤性病変を認め,脳室の拡大を認める(図2)。
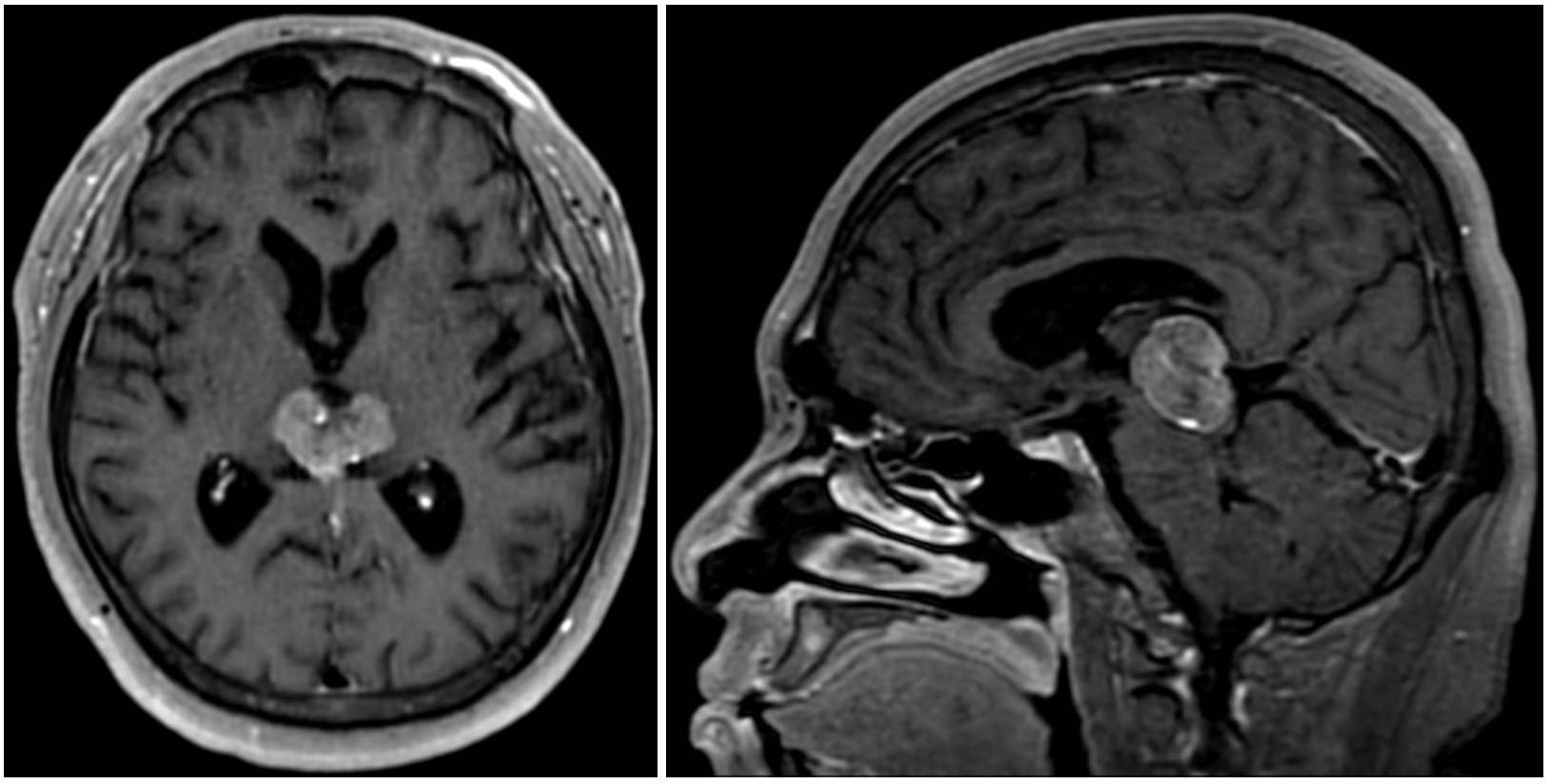
図2 頭部MRI所見(T1強調画像)
松果体部に石灰化を伴う21×16mmの腫瘤性病変を認め,脳室の拡大を認める。
臨床経過:松果体腫瘍による水頭症と診断し,内視鏡下第三脳室底開窓術と腫瘍生検を施行。術後頭痛は改善し,認知機能に関してもMMSE26点まで改善。病理学的所見はHE染色ではN/C比の高い小型の異型細胞の増生を認め,免疫染色ではTTF-1,synaptophysinが陽性,chromogranin Aが陰性であり,さらにPD-L1も陰性であった。その他遺伝子変異は認めなかった。神経内分泌腫瘍と診断され,小細胞肺癌の松果体転移が疑われた(図3)。術後20XX年2月に全脳照射を施行し,その後右肺門部腫瘤に対して気管支鏡検査を施行。松果体腫瘍と類似の病理学的所見が得られ,松果体転移を伴う進展型小細胞肺癌の診断となった。カルボプラチン(carboplatin)AUC5+エトポシド(etoposide)100mg/m2+アテゾリズマブ(atezolizumab)1200mg/body療法を4コース,維持療法としてアテゾリズマブ単剤療法を行い,原発巣・転移巣共に縮小傾向を認めた。併用療法施行中約3カ月後に腰背部痛が出現し,その後突然の両下肢脱力と感覚障害が出現。脊髄MRIにて髄膜癌腫症が判明した(図4)。緊急で全脊髄照射とステロイド加療を行うも効果なく,急激なADL低下のため化学療法継続は困難となった。肺癌の診断約6カ月後に死亡した。
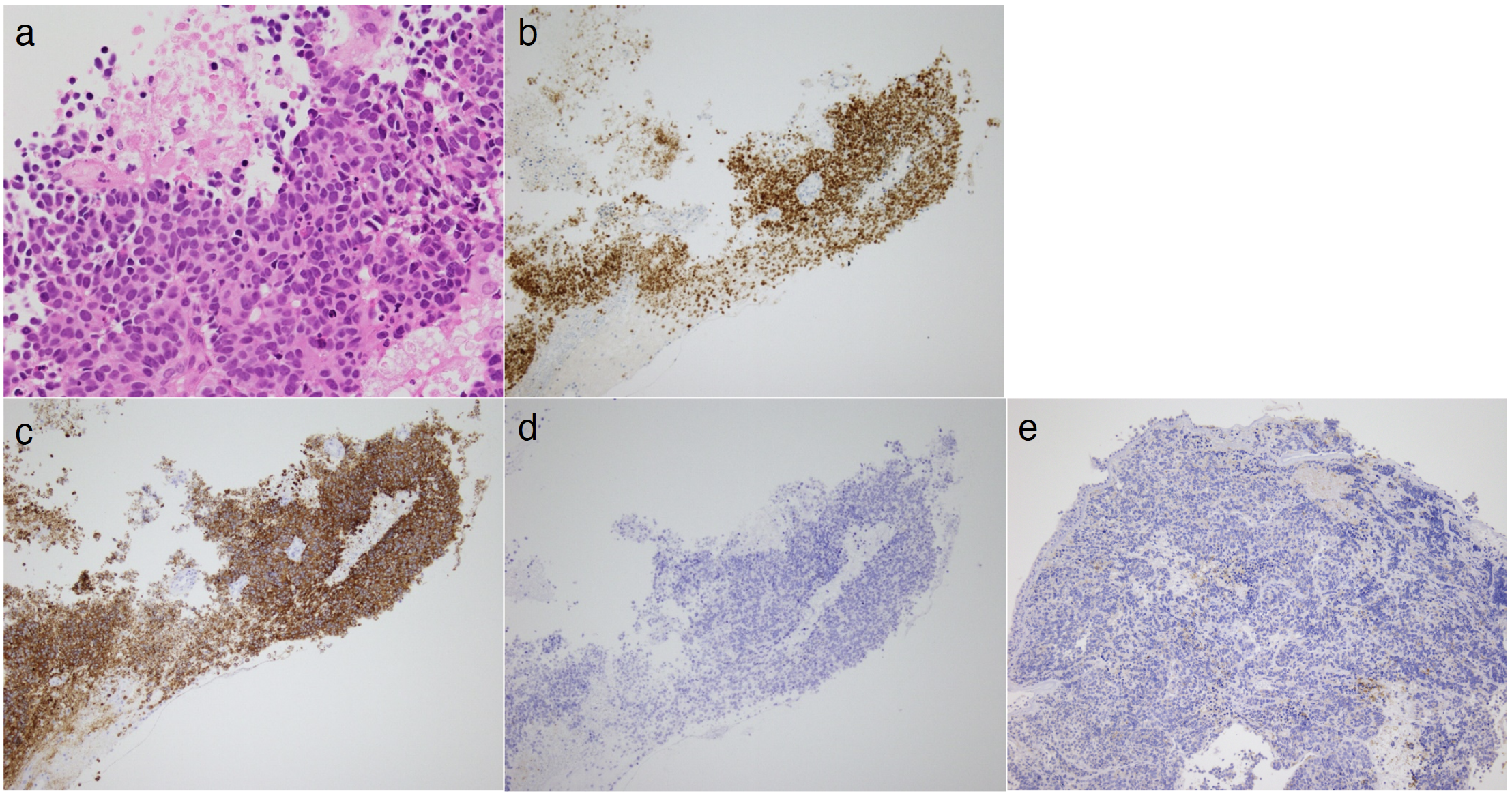
図3 病理学的所見
a. HE染色ではN/C比の高い小型の異型細胞の増生を認める。
b~e:b. TTF-1 陽性,c. synaptophysin 陽性,d. chromogranin A 陰性,e. PD-L1 陰性であった。その他遺伝子変異は認めなかった。
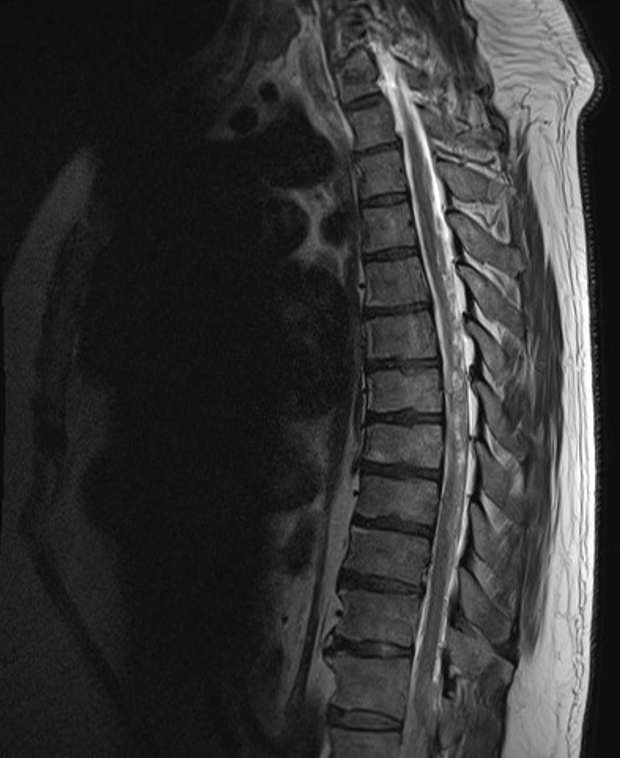
図4 脊髄MRI所見(T2強調画像)
髄膜癌腫症を疑う所見を認める。
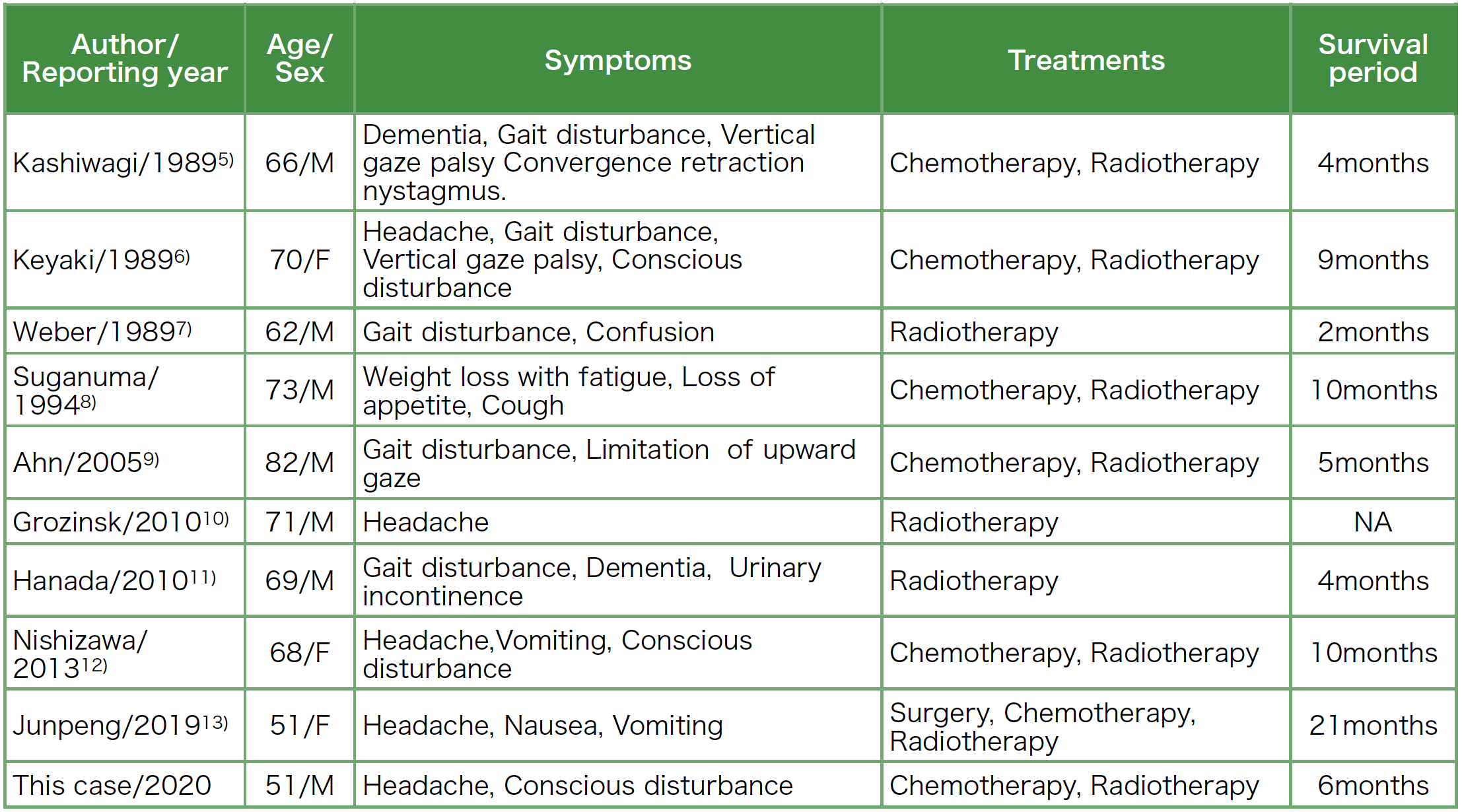
1984年から2000年にかけて報告された本邦の転移性脳腫瘍10,489例のうち,松果体への転移の割合はわずか37例(0.4%)とまれである[1]。原発巣で頻度が高いのが肺癌であり,組織型では小細胞癌が最も多い[2]。転移性松果体腫瘍は死後,剖検により偶然に診断されることが多かったが[3][4],1989年以降には画像診断の進歩により,生前に報告されるようになった。生前に診断された小細胞肺癌の松果体転移の症例報告の特徴を自験例も含めて表2に示す[5]~[13]。松果体転移を伴う肺癌は予後不良であり,全生存期間中央値は5カ月程度と報告されている[12]。表2に示した自検例を除く9症例の特徴としては化学療法に加え,放射線療法を併用した方が予後の改善を示しており,原発巣と中枢神経系のコントロールが重要と考えられる。
表2 過去に報告された松果体転移を伴う小細胞肺癌の症例一覧
小細胞肺癌には標的となるバイオマーカーがなく,新規に治療法が確立されていなかったが近年,臨床試験でPD-1/PD-L1の阻害により小細胞肺癌の抗癌免疫が強化され,無増悪生存期間と全生存期間が延長される可能性があることが示された[14]。カルボプラチンとエトポシドに免疫チェックポイント阻害薬であるアテゾリズマブを上乗せすることで従来よりも予後の改善を認めるようになった。また2020年にはデュルバルマブを上乗せするレジメンも登場し,アテゾリズマブと同様に予後の改善を認めており,治療選択肢の幅が広がりつつある。小細胞肺癌におけるPD-L1発現の陽性率に関するメタアナリシス[15]によると小細胞肺癌では陽性率の推定値は26.0%と50%未満であることに対し,非小細胞肺癌では50~70%の陽性率を示していた。PD-L1発現陽性の小細胞肺癌の方が全生存期間は長くなる傾向にはあるが,統計学的には有意差は認めなかった。生検した腫瘍の大きさや,免疫組織化学評価のカットオフ値,およびPD-L1染色パターンの評価などの要因によって陽性率に不均一性が生じてしまうため,現時点では予後の指標にはならないと考えられる。本症例においても従来の治療よりも予後の改善を期待していたが,肺癌の診断約6カ月後に死亡した。出現した腰痛症状が髄膜癌腫症の兆候と考えるならば,適切かつ早期に全身の化学療法,転移性松果体腫瘍に対する放射線治療を施行することが重要であると考えられ,さらに転移性松果体腫瘍に関して,単発の脳転移に対して全脳照射に定位放射線照射を加えることで予後延長を示す報告[16]があるように,転移性松果体腫瘍に対してγナイフといった定位放射線照射を追加することで,予後の延長が期待できる可能性があると考えられる。免疫チェックポイント阻害薬併用の化学療法が標準治療として確立されるようになったとしても,今後も臨床試験結果が一般診療においても示されるか否かは常に慎重に判断する必要がある。依然として松果体を含めた中枢神経系の転移を伴った肺癌の予後は不良であることは変わらない。標的になるバイオマーカーが存在しないため,症例毎に治療戦略を考えていく必要があり,今後の症例の蓄積が必要である。
利益相反:本論文について申告する利益相反はない。